Что относится к имн в медицине
Что относится к имн в медицине
Статья 38. Медицинские изделия
1. Медицинскими изделиями являются любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в сочетании между собой, а также вместе с другими принадлежностями, необходимыми для применения указанных изделий по назначению, включая специальное программное обеспечение, и предназначенные производителем для профилактики, диагностики, лечения и медицинской реабилитации заболеваний, мониторинга состояния организма человека, проведения медицинских исследований, восстановления, замещения, изменения анатомической структуры или физиологических функций организма, предотвращения или прерывания беременности, функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека. Медицинские изделия могут признаваться взаимозаменяемыми, если они сравнимы по функциональному назначению, качественным и техническим характеристикам и способны заменить друг друга.
2. Медицинские изделия подразделяются на классы в зависимости от потенциального риска их применения и на виды в соответствии с номенклатурной классификацией медицинских изделий. Номенклатурная классификация медицинских изделий утверждается уполномоченным федеральным органом исполнительной власти.
3. Обращение медицинских изделий включает в себя технические испытания, токсикологические исследования, клинические испытания, экспертизу качества, эффективности и безопасности медицинских изделий, их государственную регистрацию, производство, изготовление, ввоз на территорию Российской Федерации, вывоз с территории Российской Федерации, подтверждение соответствия, хранение, транспортировку, реализацию, монтаж, наладку, применение, эксплуатацию, в том числе техническое обслуживание, предусмотренное нормативной, технической и (или) эксплуатационной документацией производителя (изготовителя), а также ремонт, утилизацию или уничтожение. Производитель (изготовитель) медицинского изделия разрабатывает техническую и (или) эксплуатационную документацию, в соответствии с которой осуществляются производство, изготовление, хранение, транспортировка, монтаж, наладка, применение, эксплуатация, в том числе техническое обслуживание, а также ремонт, утилизация или уничтожение медицинского изделия. Требования к содержанию технической и эксплуатационной документации производителя (изготовителя) медицинского изделия устанавливаются уполномоченным федеральным органом исполнительной власти.
(в ред. Федеральных законов от 25.11.2013 N 317-ФЗ, от 11.06.2021 N 170-ФЗ)
(см. текст в предыдущей редакции)
3.1. Допускаются предусмотренные нормативной, технической и (или) эксплуатационной документацией производителя (изготовителя) транспортировка, монтаж, наладка, настройка, калибровка медицинского изделия и иные действия, необходимые для ввода медицинского изделия в эксплуатацию, применение, эксплуатация, в том числе техническое обслуживание, и ремонт медицинского изделия по окончании срока действия регистрационного удостоверения на это медицинское изделие, если срок службы (срок годности) медицинского изделия не истек.
(часть 3.1 введена Федеральным законом от 30.04.2021 N 128-ФЗ)
3.2. До истечения срока службы (срока годности) медицинских изделий допускается обращение таких изделий, в том числе произведенных в течение ста восьмидесяти календарных дней после дня принятия уполномоченным федеральным органом исполнительной власти решения о внесении изменений в документы, содержащиеся в регистрационном досье на медицинское изделие, в соответствии с информацией, содержащейся в таких документах до дня принятия указанного решения.
(часть 3.2 введена Федеральным законом от 30.04.2021 N 128-ФЗ)
3.3. Действие требований, установленных частью 3 настоящей статьи, может быть изменено в отношении участников экспериментального правового режима в сфере цифровых инноваций в соответствии с программой экспериментального правового режима в сфере цифровых инноваций, утверждаемой в соответствии с Федеральным законом от 31 июля 2020 года N 258-ФЗ «Об экспериментальных правовых режимах в сфере цифровых инноваций в Российской Федерации», с учетом требований, установленных правом Евразийского экономического союза.
(часть 3.3 введена Федеральным законом от 02.07.2021 N 331-ФЗ)
4. На территории Российской Федерации разрешается обращение медицинских изделий, прошедших государственную регистрацию в порядке, установленном Правительством Российской Федерации, и медицинских изделий, прошедших регистрацию в соответствии с международными договорами и актами, составляющими право Евразийского экономического союза. Действие данных требований может быть изменено в отношении участников экспериментального правового режима в сфере цифровых инноваций в соответствии с программой экспериментального правового режима в сфере цифровых инноваций, утверждаемой в соответствии с Федеральным законом от 31 июля 2020 года N 258-ФЗ «Об экспериментальных правовых режимах в сфере цифровых инноваций в Российской Федерации», с учетом требований, установленных правом Евразийского экономического союза.
(в ред. Федеральных законов от 30.04.2021 N 128-ФЗ, от 02.07.2021 N 331-ФЗ)
(см. текст в предыдущей редакции)
5. На территории Российской Федерации не регистрируются:
1) медицинские изделия, перечисленные в пункте 11 статьи 4 Соглашения о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза от 23 декабря 2014 года;
Со 02.01.2027 п. 2 ч. 5 ст. 38 утрачивает силу (ФЗ от 30.04.2021 N 128-ФЗ).
2) медицинские изделия, ввезенные на территорию Российской Федерации для оказания медицинской помощи по жизненным показаниям конкретного пациента на основании разрешения, выданного в порядке, установленном Правительством Российской Федерации, уполномоченным федеральным органом исполнительной власти, осуществляющим функции по контролю и надзору в сфере охраны здоровья;
Со 02.01.2027 п. 3 ч. 5 ст. 38 утрачивает силу (ФЗ от 30.04.2021 N 128-ФЗ).
3) медицинские изделия, произведенные в Российской Федерации для экспорта за пределы территории Евразийского экономического союза и не предназначенные для применения на территории Евразийского экономического союза, а также произведенные в Российской Федерации для проведения опытно-конструкторских работ, исследований (испытаний);
4) медицинские изделия, которые предназначены для применения на территории международного медицинского кластера или на территориях инновационных научно-технологических центров;
Со 02.01.2027 п. 5 ч. 5 ст. 38 утрачивает силу (ФЗ от 30.04.2021 N 128-ФЗ).
5) медицинские изделия, представляющие собой укладки, наборы, комплекты и аптечки, состоящие из зарегистрированных медицинских изделий (за исключением медицинских изделий, связанных с источником энергии или оборудованных источником энергии) и (или) лекарственных препаратов, объединенных общей упаковкой, при условии сохранения вторичной (потребительской) упаковки или первичной упаковки лекарственного препарата в случае, если вторичная (потребительская) упаковка не предусмотрена, производителя (изготовителя) каждого из изделий и (или) лекарственных препаратов, входящих в указанные укладки, наборы, комплекты и аптечки, и при условии сохранения ее маркировки;
П. 6 ч. 5 ст. 38 вступает в силу с 01.01.2022.
(часть 5 в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
5.1. Особенности обращения, включая особенности государственной регистрации, медицинских изделий, которые предназначены для применения в условиях военных действий, чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов, и которые разработаны в том числе по заданию федеральных органов исполнительной власти и федеральных государственных органов, в которых федеральным законом предусмотрена военная служба или приравненная к ней служба, устанавливаются Правительством Российской Федерации.
(часть 5.1 в ред. Федерального закона от 01.04.2020 N 98-ФЗ)
(см. текст в предыдущей редакции)
5.2. На указанные в части 5 настоящей статьи медицинские изделия не распространяются требования к содержанию технической и эксплуатационной документации производителя (изготовителя), установленные уполномоченным федеральным органом исполнительной власти в соответствии с частью 3 настоящей статьи.
(часть 5.2 введена Федеральным законом от 30.04.2021 N 128-ФЗ)
6. Порядок ввоза на территорию Российской Федерации медицинских изделий в целях государственной регистрации устанавливается уполномоченным федеральным органом исполнительной власти. Порядок ввоза на территорию Российской Федерации медицинских изделий, указанных в пунктах 1, 2 и 5 части 5 настоящей статьи (за исключением медицинских изделий, указанных в подпунктах «а», «в» и «г» пункта 11 статьи 4 Соглашения о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза от 23 декабря 2014 года), устанавливается Правительством Российской Федерации.
(в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
7. Ввоз на территорию Российской Федерации и вывоз с территории Российской Федерации медицинских изделий в рамках проведения допинг-контроля осуществляется в порядке, установленном Правительством Российской Федерации.
8. В целях государственной регистрации медицинских изделий в порядке, установленном уполномоченным федеральным органом исполнительной власти, проводятся оценка соответствия в форме технических испытаний, токсикологических исследований, клинических испытаний и экспертиза качества, эффективности и безопасности медицинских изделий, а также испытания в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, перечень которых утверждается уполномоченным федеральным органом исполнительной власти). Действие данных требований может быть изменено в отношении участников экспериментального правового режима в сфере цифровых инноваций в соответствии с программой экспериментального правового режима в сфере цифровых инноваций, утверждаемой в соответствии с Федеральным законом от 31 июля 2020 года N 258-ФЗ «Об экспериментальных правовых режимах в сфере цифровых инноваций в Российской Федерации», с учетом требований, установленных правом Евразийского экономического союза.
(в ред. Федерального закона от 02.07.2021 N 331-ФЗ)
(см. текст в предыдущей редакции)
С 01.01.2022 ст. 38 дополняется ч. 8.1 (ФЗ от 30.04.2021 N 128-ФЗ). См. будущую редакцию.
9. За совершение уполномоченным федеральным органом исполнительной власти действий, связанных с осуществлением государственной регистрации медицинских изделий и регистрации медицинских изделий в соответствии с международными договорами и актами, составляющими право Евразийского экономического союза, взимается государственная пошлина в соответствии с законодательством Российской Федерации о налогах и сборах.
(часть 9 в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
10. В порядке, установленном Правительством Российской Федерации, уполномоченный им федеральный орган исполнительной власти осуществляет ведение государственного реестра медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий, и размещает его на своем официальном сайте в сети «Интернет».
(в ред. Федерального закона от 25.11.2013 N 317-ФЗ)
(см. текст в предыдущей редакции)
11. В государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий, вносятся следующие сведения:
(в ред. Федерального закона от 25.11.2013 N 317-ФЗ)
(см. текст в предыдущей редакции)
1) наименование медицинского изделия;
2) дата государственной регистрации медицинского изделия и его регистрационный номер, срок действия регистрационного удостоверения;
3) назначение медицинского изделия, установленное производителем;
4) вид медицинского изделия;
5) класс потенциального риска применения медицинского изделия;
6) код Общероссийского классификатора продукции по видам экономической деятельности;
(п. 6 в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
(п. 7 в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
(п. 8 в ред. Федерального закона от 25.11.2013 N 317-ФЗ)
(см. текст в предыдущей редакции)
9) адрес места производства или изготовления медицинского изделия;
10) сведения о взаимозаменяемых медицинских изделиях;
11) иные сведения, определяемые Правительством Российской Федерации.
(п. 11 введен Федеральным законом от 30.04.2021 N 128-ФЗ)
С 01.01.2022 ст. 38 дополняется ч. 11.1 (ФЗ от 30.04.2021 N 128-ФЗ). См. будущую редакцию.
(часть 12 введена Федеральным законом от 31.12.2014 N 532-ФЗ)
(часть 13 в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
(часть 14 введена Федеральным законом от 31.12.2014 N 532-ФЗ)
1) незарегистрированных медицинских изделий, за исключением медицинских изделий, указанных в части 5 настоящей статьи;
(п. 1 в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
2) фальсифицированных медицинских изделий;
3) медицинских изделий, содержащих этиловый спирт, по месту осуществления производства фармацевтической субстанции спирта этилового (этанола) и (или) по месту осуществления производства этилового спирта;
(п. 3 введен Федеральным законом от 27.12.2019 N 481-ФЗ)
4) медицинских изделий, содержащих этиловый спирт, на основном технологическом оборудовании для производства этилового спирта, указанном в пункте 1.1 статьи 14.1 Федерального закона от 22 ноября 1995 года N 171-ФЗ «О государственном регулировании производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции и об ограничении потребления (распития) алкогольной продукции».
(п. 4 введен Федеральным законом от 27.12.2019 N 481-ФЗ)
(часть 15 введена Федеральным законом от 31.12.2014 N 532-ФЗ)
15.1. В случае необходимости использования этилового спирта, в том числе фармацевтической субстанции спирта этилового (этанола), при производстве медицинских изделий, содержащих этиловый спирт, в качестве действующего и (или) вспомогательного вещества, а также в иных технологических целях должна быть использована только фармацевтическая субстанция спирта этилового (этанол).
(часть 15.1 введена Федеральным законом от 27.12.2019 N 481-ФЗ)
16. Запрещается ввоз на территорию Российской Федерации фальсифицированных медицинских изделий, недоброкачественных медицинских изделий и контрафактных медицинских изделий, а также незарегистрированных медицинских изделий, за исключением медицинских изделий, указанных в части 5 настоящей статьи.
(часть 16 введена Федеральным законом от 31.12.2014 N 532-ФЗ; в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
17. Запрещается реализация фальсифицированных медицинских изделий, недоброкачественных медицинских изделий и контрафактных медицинских изделий, а также незарегистрированных медицинских изделий, за исключением медицинских изделий, указанных в части 5 настоящей статьи.
(часть 17 введена Федеральным законом от 31.12.2014 N 532-ФЗ; в ред. Федерального закона от 30.04.2021 N 128-ФЗ)
(см. текст в предыдущей редакции)
(часть 18 введена Федеральным законом от 31.12.2014 N 532-ФЗ)
19. Фальсифицированные медицинские изделия и недоброкачественные медицинские изделия подлежат изъятию из обращения и уничтожению на основании решения владельца медицинских изделий, решения уполномоченного федерального органа исполнительной власти, осуществляющего функции по контролю и надзору в сфере охраны здоровья, или решения суда. Контрафактные медицинские изделия подлежат изъятию из обращения и уничтожению по решению суда. Порядок изъятия из обращения и уничтожения фальсифицированных медицинских изделий, недоброкачественных медицинских изделий и контрафактных медицинских изделий устанавливается Правительством Российской Федерации.
(часть 19 в ред. Федерального закона от 02.07.2021 N 314-ФЗ)
(см. текст в предыдущей редакции)
20. Расходы, связанные с изъятием из обращения и уничтожением фальсифицированных медицинских изделий, недоброкачественных медицинских изделий и контрафактных медицинских изделий, возмещаются их владельцем.
(часть 20 введена Федеральным законом от 31.12.2014 N 532-ФЗ; в ред. Федерального закона от 02.07.2021 N 314-ФЗ)
(см. текст в предыдущей редакции)
21. В условиях чрезвычайной ситуации и (или) при возникновении угрозы распространения заболевания, представляющего опасность для окружающих, а также в случае, если в течение тридцати календарных дней после принятия Правительством Российской Федерации решения о проведении мониторинга розничных цен на медицинские изделия на территориях субъектов Российской Федерации выявлен рост розничных цен на медицинские изделия на тридцать процентов и более, Правительство Российской Федерации вправе установить предельные отпускные цены производителей на медицинские изделия, предельные размеры оптовых надбавок и предельные размеры розничных надбавок к фактическим отпускным ценам производителей на медицинские изделия. Перечень медицинских изделий и порядок его формирования определяются Правительством Российской Федерации.
(часть 21 введена Федеральным законом от 26.03.2020 N 67-ФЗ)
22. В течение девяноста календарных дней со дня утверждения Правительством Российской Федерации перечня медицинских изделий, указанного в части 21 настоящей статьи, не допускаются реализация и отпуск включенных в него медицинских изделий по ценам, превышающим предельные отпускные цены производителей на указанные медицинские изделия, предельные размеры оптовых надбавок и предельные размеры розничных надбавок к фактическим отпускным ценам производителей с учетом налога на добавленную стоимость.
(часть 22 введена Федеральным законом от 26.03.2020 N 67-ФЗ)
23. В условиях чрезвычайной ситуации и (или) при возникновении угрозы распространения заболевания, представляющего опасность для окружающих, Правительство Российской Федерации вправе принять решение об установлении ограничений на осуществление оптовой и розничной торговли медицинскими изделиями, включенными в определяемый Правительством Российской Федерации перечень, на срок, не превышающий девяноста календарных дней со дня принятия указанного решения.
(часть 23 введена Федеральным законом от 01.04.2020 N 98-ФЗ)
Классификация изделий медицинского назначения, предметов ухода за больными
В ассортименте аптек обязательно должны быть товары для санитарно-гигиенических целей и предметы ухода за больными, так как при тяжелых заболеваниях, после хирургических вмешательств, для неходячих больных и в других случаях они являются необходимыми для обеспечения жизнедеятельности человека. Они относятся к изделиям медицинского назначения, в ассортименте которых гигиенические и перевязочные средства, медицинская одежда и др.
Изделия медицинского назначения (ИМИ) — это медицинские изделия из стекла, полимерных, резиновых, текстильных и иных материалов, наборы реагентов и контрольные материалы для них, другие расходные средства и изделия, в основном однократного применения, не требующие технического обслуживания при использовании (приказ МЗ РФ № 444 от 13.12.2001 «О сроках действия регистрационных удостоверений на изделия медицинского назначения и медицинской техники»).
Эта группа товаров занимает около 20% от общего объема рынка медицинских изделий, что подчеркивает ее значимость для медицинской промышленности. В настоящее время лишь пятая часть (20%) продукции этой направленности приходится на отечественную.
Приказ Минздравмедпрома № 161 от 9.06.95 г. регламентирует ассортиментный перечень изделий медицинского назначения, предметы ухода за больными, профилактики, санитарии и гигиены, которые должны быть в аптечных учреждениях.
Ассортиментный перечень изделий медицинского назначения, предметов ухода за больными, профилактики, санитарии и гигиены для аптечных учреждений (приказ № 161 Минздравмедпрома РФ от 9.06.95 г.)
— Аптечки (наборы) индивидуальные, первой помощи, универсальные, матери и ребенка
— Калоприемники и мешочки-сборники
— Клеенка подкладная, компрессная, полихлорвиниловая, медицинская
— Кольца детские зубные
— Костыли взрослые, детские, подростковые и наконечники к ним
— Кружки Эсмарха (ирригаторные)
— Пакеты (прокладки) гигиенические женские,тампоны
— Пояса гигиенические резиновые
— Респираторы, маски медицинские
— Средства предохранения (колпачки, презервативы, внутрима-точные спирали)
— Стаканчики для приема лекарств
— Чулки, получулки (гольфы) медицинские
Отдельные товары (катетеры, ножницы, термометры, шприцы и др.) рассмотрены в других темах. В данной теме рассматриваются группы остальных товаров.
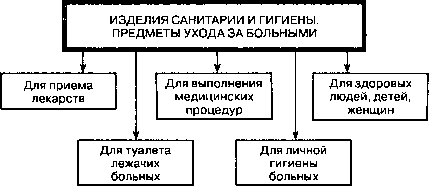
По функциональному назначению изделия санитарии, гигиены и предметы ухода за больными можно систематизировать на группы, представленные на
Классификация изделий санитарии и гигиены, предметов ухода за больными по функциональному назначению
Классификация изделий санитарии и гигиены, предметов ухода за больными по функциональному назначению
К предметам ухода за больными для приема лекарств, в основном жидких, воды, предназначены стаканчики, поильники, пипетки глазные и др.
Для выполнения некоторых медицинских процедур применяются банки кровоотсосные, кружки Эсмарха, жгуты кровоостанавливающие, перчатки, шприцы, термометры и др.
В случае постельного режима больного необходимы изделия санитарии и гигиены для туалета: судна подкладные, мочеприемники, калоприемники, клеенка.
Отдельные товары предназначены для личной гигиены больных, в частности, бандажи, катетеры, кольца маточные, плевательницы, суспензории и др.
В то же время в ассортименте есть и изделия санитарии и гигиены, которые нужны здоровым людям, детям, женщинам, в том числе и беременным женщинам, например, аптечки, кольца детские зубные, молокоотсосы, напальчники, соски, женские пакеты, маски, респираторы медицинские и др.
В последние годы на фармацевтическом рынке России появились группы или серии товаров, предназначенных для решения определенных проблем здоровых или больных людей. Например, фирма Артсана (Италия) предлагает группу товаров — изделий для ухода
за новорожденными и детьми раннего возраста, а также аксессуаров для кормящих женщин, в том числе:
Физиологичный проект КиККО:
— соски физиологичные имеют оригинальные конструктивные особенности, а именно: противоикотный клапан в комбинации с разгрузочными каналами-бороздками, которые регулируют поступление воздуха в бутылочку;
— пустышки физиологичные «капля» имеют каплевидную форму;
— бутылочки физиологичные состоят из колпачка-стаканчика, соски физиологичной, гигиенической заглушки, бутылочки, клапана, предотвращающего возникновение коликудетей, и съемного дна;
— молокоотсос регулируемый предназначен для сцеживания грудного молока у кормящих женщин.
Серия товаров «Тена» — для ухода за пациентами с недержанием мочи, включает подгузники для взрослых, впитывающие простыни. Применение этих средств упрощает уход за больными и обеспечивает пациенту ощущение комфорта.
• прокладки-дайперсы «Леди» для женщин, имеют анатомическую форму, подходят для применения и ночью и днем, незаметны под одеждой; выпускаются типы нормал, экстра, супер, в упаковках 7-12 шт.;
• прокладки «Комфорт» выпускаются в комплекте с фиксирующими трусами;
• прокладки-простыни «Бэд», размер 60×60 или 60×90, 20—30 шт. в упаковке.
Эти товары отечественного производства: фирма «ЭсСиЭй Хайд-жин Продактс» (Россия).
Определенную группу товаров составляют средства для личной гигиены женщин в дни менструального цикла и на каждый день. К ним относятся прокладки, тампоны, пакеты, выполняющие одну функцию — поглощение (впитывание) выделений организма и обеспечение комфорта женщин.
Гигиенические интравагинальные средства для использования в «критические» дни — тампоны «Тампакс» изготавливают из специально отбеленного хлопкового волокна, вискозы или их смеси, имеют шнур возврата. Выпускаются трех видов: мини, нормальные и супер-супер плюс; в упаковке 8 шт.
Они компактны и позволяют женщине вести активный образ жизни. Исследователями Российской ассоциации акушеров-гинеко-логов доказано, что они не вызывают изменений вагинальной микрофлоры, безопасны для здоровья женщин. Тампоны следует менять каждые 4—8 час. В то же время нужно знать предосторожности, так как если при использовании тампонов происходит неожиданное ухудшение состояния здоровья (повышение температуры, рвота, диарея, мышечная боль, головокружение и др.), то следует срочно обратиться к врачу. Причиной могут быть токсины, вырабатываемые стафилококком. Эти изменения здоровья носят название «синдром токсического шока». В России пока не зарегистрированы случаи СТШ. Применение тампонов в послеродовой период, особенно при хирургических вмешательствах, нежелательно и возможно только после консультации с врачом. Выпускаются филиалами компании «Проктер энд Гембл» (США).
Фирма «Проктер энд Гембл» (США) также выпускает серию гигиенических средств для женщин, в частности:
Эти прокладки хорошо впитывают влагу, так как имеют уникальный верхний слой «Драйвив», состоящий измельчайших трехмерных воронкообразных пор. Он пропускает влагу внутрь прокладки и препятствует ее выходу на поверхность под давлением. Прокладки имеют удлиненные эластичные «крылышки» для надежной фиксации к белью. Материалы, из которых изготавливаются прокладки, не поддерживают рост и размножение бактерий, не раздражают кожу и не вызывают аллергии. Прокладки меняют 4—6 раз в день. Срок годности 2 года. Выпускаются филиалами компании в Германии, Венгрии, Турции.
Для ежедневного использования выпускается серия прокладок «Олдэйз». Они имеют более мягкую поверхность, обеспечивают контроль появления неприятного запаха, создают комфортные условия для женского организма, предупреждают раздражение кожи и ощущение опрелости.
Серия О.БИ. (о.Ь.) — тампоны изготовлены из вискозы, хлопка, имеют нетканую поверхность и шнур возврата. Выпускаются разные размеры, предназначенные для применения при разных объемах выделений. Требуют смены каждые 3-6 час. Тампоны О.БИ. Комфорт имеют специальную шелковистую поверхность. В упаковках 8 и 16 шт. Производит компания «Джонсон и Джонсон» (Австрия).
Серия гигиенических салфеток (прокладок) для ежедневного использования «Кэр фри» изготовлена из хлопка, поверхность мягкая, пропитана специальным раствором, содержащим различные вещества, поддерживающие естественный кислотно-щелочной баланс интимной зоны, экстракт ромашки предупреждает возможность появления воспаления и раздражения. Тонкие, гибкие, форма повторяет линии тела, надежно фиксируются на нижнем белье. В упаковках от 16 до 30 шт., могут быть черные,
Выпускаются различные виды: «Кэр фри», «Кэр фри блэк», «Кэр фри флексиформ» (воздухопроницаемые), «Кэр фри фрэш» (с ароматом свежести), «Кэр фри ультра» (для применения в критические дни) и др. Производит компания «Джонсон и Джонсон» (Италия).