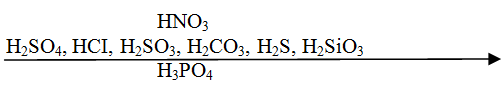Что значит трехосновная кислота
Разница между одноосновными двухосновными и трехосновными кислотами
Содержание:
Ключевые области покрыты
1. Что такое одноосновные кислоты
— определение, диссоциация и примеры
2. Что такое двухосновные кислоты
— определение, диссоциация и примеры
3. Что такое трехосновные кислоты
— определение, диссоциация и примеры
4. В чем разница между одноосновными двухосновными и трехосновными кислотами
— Сравнение основных различий
Основные термины: кислота, двухосновная кислота, одноосновная кислота, соль, трехосновная кислота
Что такое одноосновные кислоты
Одноосновные кислоты представляют собой кислотные соединения, которые имеют один замещаемый атом водорода на одну молекулу кислоты. В водном растворе эти кислоты могут удалить один протон (атом водорода). Поэтому они называются монопротонные кислоты, Одноосновная кислота может отдавать только один атом водорода для реакции между одноосновной кислотой и основанием.
Так как диссоциация одноосновной кислоты дает в систему только один атом водорода, уравнение для константы диссоциации одноосновной кислоты включает концентрацию только одного Н + ион. Диссоциация одноосновной кислоты может быть показана ниже.
Константа диссоциации Ka = [H + (Водно)] [A – (Водно)] / [HA(Водно)]
Рисунок 1: Структура соляной кислоты (атом водорода показан красным)
Существуют органические и неорганические одноосновные кислоты. Некоторые из них являются сильными кислотами, тогда как другие являются слабыми кислотами. Сильные одноосновные кислоты, такие как HCl, HNO3HBr может полностью диссоциировать и отдавать один водород до основания. Слабые одноосновные кислоты, такие как уксусная кислота (СН3COOH) частично диссоциированы.
Что такое двухосновные кислоты
Двухосновные кислоты представляют собой химические соединения, которые имеют два заменяемых атома водорода на молекулу кислоты. Следовательно, эти двухосновные кислоты могут отдавать два атома водорода для реакции между двухосновной кислотой и основанием. В водном растворе двухосновные кислоты диссоциируют с образованием двух ионов водорода (H + ) в систему. Поэтому они также называются дипротоновые кислоты.
Диссоциация двухосновной кислоты может быть приведена ниже. Двухосновная кислота имеет два значения константы диссоциации. Это для первой диссоциации и второй диссоциации.
Рисунок 2: Структура серной кислоты (два атома водорода показаны красным)
Двухосновные кислоты также можно отнести к двум типам: сильные двухосновные кислоты и слабые двухосновные кислоты. Сильные двухосновные кислоты полностью диссоциируют на два атома водорода и сопряженный ион кислоты. Их первая ионизация сильна. Но слабые двухосновные кислоты частично диссоциируют на два атома водорода и сопряженный ион кислоты. Некоторые распространенные примеры двухосновных кислот включают Н2ТАК4, Ч2Колорадо3 и H2С2О4.
Что такое трехосновные кислоты
Трехосновные кислоты представляют собой химические соединения, которые имеют три замещаемых атома водорода. Эти кислоты могут пожертвовать три иона водорода для реакции между трехосновной кислотой и основанием. Так как они могут удалить три H + ионы (протоны), эти кислоты также называют трипротонные кислоты.
Диссоциация трехосновной кислоты обеспечивает три иона водорода в системе. Следовательно, диссоциация трехосновной кислоты имеет три константы диссоциации.
Рисунок 3: Структура фосфорной кислоты (три атома водорода показаны красным)
Распространенной неорганической трехосновной кислотой является фосфорная кислота (H3ПО4). Он состоит из трех атомов водорода, связанных с тремя атомами кислорода вокруг атома фосфора. Эти атомы водорода могут быть заменены или удалены из молекулы. Обычной органической трехосновной кислотой является лимонная кислота.
Разница между одноосновными двухосновными и трехосновными кислотами
Определение
Одноосновная кислота: Одноосновные кислоты представляют собой кислотные соединения, которые имеют один замещаемый атом водорода на молекулу кислоты.
Двухосновная кислота: Двухосновные кислоты представляют собой химические соединения, которые имеют два заменяемых атома водорода на молекулу кислоты.
Трехосновная кислота: Трехосновные кислоты представляют собой химические соединения, которые имеют три замещаемых атома водорода на молекулу кислоты.
Ионы водорода, пожертвованные для кислотно-основных реакций
Одноосновная кислота: Одноосновные кислоты могут пожертвовать только один ион водорода для кислотно-щелочной реакции.
Двухосновная кислота: Двухосновные кислоты могут пожертвовать два иона водорода для кислотно-основной реакции.
Трехосновная кислота: Трехосновные кислоты могут пожертвовать три иона водорода для кислотно-щелочной реакции.
диссоциация
Одноосновная кислота: Одноосновные кислоты не имеют ступенчатой диссоциации.
Двухосновная кислота: Двухосновные кислоты диссоциируют в две стадии.
Трехосновная кислота: Трехосновные кислоты диссоциируют в три этапа.
Константы диссоциации
Одноосновная кислота: Одноосновные кислоты имеют только одну константу диссоциации.
Двухосновная кислота: Двухосновные кислоты имеют две константы диссоциации.
Трехосновная кислота: Трехосновные кислоты имеют три константы диссоциации.
Заключение
Рекомендации:
1. «Кислота». Википедия, Фонд Викимедиа, 23 августа 2017 г.,
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Краткий конспект подготовки к ЗНО по химии №10 Кислоты
Подготовка к ВНО. Химия.
Конспект 10. Кислоты
Общая характеристика кислот
| Название кислоты | Формула кислоты | Кислотный остаток | Название солей |
| Фтороводородная (плавиковая) |  |  | Фторид |
| Хлороводородная (соляная) |  |  | Хлорид |
| Бромоводородная |  |  | Бромид |
| Угольная |  | =  | Карбонат |
| Кремниевая |  | =  | Силикат |
| Азотная |  |  | Нитрат |
| Ортофосфорная |  |  | Ортофосфат |
| Серная | =  | Сульфат | |
| Сернистая |  | =  | Сульфит |
| Сероводородная |  | =  | Сульфид |
Одним из представителей органических кислот является уксусная кислота 
Слово «кислота» по значению связано со словом «кислый», так как имеют общий корень. Отсюда следует, что растворы всех кислот имеют кислый вкус.
Несмотря на это, не следует пробовать на вкус никакие растворы кислот, так как некоторые из них относятся к едким и ядовитым растворам.
Природные источники кислот.
В природе встречается много кислот: лимонная кислота в лимонах, яблочная кислота – в яблоках, щавелевая кислота – в листьях щавеля.
Муравьи защищаются от врагов, выбрасывая едкие капельки муравьиной кислоты. (Она же содержится в пчелином яде и жгучих волосках крапивы.)
При прокисании виноградного сока получается всем известная уксусная кислота (уксус), а при прокисании молока – молочная кислота, та же самая молочная кислота получается при квашении капусты.
Кислоты делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
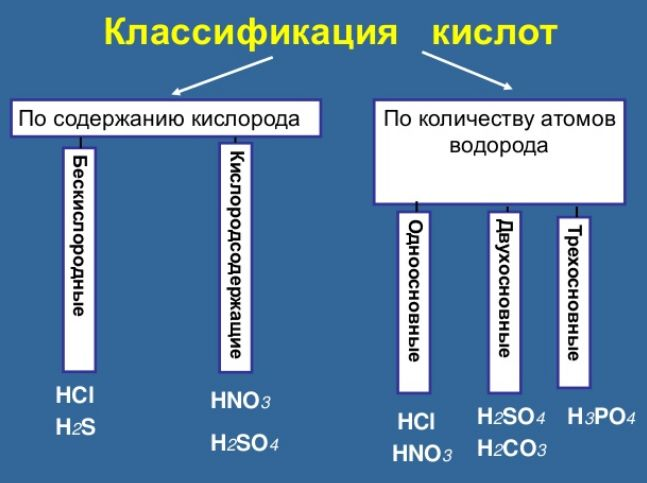
1. Существуют бескислородные и кислородсодержащие кислоты. Название этих групп указывает на наличие или отсутствие в молекуле кислоты атомов кислорода.
2. Другой признак классификации кислот – количество атомов водорода в кислоте. Соответствующую характеристику кислоты называют основностью. Существуют одно-, двух-, трехосновные кислоты.
3. Приведем еще один признак классификации кислот, как электролитов по степени электролитической диссоциации. Кислота – это электролит, водный раствор которого содержит катионы водорода и анионы кислотного остатка. Если электролит диссоциирует практически нацело – это сильный электролит. Электролит, степень диссоциации которого мала, это слабый электролит.
Классификация по степени электролитической диссоциации.
| Признак классификации | ||
| Степень электролитической диссоциации | Сильные кислоты |  |
| Слабые кислоты |  |
Физические свойства кислот
Агрегатное состояние.
При обычных условиях кислоты могут быть твердыми веществами(ортофосфорная 


Такие газы как хлороводород 


Цвет.
Водные растворы соляной, азотной, серной, ортофосфорной и ряда других кислот не имеют окраски. Водные растворы хромовой кислоты 

Запах.
Некоторые кислоты имеют запах. Например, кислоты: 
Растворением в воде сероводорода получают сероводородную кислоту 
Растворимость, летучесть и стабильность некоторых кислот.
| Физические свойства | Группы кислот | Пример |
| Растворимость | Растворимые |  |
| Нерастворимые |  | |
| Летучесть | Летучие |  |
| Нелетучие |  | |
| Стабильность | Стабильные |  |
| Нестабильные |  |
Серная, соляная, уксусная кислоты могут вызывать сильные ожоги, разрушать ткани. Поэтому при работе с кислотами необходимо соблюдать меры предосторожности.
Если кислота попала на одежду или на поверхность тела, то её необходимо очень быстро смыть большим количеством проточной воды или нейтрализовать нашатырным спиртом.
Если кислота попала на деревянную, металлическую или на другие поверхности, то ее нейтрализуют известью, мелом или содой. Кислоты необходимо хранить в хорошо укупоренной посуде в недоступном месте для детей, и обязательно на таре должна быть бирка с названием кислоты.
Серная кислота является более сильной кислотой, чем соляная. Концентрированная серная кислота обугливает сахар, дерево, хлопок, шерсть и вызывает очень глубокие ожоги кожи.
При приготовлении раствора серной кислоты необходимо следовать следующему правилу: Кислоту льют в воду тонкой струйкой по стенке стеклянной посуды, но не наоборот.
Химические свойства кислот
1. Действие на индикаторы.
Кислоты в водных растворах изменяют окраску индикаторов.
В кислой среде фиолетовый лакмус приобретает красную окраску. Метиловый оранжевый – красную, а фенолфталеиновый – бесцветный. Если в раствор кислоты добавим по несколько капель универсального индикатора, он также поменяет окраску на красную.
Окраска индикаторов в различных средах.
2. Реакция с металлами.
Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов до водорода. При этом получается соль и выделяется водород.
Металлы, расположенные в ряду активности металлов до водорода, вытесняют водород из кислот. Каждый предыдущий металл активнее, чем каждый последующий. 
Эта реакция относится к реакциям замещения.
Реакцию между простым и сложным веществами, в результате которой образуются новые простое и сложное вещества, называют реакцией замещения.
При реакциях азотной кислоты и концентрированной серной кислоты с металлами образуются соли, но водород не выделяется.
3. Реакция с основными и амфотерными оксидами с образованием соли и воды. 
Произошла реакция обмена: два сложных вещества обменялись своими составными частями.
4. Реагируют с основаниями. 

Реакция нейтрализации – реакция между кислотой и основанием, в результате которой получается соль и вода.
5.Реакция с солями.
Реакции кислот с солями не всегда возможны.
А. Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок. 


Б. Если кислота – продукт является летучей, происходит от газообразного соединения или разлагается с образованием газа. 


Сокращение (тв.) означает «твердое вещество», а (конц.) – «концентрированный раствор».
В. Если кислота, которая вступает в реакцию, является сильной, а кислота, которая образуется, – слабой.
Пользуясь вытеснительным рядом кислот можно предсказать течение реакции. Каждая предыдущая кислота может вытеснить из соли последующую.
Например,

но не будет происходить реакция между 


Вытеснительный ряд кислот.
Взаимодействие кислот с солями также относится к реакциям обмена.
6. Термическое разложение кислородсодержащих кислот.
Кислородсодержащие кислоты при нагревании, а угольная кислота и сернистая в обычных условиях, разлагаются с образованием соответствующих кислотных оксидов и воды:
Химические свойства кислот можно обобщить таким образом:
А. Изменяют цвет индикаторов
Б. Реагируют с металлами
В. Реагируют с основными и амфотерными оксидами
Г. Реагируют с основаниями
Д. Реагируют с солями (более слабых и летучих кислот)
Е. Некоторые кислоты разлагаются при нагревании.
В промышленности.
Наибольшее применение получили серная, соляная, азотная и ортофосфорная кислоты. Их получают на химических заводах в больших количествах.
| Кислота | Область применения |
 | Производство других кислот, солей, удобрений, красителей, лекарств, очистка нефтепродуктов. Серную кислоту, за счет ее свойств поглощать большие количества воды, используют для осушения. Применяется для приготовления аккумуляторной кислоты. |
 | Производство солей, красок, лекарств. |
 | Производство удобрений, красителей, взрывчатых веществ. |
 | Производство удобрений, моющих средств. |
Общие способы получения кислот
1. Бескислородные кислоты получают при растворении в воде газообразных соединений неметаллов с водородом. Так, например, соляная кислота получается в результате растворения газа хлороводорода 


2. Кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой. 
3. Получение кислот вытеснением из солей слабых кислот сильными, летучих нелетучими, растворимых – нерастворимыми. Например, сильная соляная кислота вытесняет слабую уксусную из растворов их солей. 


Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №12 «Кислоты»