Что называют осмотическим давлением
Водно-электролитный обмен в организме здорового человека: принципы регуляции
Регуляция водно-солевого обмена, как и большинство физиологических регуляций, включает афферентное, центральное и эфферентное звенья. Афферентное звено представлено массой рецепторных аппаратов сосудистого русла, тканей и органов, воспринимающих сдвиги осмотического давления, объема жидкостей и их ионного состава. В результате, в центральной нервной системе создается интегрированная картина состояния водно-солевого баланса в организме. Так, при увеличении концентрации электролитов и уменьшении объема циркулирующей жидкости (гиповолемии) появляется чувство жажды, а при увеличении объема циркулирующей жидкости (гиперволемии) оно уменьшается. Следствием центрального анализа является изменение питьевого и пищевого поведения, перестройка работы желудочно-кишечного тракта и системы выделения (прежде всего функции почек), реализуемая через эфферентные звенья регуляции. Последние представлены нервными и, в большей мере, гормональными влияниями. Увеличение объема циркулирующей жидкости за счет повышенного содержания воды в крови (гидремия) может быть компенсаторным, возникающим, например, после массивной кровопотери. Гидремия с аутогемодиллюцией представляет собой один из механизмов восстановления соответствия объема циркулирующей жидкости емкости сосудистого русла. Патологическая гидремия является следствием нарушения водно-солевого обмена, например при почечной недостаточности и др. У здорового человека может развиться кратковременная физиологическая гидремия после приема больших количеств жидкости.
Гуморальная регуляция водно-электролитного баланса в организме осуществляется следующими гормонами:
— антидиуретический гормон (АДГ, вазопрессин), воздействует на собирательные трубочки и дистальные канальцы почек, увеличивая реабсорбцию воды;
— натриуретический гормон (предсердный натриуретический фактор, ПНФ, атриопептин), расширяет приносящие артериолы в почках, что увеличивает почечный кровоток, скорость фильтрации и экскрецию Na+; ингибирует выделение ренина, альдостерона и АДГ;
— ренин-ангиотензин-альдостероновая система стимулирует реабсорбцию Na+ в почках, что вызывает задержку NaCl в организме и повышает осмотическое давление плазмы, что определяет задержку выведения жидкости.
— паратиреоидный гормон увеличивает абсорбцию калия почками и кишечником и выведение фосфатов и увеличение реабсорбции кальция.
Содержание натрия и организме регулируется в основном почками под контролем ЦНС через специфические натриорецепторы. реагирующие на изменение содержания натрия в жидкостях тела, а также волюморецепторы и осморецепторы, реагирующие на изменение объема циркулирующей жидкости и осмотического давления внеклеточной жидкости соответственно. Содержание натрия в организме контролируется ренин-ангиотензинной системой, альдостероном, натрийуретическими факторами. При уменьшении содержания воды в организме и повышении осмотического давления крови усиливается секреция вазопрессина (антидиуретического гормона), который вызывает увеличение обратною всасывания воды в почечных канальцах. Увеличение задержки натрия почками вызывает альдостерон, а усиление выведения натрия — натрийуретические гормоны, или натрийуретические факторы (атриопептиды, простагландины, уабаинподобное вещество).
Состояние водно-солевого обмена в значительной степени определяет содержание ионов Cl- во внеклеточной жидкости. Из организма ионы хлора выводятся в основном с мочой, желудочным соком, потом. Количество экскретируемого хлорида натрия зависит от режима питания, активной реабсорбции натрия, состояния канальцевого аппарата почек, кислотно-щелочного состояния. Обмен хлора в организме пассивно связан с обменом натрия и регулируется теми же нейрогуморальными факторами. Обмен хлоридов тесно связан с обменом воды: уменьшение отеков, рассасывание транссудата, многократная рвота, повышенное потоотделение и др. сопровождаются увеличением выведения ионов хлора из организма.
Главные регуляторы обмена кальция и фосфора в организме: витамин D, паратгормон и кальцитонин. Витамин D (в результате преобразований в печени образуется витамин D3, в почках — кальцитриол) увеличивает всасывание кальция в пищеварительном тракте и транспорт кальция и фосфора к костям. Паратгормон выделяется при снижении уровня кальция в сыворотке крови, высокий же уровень кальция тормозит образование паратгормона. Паратгормон способствует повышению содержания кальция и снижению концентрации фосфора в сыворотке крови. Кальций резорбируется из костей, также увеличивается его всасывание в пищеварительном тракте, а фосфор удаляется из организма с мочой. Паратгормон также необходим для образования активной формы витамина D в почках. Увеличение уровня кальция в сыворотке крови способствует выработке кальцитонина. В противоположность паратгормону он вызывает накопление кальция в костях и снижает его уровень в сыворотке крови, уменьшая образование активной формы витамина D в почках. Увеличивает выделение фосфора с мочой и снижает его уровень в сыворотке крови.
Статья добавлена 31 мая 2016 г.
Осмотическое давление
Из Википедии — свободной энциклопедии
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничностью. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для внутривенного введения, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия (3—10 %, гипертонические растворы), то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называется плазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, — соответственно, деплазмолизом.
Что называют осмотическим давлением
Если в условиях, к раствору хлорида натрия приложить давление, осмос воды в этот раствор замедлится, прекратится или пойдет в противоположном направлении. Точную величину давления, необходимого для прекращения осмоса, называют осмотическим давлением раствора хлорида натрия.
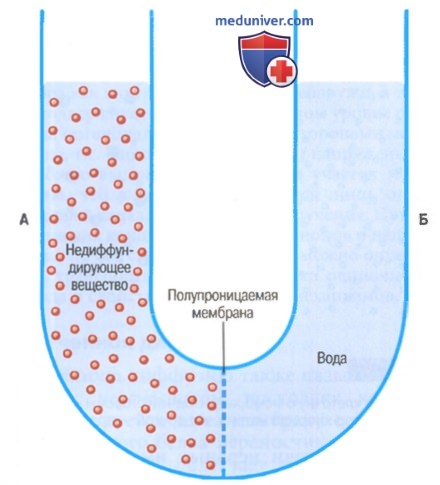
Принцип перепада давления, противостоящего осмосу, демонстрируется на рисунке, где показана избирательно проницаемая мембрана, разделяющая два столба жидкости, один из которых содержит чистую воду, а другой — воду и любое растворенное вещество, не проникающее через мембрану.
Осмос воды из отсека Б в отсек А ведет ко все большему перепаду уровней столбов жидкости до тех пор, пока в итоге разность давлений по обе стороны мембраны не станет достаточно большой, чтобы противостоять осмотическому эффекту. Разность давлений через мембрану в этот момент эквивалентна осмотическому давлению раствора, содержащего не проникающее через мембрану вещество.
Значение количества осмотических частиц (молярной концентрации) в определении осмотического давления. Осмотическое давление, создаваемое растворенными частицами, независимо от того, являются ли они молекулами или ионами, определяется количеством частиц на единицу объема жидкости, но не их массой, т.к. каждая частица в растворе, независимо от ее массы, оказывает в среднем одинаковое давление на мембрану.
Так, большие частицы, имеющие большую массу (т), движутся с меньшей скоростью (v), чем малые частицы. Малые частицы движутся с более высокой скоростью, и средняя кинетическая энергия (к), определяемая уравнением: k=mv 2 /2, одинакова как для каждой малой, так и каждой большой частицы. Следовательно, фактором, определяющим осмотическое давление раствора, является его концентрация, выраженная количеством частиц (что для недиссоциирующих веществ аналогично молярной концентрации), но не показателем массы растворенного вещества.
Осмоляльность. Осмоль. При определении концентрации раствора в показателях количества частиц вместо граммов используют единицу, называемую осмолем.
Один осмоль является 1 грамм-молекулой осмотически активного растворенного вещества. Так, 180 г глюкозы, т.е. 1 грамм-молекула глюкозы, эквивалентны 1 осмолю глюкозы, поскольку глюкоза не диссоциирует на ионы. Если растворенное вещество диссоциирует на 2 иона, 1 грамм-молекула растворенного вещества будет соответствовать 2 осмолям, поскольку число осмотически активных частиц в этом случае вдвое больше, чем для недиссоциирующего вещества.
При полной диссоциации 1 грамм-молекула хлорида натрия, или 58,5 г, эквивалентна 2 осмолям.
Следовательно, о растворе, содержащем 1 осмоль растворенного вещества в каждом килограмме воды, говорят, что его осмоляльность равна 1 осмоль на 1 кг. Раствор, содержащий 1/1000 осмоля растворенного вещества на 1 кг, имеет осмоляльность 1 миллиосмоль (мосм) на 1 кг. Нормальная осмоляльность внеклеточной и внутриклеточной жидкостей равна примерно 300 мосм на 1 кг воды.
Связь осмоляльности с осмотическим давлением. При 37°С, т.е. при температуре, равной нормальной температуре тела, раствор с концентрацией 1 осмоль на 1 л воды создает осмотическое давление, равное 19300 мм. рт. ст. Следовательно, концентрация 1 моем на 1 л эквивалентна 79,3 мм. рт. ст. осмотического давления.
Умножение этой величины на 300 мосм, т.е. на концентрацию частиц в жидкостях организма, дает общее расчетное осмотическое давление, равное 5790 мм рт. ст., однако измеренная реальная величина давления составляет в среднем только 5500 мм рт. ст. Причина такого различия заключается в том, что многие ионы в жидкостях организма, например ионы натрия и хлора, сильно притягиваются друг к другу и, следовательно, не могут двигаться совершенно свободно, реализуя свой полный осмотический потенциал.
В связи с этим истинное осмотическое давление жидкостей организма составляет в среднем около 0,93 (93%) расчетного значения.
Термин «осмолярность». В связи со сложностью измерения воды в растворе в килограммах, что необходимо для определения осмоляльности, вместо этого показателя используют осмолярность, т.е. осмолярную концентрацию, выражаемую числом осмолей на 1 л раствора, а не количеством осмолей на 1 кг воды. Хотя, строго говоря, именно осмоли на 1 кг воды (осмоляльность) определяют осмотическое давление для таких разбавленных растворов, как жидкости организма, количественные различия между осмолярностью и осмоляльностью составляют менее 1%.
Поскольку осмолярность измерять проще, чем осмоляльность, это является обычной практикой почти всех физиологических исследований.
Осмотическое давление
Осмотическое давление раствора выражают в единицах осмолярности. Осмолярным называют раствор, содержащий один осмоль вещества в 1 л растворителя. Осмотическоедавлениеу бактериальных клеток в 2 раза меньше, чем у животных. В молодых клетках грамотрицательных бактерий оно достигает 20–25 атмосфер, в старых – 2–3 атмосферы.
Роль осмотического давления в жизнедеятельности бактерий
Осмотическое давление играет большую роль в обеспечении жизнеспособности микроорганизмов. Величина осмотического давления зависит от концентрации растворенных в воде соединений. При низкой концентрации и следственно низком осмотическом давлении – раствор является гипотоническим раствром. При высокой концентрации и высоком осмотическом давлении – раствор называют гипертоническим раствором.
При оптимальной концентрации растворенных в питательной среде веществ для микроорганизма создаются наилучшие условии роста и развития. Увеличение концентрации и осмотического давления приводит к задержке роста организма, поскольку в растворах с более высоким осмотическим давлением, чем внутри микробной клетки, микроорганизмы не выживают. Это связано с тем, что в данном случае вода устремляется из клетки наружу (к более концентрированному раствору). В результате клетка обезвоживается и протопласт сжимается. Это явления называют плазмолизом.
Питательная среда с низким осмотическим давление так же губительна для микробов, поскольку в этом случае вода без ограничения поступает в клетку и цитоплазматическая мембрана не выдерживает внутреннего давления и лопается. Данное явление носит название плазмоптиза.
Разделение микробов по отношению к величине осмотического давления
По отношению к величине осмотического давления выделяются несколько групп экстремофилов:
Галофилы – это осмофильные организмы, в том числе микробы, для развития которых необходимо высокая концентрация соли (NaCl).
Что называют осмотическим давлением
Поддержание адекватного объема одной или обеих (внутри- и внеклеточной) жидких сред организма является частой проблемой при лечении тяжелобольных. Распределение внеклеточной жидкости между плазмой и межклеточным пространством в основном зависит от уравновешивания сил гидростатического и коллоидно-осмотического давления, которые действуют на мембрану капилляров.
Распределение жидкости между внутри- и внеклеточной средами в основном определяется осмотическими силами мелких молекул растворенных веществ, преимущественно натрия, хлора и других электролитов, действующих по разные стороны мембраны. Причина этого распределения обусловлена свойствами мембран, проницаемость которых для воды высока, а для ионов даже очень небольшого диаметра, таких как натрий и хлор, практически равна нулю. Следовательно, вода быстро проникает через мембрану, а внутриклеточная жидкость, тем не менее, остается изотоничной по отношению к внеклеточной.
В следующем разделе рассмотрим взаимосвязь между внутри- и внеклеточной жидкостями и причины осмотического характера, способные влиять на перенос жидкости между этими средами.
В статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Теоретические основы осмоса и осмотического давления
Основы осмоса и осмотического давления изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). В этой статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Осмос — процесс диффузии воды через полупроницаемую мембрану. Он происходит из области с высокой концентрацией воды в область с ее низкой концентрацией. Растворение вещества в воде приводит к снижению концентрации воды в данном растворе. Следовательно, чем больше концентрация вещества в растворе, тем ниже в нем содержание воды. Кроме того, вода диффундирует из области с низкой концентрацией вещества (высоким содержанием воды) в область с высокой концентрацией вещества (низким содержанием воды).
Поскольку проницаемость мембраны клеток избирательна (она относительно низка для большинства растворенных веществ, но высока для воды), то при повышении концентрации вещества с одной стороны мембраны вода проникает в эту область путем диффузии. Если растворенное вещество, такое как NaCl, добавить во внеклеточную жидкость, вода будет быстро выходить из клетки до тех пор, пока концентрации молекул воды по обе стороны мембраны не уравняются. Если, напротив, концентрация NaCl во внеклеточной жидкости снизится, вода из внеклеточной жидкости устремится в клетки. Интенсивность, с которой вода диффундирует в клетку, называют осмотической силой.
а) Соотношение молей и осмолей. Поскольку концентрация воды в растворе зависит от количества в нем частиц вещества, под термином «концентрация вещества» (независимо от его химического состава) понимают общее число частиц вещества в растворе. Это число измеряют в осмолях. Один осмоль (осм) соответствует одному молю (1 моль, 6,02×10 23 ) частиц растворенного вещества. Следовательно, каждый литр раствора, содержащий 1 моль глюкозы, соответствует концентрации 1 осм/л. Если молекула диссоциирует на 2 иона, т.е. возникают две частицы (например, NaCl распадается на ионы Na+ и Сl-), то одномолярный раствор (1 моль/л) будет иметь осмолярность 2 осм/л. Аналогично раствор, содержащий 1 моль вещества, которое диссоциирует на 3 иона, например сульфат натрия Na2SО4, будет содержать 3 осм/л. Поэтому термин «осмоль» определяют, ориентируясь не на молярную концентрацию вещества, а на число растворенных частиц.
В целом осмоль — слишком большая величина, чтобы использовать ее в качестве единицы измерения осмотической активности жидких сред организма. Обычно используют 1/1000 осмоли — миллиосмолъ (моем).
б) Осмоляльность и осмолярность. Осмолялъностью называют осмоляльную концентрацию вещества в растворе, которая выражается в количестве осмолей на килограмм растворителя. Когда же речь идет о количестве осмолей в литре раствора, эту концентрацию называют осмолярностью. Для сильно разведенных растворов, которыми являются жидкие среды организма, справедливо использовать оба термина, т.к. разница значений невелика. Во многих случаях сведения о жидких средах организма легче выражать в литрах, чем в килограммах, поэтому в большинстве расчетов, используемых в клинике, а также в следующих главах, за основу принята не осмоляльность, а осмолярность.
в) Осмотическое давление. Осмос молекул воды через избирательно проницаемую мембрану может быть уравновешен силой, приложенной в направлении, обратном осмосу. Величину давления, необходимую для прекращения осмоса, называют осмотическим давлением. Таким образом, осмотическое давление является непрямой характеристикой содержания воды и концентрации веществ в растворе. Чем оно выше, тем меньше в растворе содержание воды и выше концентрация растворенного вещества.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021



