Что называют массовым числом
Массовое число
Из Википедии — свободной энциклопедии
Массовое число в обозначении конкретного нуклида (вида атомных ядер) пишется верхним левым индексом, например 232 Th. Нуклиды с одинаковым массовым числом называются изобарами (например, изобарами являются нуклиды 14 C и 14 N).
Массовое число совпадает с барионным числом ядра. Барионное число сохраняется во всех известных процессах, поэтому любые радиоактивные распады и ядерные реакции не приводят к изменению суммы массовых чисел ядер в левой и правой части реакции. Например, при альфа-распаде урана-238
92 238 U → 90 234 T h + 2 4 H e <\displaystyle <\mathsf <_<<\text< >>92>^<238>U\rightarrow <>_<<\text< >>90>^<234>Th+<>_<2>^<4>He>>>
в левой части массовое число начального ядра равно 238, в правой части реакции — два ядра с массовыми числами 234 и 4, что в сумме даёт 238. С учётом того, что массовое число альфа-частицы (ядра гелия-4) равно 4, альфа-распад снижает массовое число распадающегося ядра на 4 единицы. Любые типы бета-распада (бета-минус-распад, позитронный распад, электронный захват, все типы двойного бета-распада) не изменяют массовое число, поскольку в этом процессе происходит лишь превращение некоторых нуклонов ядра из одного вида в другой (протонов в нейтроны или обратно). Изомерный переход также не изменяет массовое число ядра.
Что называют массовым числом
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
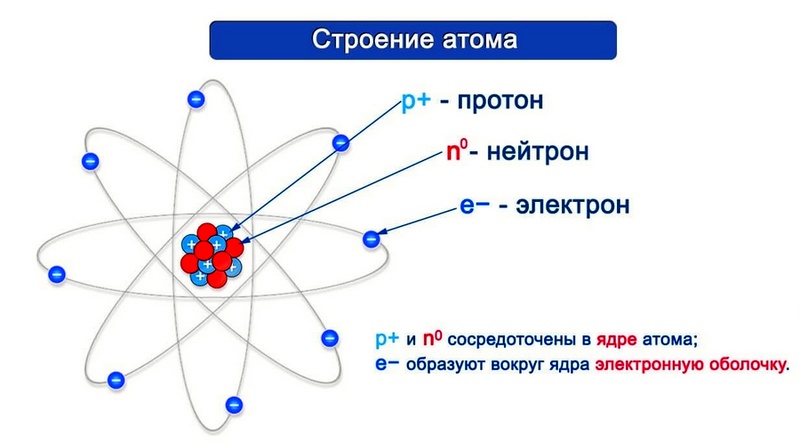
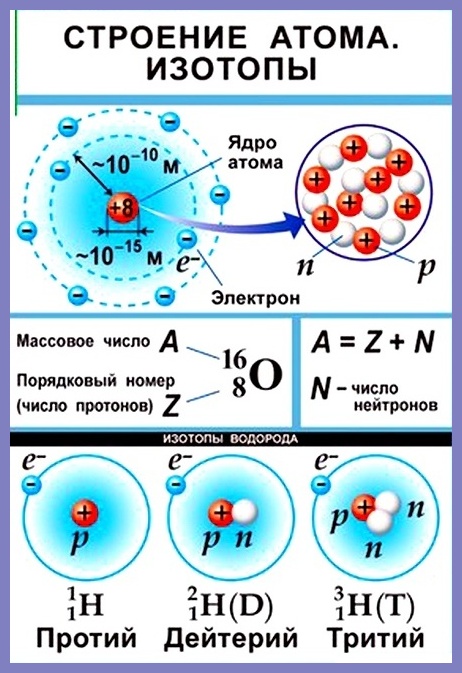
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
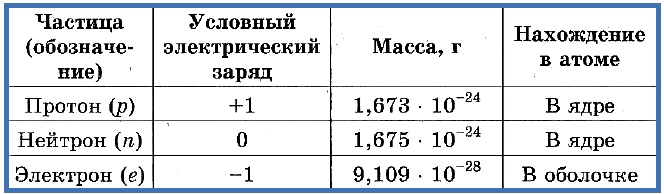
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
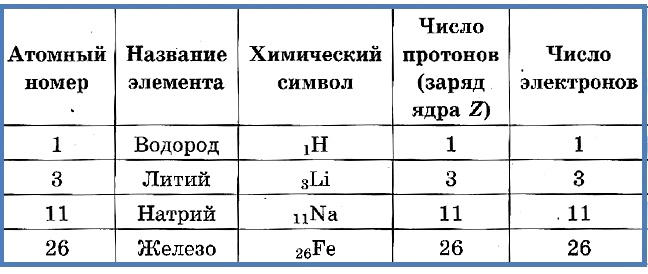
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23 Na или натрий-23.
Массовое число кислорода, А( 16 О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23 Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
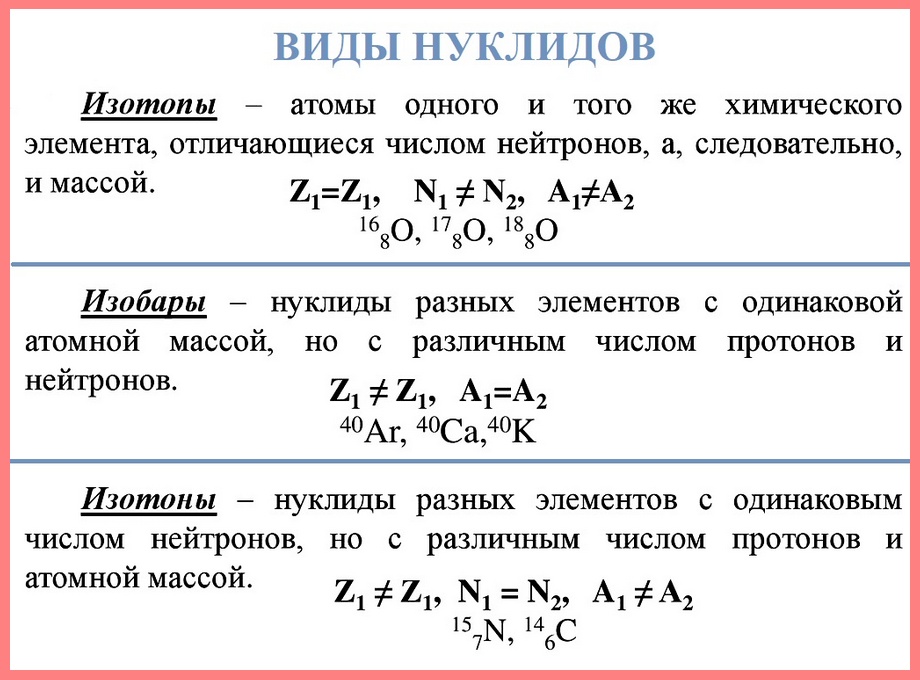
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16 О, 17 О и 18 О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16 О, 17 О и 18 О — это изотопы. Природные изотопы урана — 234 U, 235 U и 238 U.
Таблица 3. «Обозначение и название ионов»
Конспект урока по химии «Строение атома».
МАССОВОЕ ЧИСЛО
Смотреть что такое «МАССОВОЕ ЧИСЛО» в других словарях:
МАССОВОЕ ЧИСЛО — суммарное число нуклонов (нейтронов и протонов) в ат. ядре. Различно для изотопов одного хим. элемента. Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983. МАССОВОЕ ЧИСЛО … Физическая энциклопедия
МАССОВОЕ ЧИСЛО — число нуклонов в атомном ядре. Обычно указывается слева вверху у символа химического элемента (напр., 10В) … Большой Энциклопедический словарь
МАССОВОЕ ЧИСЛО — общее число нуклонов (протонов и нейтронов) в атомном ядре, обозначается А и указывается индексом вверху слева у символа соответствующего элемента, напр. 32S означает изотоп серы с массовым числом, равным 32 (А = 32). М. ч. изотопа равно целому… … Большая политехническая энциклопедия
массовое число — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва] Тематики электротехника, основные понятия EN mass number … Справочник технического переводчика
Массовое число — Для улучшения этой статьи желательно?: Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное. Дополнить статью (статья слишком короткая либо содержит лишь словарное определение) … Википедия
массовое число — число нуклонов в атомном ядре. Обычно указывается слева вверху у символа химического элемента (например, 10В). * * * МАССОВОЕ ЧИСЛО МАССОВОЕ ЧИСЛО, число нуклонов в атомном ядре. Обычно указывается слева вверху у символа химического элемента… … Энциклопедический словарь
массовое число — masės skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: angl. mass number; nuclear number; nucleon number vok. Massenzahl, f; Nukleonenzahl, f rus. массовое число, n; число… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
массовое число — masės skaičius statusas T sritis chemija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: angl. mass number; nuclear number; nucleon number rus. массовое число … Chemijos terminų aiškinamasis žodynas
массовое число — masės skaičius statusas T sritis fizika atitikmenys: angl. mass number; nuclear number; nucleon number vok. Massenzahl, f; Massezahl, f; Nukleonenzahl, f rus. массовое число, n pranc. nombre de masse, m; nombre de nucléons, m … Fizikos terminų žodynas
Массовое число — число нуклонов (протонов и нейтронов) в атомном ядре; обозначается буквой A и указывается обычно слева вверху рядом с символом элемента, например 32S означает изотоп серы с A = 32. М. ч. и заряд ядра Z, выраженный в единицах элементарного … Большая советская энциклопедия
Вопросы § 56
Физика А.В. Перышкин
1.Как называются протоны и нейтроны вместе?
Протоны и нейтроны вместе называются нуклоны.
2. Что называется массовым числом? Что можно сказать о числовом значении массы атома (в а. е. м.) и его массовом числе?
Массовым числом А называется количество нуклонов в ядре.
Массовое число равно массе ядра m выраженной в а.е.м., округленной до целых чисел.
3. Что можно сказать о зарядовом числе, заряде ядра (выраженном в элементарных электрических зарядах) и порядковом номере в таблице Д. И. Менделеева для любого химического элемента?
Число протонов в ядре называется зарядовым числом Z.
Зарядовое число равно заряду ядра выраженному в элементарных электрических зарядах и порядковому номеру в таблице Д. И. Менделеева.
4. Как связаны между собой массовое число, зарядовое число и число нейтронов в ядре?
А — Z + N, где А — массовое число, Z — зарядовое число, X — символ химического элемента.
5. Как в рамках протонно-нейтронной модели ядра объяснить существование ядер с одинаковыми зарядами и различными массами?
Это объясняется тем, что в таких ядрах находится одинаковое число протонов, но разное число нейтронов, такие разновидности химических элементов называются изотопами.
6. Какой вопрос возникал в связи с гипотезой о том, что ядра атомов состоят из протонов и нейтронов? Какое предположение пришлось сделать учёным для ответа на этот вопрос?
Так как протоны положительно заряжены, то между ними действуют силы электростатического отталкивания и ядра должны тогда распадаться. Чтобы разрешить данное противоречие (ядра стабильны) была высказана гипотеза, что между нуклонами действуют особые силы притяжения.
7. Как называются силы притяжения между нуклонами в ядре и каковы их характерные особенности?
Массовое число: что это такое и как получить (с примерами)
Содержание:
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 12 6С или углерод-12. А кроме углерода-14 есть 13 6C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
— Пример 1
В чем разница между 13 7 N и 14 7 N?
Ответить
— Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 201 80 Hg?
Ответить
Поскольку A = 201 и Z = 80, а также зная, что:
И делается вывод, что в атоме ртути 121 нейтрон.
Ссылки
90 великих цитат Уильяма Шекспира
Рэнди Гарднер: человек, который не спал 11 дней