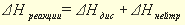Что называется энтальпией растворения
Что называется энтальпией растворения
Изменение энтальпии, происходящее при растворении одного моля вещества в определенном растворителе с образованием бесконечно разбавленного раствора, называется энтальпией растворения или теплотой растворения. Энтальпию растворения нетрудно измерить экспериментально.
Происходящее изменение энтальпии может быть объяснено двумя причинами.
Во-первых, при растворении должны быть разорваны связи между частицами, которые удерживают их вместе в твердом веществе. Во-вторых, эти частицы становятся сольватированными.
Рассмотрим в качестве примера растворение в воде какого-либо ионного кристалла. Прежде всего должно происходить изменение энтальпии, связанное с разрушением ионной решетки кристалла. Далее, происходит сольватация ионов в воде, иначе говоря, их гидратация. Весь этот процесс в целом может оказаться экзотермическим либо эндотермическим. Например, если хлорид натрия растворяется в воде, этот процесс сопровождается небольшим результирующим поглощением энергии, т.е. является эндотермическим.
Изменение энтальпии, которым сопровождается гидратация одного моля обоих типов этих газообразных ионов, называется энтальпией гидратации.
Значения энтальпий гидратации нельзя определить экспериментально. Однако их можно находить с помощью закона Гесса:
Рис. 5.15. Энтальпийная диаграмма растворения хлорида натрия в воде.
Таблица 5.11. Энтальпии гидратации ионов
Подставляя в последнее уравнение соответствующие значения для 
Как обычно, соотношение между этими тремя энтальпиями можно представить в графической форме с помощью энтальпийной диаграммы (рис. 5.15). Данная энтальпийная диаграмма не содержит исходного уровня, поскольку расчет не включает энтальпию образования веществ из составляющих их элементов в их стандартных состояниях. Кроме того, поскольку рассматриваются только изменения энтальпии, можно не пользоваться абсолютной шкалой энтальпии Н.
Энтальпия гидратации хлорида натрия представляет собой сумму энтальпий гидратации ионов натрия и хлорид-ионов:
Что называется энтальпией растворения
Глава 2. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
2.1. Теоретическая часть
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. Все химические процессы сопровождаются выделением или поглощением теплоты. Реакции, сопровождающиеся выделением теплоты из системы в окружающую среду, называются экзотермическими, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называется теплотой реакции Qр, а противоположная ему по знаку величина, описывающая изменение состояния системы в результате протекания реакции энтальпией реакции 
В качестве основной единицы измерения теплоты в системе СИ установлен джоуль. В качестве единицы измерения теплоты встречается также калория, равная 4,184 Дж. В настоящее время она сохраняется как внесистемная единица для сравнения результатов современных работ с экспериментальными и справочными данными, накопленными за многие предыдущие годы.
Для описания тепловых явлений в химических реакциях принято пользоваться так называемыми термохимическими уравнениями. Термохимические уравнения записываются как обычные уравнения химических реакций, но с указанием величины и знака теплового эффекта реакции. В случае экзотермических реакций с правой стороны уравнения отмечают количество выделившейся теплоты со знаком «плюс», а в случае эндотермических реакций — количество поглощенной теплоты со знаком «минус». При этом у формулы каждого вещества индексом указывается его физическое состояние: газообразное (г), жидкое (ж), кристаллическое (к) или раствор (р-р).Существует термодинамический способ записи термохимических уравнений — когда в самом уравнении тепловой эффект не указывается, а изменение энтальпии реакции (
В данной реакции Q > 0, соответственно, 
Расчеты тепловых эффектов химических реакций основаны на применении закона Гесса (1836 г.): Тепловой эффект химической реакции при постоянном давлении и объеме, не зависит от способа ее проведения, а зависит лишь от начального и конечного состояния реагирующих веществ.
Например, растворение безводного сульфата меди:






Значения теплоты растворения безводной соли Q и кристаллогидрата Q2 известны и составляют 66,11 и –11,5 кДж соответственно. Тогда тепловой эффект реакции образования кристаллогидрата может быть рассчитан по формуле:
Q1 = Q – Q2 = 66,11 кДж – (–11,51 кДж) = 77,69 кДж, (2.5)
соответственно энтальпия равна 
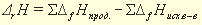
Например, значение энтальпии реакции между растворами сильной кислоты и сильного основания может быть получено по табличным данным энтальпий образования исходных веществ., если представить эту реакцию:, например
может быть получено по табулированным энтальпиям образования в виде реакций между ионами, поскольку эта реакция в действительности является реакцией между ионами H + и OH – :
Табличные значения энтальпий образования (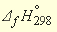




–285,84 – (–229,94) = –55,9 кДж/моль
При нейтрализации слабой кислоты сильным основанием или сильной кислоты слабым основанием тепловой эффект реакции будет зависеть от того, какая слабая кислота или слабое основание вступает в реакцию. (Другими словами от природы этих веществ). Это связано с тем, что слабые кислоты и основания существуют в растворах преимущественно в виде молекул. Например, при нейтрализации уксусной кислоты щелочью:
в действительности идет следующая реакция:
которой соответствует энтальпия 
В то же время реакцию (2.8) можно представить в виде суммы двух процессов:
1) диссоциации кислоты
CH3COOH = CH3COO + Н + 
2) и нейтрализации возникающих при этом ионов H + :
H + + ОН – = Н2О 
Тогда, по закону Гесса, энтальпия ее равна сумме энтальпий этих реакций:
Следовательно, если известныизмерить энтальпии реакций нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием, то по этим данным можно найти энтальпияю реакции диссоциации слабой кислоты может быть рассчитана по этим данным:
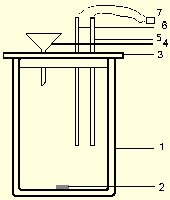
Общий вид используемой калориметрической установки
Рис.2.2 Схематическое изображение калориметрического стакана.
Если калориметрическая установка работает с компьютером, то сбор данных и построение графика осуществляется автоматически.
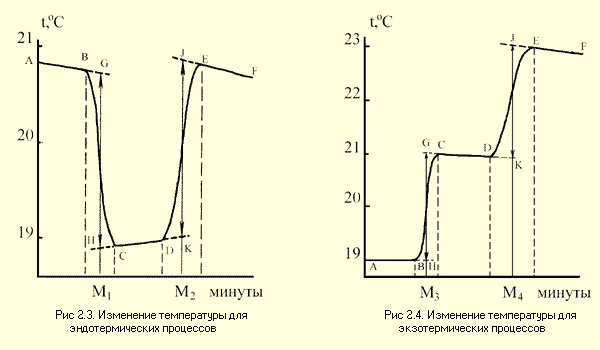
Примерные графики изменения температуры для экзотермических и эндотермических процессов представлены на рис.2.3 и 2.4.
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру установки (участок АВ на рис. 2.3 и 2.4).
Участок ВС на графиках соответствует собственно реакции: экзндотермической на рис. 2.3 и экзотермической на рис.2.4. В результате реакции наблюдается значительное изменение температуры калориметра (
Наличие небольшого наклона на графике температурной зависимости в начальном (АВ) и конечном (СD) периодах, свидетельствует о том, что во время опыта имеет место некоторый теплообмен калориметра с окружающей средой. В расчетах теплообмен учитывается следующим образом. Прямая AB экстраполируется вправо, а прямая CD влево. Интервал времени от B до C делится пополам и через эту точку проводится перпендикуляр к оси абсцисс до пересечения его с экстраполированными участками прямых АВ и СД (точки H,G). Величина отрезка HG соответствует изменению температуры калориметрической системы 
Тепловой эффект химической реакции может быть рассчитан по формуле
Q = K
Количество тепловой энергии qэл,, сообщенное калориметрической системе при нагреве,, вычисляется по формуле Джоуля:
Тепловое значение калориметра:
K = qэл/
Подставив значение K в формулу (2.11), получаем значение теплового эффекта реакции.
Измеренный тепловой эффект следует отнести к 1 моль вещества, для чего необходимо разделить его на число молей (n ) того из участников реакции, который находится в недостатке, тогда:
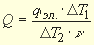
Увеличивается или уменьшается при этом энтальпия системы? Чему равно изменение энтальпии?
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами.. Экспериментально определить теплоты растворения кристаллогидрата CuSO4• 5H20O и безводной соли CuSO4. Оценить достоверность полученных результатов.
Дистиллированная вода, безводный CuSO4, CuSO4• 5H20O.
Калориметрическая установка, технические весы, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл.
2.2.4. Порядок выполнения эксперимента
Опыт 1. Определение теплоты растворения кристаллогидрата CuSO4•5H2O.
Начинающим рекомендуется работать вдвоем. Один студент следит за показаниями температуры и времени на дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» и диктует эти данные второму студенту, который заносит данные в таблицу 1 в рабочем журнале.)
Взвесьте с точностью до сотых 15 г CuSO4•5H2O.
В калориметрический стакан с помощью мерной колбы налейте 150 мл дистиллированной воды, температура которой должна быть близка к комнатной. Оставьте небольшое количество воды (
Опустите в калориметрический стакан сердечник магнитной мешалки и включите в розетку 220 В блок питания.
Нажмите кнопку включения на блоке питания (при этом на блоке питания должна загореться красная лампочка).
Нажмите и удерживайте в течение 2 сек. кнопку «ВКЛ» (рис.2 Приложения) на измерительном преобразователе «ЭКСПЕРТ-001-3» (при этом начнет светиться его жидкокристаллический дисплей). Первая надпись на ж/к дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» показывает уровень зарядки собственных аккумуляторов преобразователя. При величине менее 30 % необходимо зарядить аккумуляторы при помощи сетевого адаптера.
Вращая ручку включения магнитной мешалки, добейтесь оптимальной скорости вращения сердечника магнитной мешалки.
Выберите время работы электрического нагревателя (с) при определении теплового значения калориметра. Для этого на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3» нажмите кнопку «Ф2» и далее кнопку «ЧИСЛ». Цифровыми кнопками наберите время работы нагревателя, с. Рекомендуемое время 200 с. После установки времени нагрева два раза нажмите кнопку «ВВОД».
Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР».
Начните выполнение опыта, нажав кнопку «ИЗМ». На дисплее появятся данные работы секундомера, работающего в режиме прямого отсчета времени и значения температуры в калориметрическом стакане.
Определите тепловой ход калориметрической установки. (Участок АВ на рис. 2.3) При работе в ручном режиме записывайте в рабочий журнал в таблицу 1 показания температуры через каждые 30 с. в течение пяти минут. Если измерения показывают, что в течение 5 мин температурные изменения достаточно равномерны и невелики, начинайте эксперимент.
В определенный момент времени, отметив его в рабочем журнале, высыпьте в калориметрический стакан через сухую воронку приготовленную навеску кристаллогидрата сульфата меди CuSO4•5H2O. Оставшейся в мерной колбе водой смойте остатки соли с воронки.
| Время измерений, с | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 |
| Температура измерений, о С |
За счет растворения соли происходит быстрое изменение температуры, поэтому, пока наблюдается рост температуры, фиксирутефиксируйте значения температуры через возможно малые промежутки времени (каждые 5–10 с).
После того, как растворение соли закончится, изменение температуры замедлится и температурный ход снова станет равномерным (участок СD на рис. 2.3), продолжайте измерения температуры через 30 с. еще в течение 5 мин.
После отключения тока нагревателя, рост температуры замедлится, а затем температура начнет медленно падать. Фиксируйте изменение температуры через каждые 30 с еще в течение 5мин..
Нажмите клавишу «ОТКЛ» на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3».
Выполните команду «Стоп» на экране монитора компьютера.
При работе установки с компьютером измерения температуры в зависимости от времени в течении всего эксперимента будут фиксироваться автоматически. В результате на мониторе компьютера появиться график, соответствующий изменению температуры системы в течении всего эксперимента. После его окончания расечатайтераспечатайте полученный график на принтере.
Опыт 2. Определение теплоты растворения безводной соли CuSO4
Взвесьте с точностью до 0,01 г
Затем проведите опыт по определению теплоты растворения безводной соли CuSO4. Опыт выполняется так же, как и опыт 1.
Результаты температурных измерений представьте в виде графика.
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Экспериментально определить теплоты нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием. Оценить достоверность полученных результатов.
Дистиллированная вода, 0,4 М HCl, 0,4 M CH3COOH, 6 М KOH.
Калориметрическая установка, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл
2.3.4. Порядок выполнения эксперимента
Опыт 3 Определение теплоты нейтрализации сильной кислоты сильным основанием
Определение теплоты нейтрализации сильной кислоты и сильного основания проводите в калориметрической установке, которая была описана выше.
С помощью мерной колбы налейте в калориметрический стакан 150 мл 0,4 М. раствора соляной кислоты. Оставшиеся в колбе следы соляной кислоты смойте в калориметр небольшим количеством дистиллированной воды.
В мерный цилиндр налейте 12 мл 6 М раствора КОН.
Опустите в калориметрический стакан сердечник магнитной мешалки, включите блок питания установки и, вращая ручку регулировки вращения магнитной мешалки, добейтесь оптимальной скорости ее вращения.
Выберите время работы электрического нагревателя, так как это описано в опыте 1. Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР» и начните выполнение опыта, нажав кнопку «ИЗМ».
Для того, чтобы результаты измерения фиксировались компьютером, одновременно выполните команду «СТАРТ» в меню программы«Expert001.exe» измерения данных на компьютере.
Определите тепловой ход калориметрической установки (участок АВ на рис. 2.4), записывая в таблицу 1 показания температуры через каждые 30 с. в течение 5 минут.
Влейте через воронку в калориметрический стакан 12 мл 6 М раствора КОН и с этого момента записывайте изменение температуры в калориметрической системе через возможно малые интервалы времени (5-10 с).
После того, как температура стабилизируется, в течение 5 минут фиксируйте изменение температуры через каждые 30 с.
Определите тепловое значение калориметрической установки как это описано в опыте 1 и закончите эксперимент нажатием клавиши «ОТКЛ». Выполните команду «Стоп» на экране монитора компьютера.
Постройте график зависимости температуры калориметрической системы в зависимости от времени или распечатайте его на компьютере.
Опыт 4. Определение теплоты нейтрализации слабой кислоты сильным основанием
Работу проводите так же, как и в опыте 3, только для реакции нейтрализации возьмите 150 мл 0,4 М раствора уксусной кислоты.
Рк +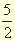
Чему равна энтальпия образования пентахлорида фосфора?
Что называется энтальпией растворения
Основы биохимии. Физическая химия
Энтальпия и энтропия

А.Теплота реакции и калориметрия
У многих химических реакций ΔG и ΔН имеют близкие значения (см., например, Б1 ). Это обстоятельство позволяет определять энергетическую ценность пищевых продуктов. В живых организмах пища обычно окисляется кислородом до СО 2 и H 2 O (см. с. 114). Максимальную химическую работу, которую питательные вещества могут совершить в организме, т. е. ΔG реакции окисления компонентов пищи, определяют путем сжигания взятой навески соответствующего вещества в калориметре в атмосфере кислорода. Выделившееся тепло повышает температуру воды в калориметре. По разности температур рассчитывают теплоту реакции (энтальпию сгорания).
Б. Энтальпия и энтропия
Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца :
Поясним зависимость этих трех величин на двух примерах.
ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ КРИСТАЛЛОГИДРАТОВ
Как известно, жизнь на Земле невозможна без протекания химических реакций. Они составляют основу создания и существования большинства современных предметов. Без химических реакций нашу планету не защищал бы озоновый слой, в недрах земли не скрывались бы полезные ископаемые. Поэтому химические реакции – одна из самых важных вещей на Земле, а их изучение – сложный, но очень полезный процесс.
Но охватить всю суть химических реакций в одном реферате невозможно. Можно лишь описать какую-то их сторону. Именно поэтому я и выбрала в качестве темы своего исследования, наверное, один из самых интересных и уж точно один из самых важных аспектов химических реакций – тепловой эффект.
Актуальность данной темы обуславливается тем, что термохимические данные, такие как энтальпия образования, теплоемкость лежат в основе разработки, внедрения и освоения высокоэффективных технологий производств.
Цель курсовой работы: рассмотреть основы термохимии, изучить калориметрический метод анализа, определить теплоту образования кристаллогидратов: железо сернокислое (FeSO4*7H2O), магний сернокислый (MgSO4*7H2O), никель сернокислый (NiSO4*7H2O).
Задачи курсовой работы:
На основе анализа учебно-методической литературы:
изучить основные понятия и законы термохимии;
изучить сущность калориметрии, структуру калориметра;
изучить основы методики калориметрических измерений.
При выполнении практической части работы:
определить теплоту образования кристаллогидратов в воде калориметрическим методом.
ГЛАВА 1. ТЕРМОХИМИЧЕСКИЕ ИЗМЕРЕНИЯ
1.1 Краткий очерк из истории термохимии
В конце XVIII века появились первые работы, посвящённые изучению тепловых эффектов химических реакций, с которых и началось становление термохимии. Выделение теплоты как одна из составляющих химического процесса рассматривалось уже во флогистонной теории. Следует отметить, что термохимия сразу же приобрела важное практическое значение: определение теплоты горения различных видов топлива имело большое значение для техники. В первой половине XIX века химики рассматривали термохимию как важный инструмент для решения таких важнейших теоретических проблем химии, как изучение состава и строения вещества и определения сил химического сродства. Теплоту начали рассматривать и как возможную меру прочности соединения атомов и взаимодействия молекул.
Следует отметить, что во время возникновения термохимии взгляды на природу теплоты существенно отличались от современных. Естествоиспытатели исходили из предположения, что существует некая невесомая материальная субстанция – теплород – высвобождающаяся либо поглощающаяся в ходе химической реакции.
Иное представление о теплоте как о форме движения мельчайших частиц материи (атомов) появилось в XVII веке. Этих воззрений придерживались Фрэнсис Бэкон, Рене Декарт, Исаак Ньютон, Роберт Гук. Швейцарский математик и физик Даниил Бернулли предложил в 1734 г. уравнение, связывающее давление газа с движением атомов. Михаил Васильевич Ломоносов, развивая свою корпускулярную философию, детально разработал положения кинетической теории теплоты. Однако без доказательства существования атомов кинетические воззрения на природу теплоты не могли найти всеобщего признания. В 1798 г. Бенджамин Томпсон (граф Румфорд), описав выделение большого количества тепла при высверливании канала в пушечном стволе, посчитал это экспериментальным доказательством того, что теплота является формой движения. Конечно, факт выделения тепла при трении был известен с незапамятных времен; однако сторонники теории теплорода усматривали в этом явлении нечто аналогичное электризации тел трением – трение способствует выжиманию теплорода из тела. Румфорд, однако, показал, что из ограниченного количества материи может быть получено неограниченное количество теплоты. Получение теплоты с помощью трения подтвердили и опыты Гемфри Дэви, обнаружившего, что трение двух кусков льда друг о друга вызывает их плавление. После утверждения атомно-молекулярной теории теплородная теория теплоты в значительной степени поколебалась, однако в первой половине XIX века концепция теплорода разделялась большинством ученых.
Одним из первых систематическое изучение тепловых явлений начал английский химик Джозеф Блэк. Он сформулировал понятия теплоёмкости тел и скрытой теплоты изменения агрегатного состояния вещества, указал на необходимость различения между количеством и интенсивностью теплоты (температурой). С помощью изобретённого им калориметра Блэк в 1759-1763 гг. выполнил первые определения теплоёмкостей веществ и скрытой теплоты плавления льда и испарения воды.
Первые систематические опыты по измерению теплот химических реакций начали в 1780 г. французские химики Антуан Лоран Лавуазье и Пьер Симон де Лаплас. Обобщая результаты своих исследований, Лавуазье и Лаплас сформулировали правило, известное сейчас как первый закон термохимии (закон Лавуазье-Лапласа): «Если при соединении или при любом изменении состояния системы происходит уменьшение свободной теплоты, то эта теплота в полной мере появится вновь, когда вещества вернутся к своему первоначальному состоянию, и наоборот…».
Важнейшую роль в развитии термохимии сыграл русский химик Герман Иванович Гесс. В период с 1830 по 1850 гг. им был проведён ряд систематических исследований в области термохимии. В 1840 г. Гесс сформулировал фундаментальный закон термохимии – закон постоянства количества теплоты: «Каким бы путём не совершалось соединение, – имело ли оно место непосредственно или происходило косвенным путём в несколько приёмов, – количество выделившейся при его образовании теплоты всегда постоянно». Гесс не только открыл основной закон термохимии, доказав его экспериментально, но и широко применял этот закон для расчётов теплот различных процессов, которые невозможно определить непосредственно. Закон Гесса выражает принцип сохранения энергии применительно к химическим процессам, являясь следствием первого начала термодинамики. Гесс одним из первых высказал предположение, что определение теплоты реакции может дать возможность измерить химическое сродство; впоследствии эта идея легла в основу принципа максимальной работы Бертло-Томсена.
В 60-е годы XIX века независимо друг от друга два выдающихся исследователя – Пьер Эжен Марселен Бертло и Ханс Петер Юрген Юлиус Томсен высказали предположение о том, что тепловой эффект реакции является мерой химического сродства между реагентами. Основное положение данного подхода Бертло сформулировал следующим образом:»Теплота, выделяющаяся при реакции, служит мерой суммы физических и химических работ, совершаемых при этой реакции. …Принцип максимальной работы заключается в том, что всякое химическое превращение… стремится к образованию тела или системы тел, которые выделяют наибольшее количество тепла». Считая, что реакции самопроизвольно протекают лишь тогда, когда сопровождаются выделением теплоты, Бертло многие годы посвятил систематическому определению тепловых эффектов химических реакций. По его мнению, результаты термохимических измерений должны были позволить вычислять направление реакции и предвидеть принципиальную осуществимость химического взаимодействия.
Следует отметить, что принцип максимальной работы Бертло-Томсена критиковался многими современниками, поскольку далеко не все самопроизвольные реакции сопровождаются выделением теплоты; кроме того, уже были известны обратимые реакции. Тем не менее, хотя принцип максимальной работы не является общим законом природы, в ряде случаев (особенно в области низких температур) его можно было успешно использовать для предсказания направления реакции [2].
1.2.Основные понятия термохимии
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. При протекании химических реакций происходит разрыв химических связей между атомами в молекулах одних веществ и образование химических связей между атомами в молекулах других веществ. Разрыв химических связей связан с затратами энергии, а образование новых химических связей приводит к выделению энергии. Суммы энергий всех разорванных и всех образованных связей не являются равными, поэтому все реакции проходят либо с выделением, либо с поглощением энергии. Энергия может выделяться или поглощаться в виде звуковых волн, света, работы расширения или сжатия и т.п. В большинстве случаев энергия химической реакции выделяется или поглощается в виде тепла.
Тепловой эффект химической реакции.
Количество теплоты, которое выделяется или поглощается при протекании химической реакции, называется тепловым эффектом реакции.
Тепловой эффект реакции, протекающей в условиях постоянства давления и постоянства температуры (р = const, T = const), равен изменению энтальпии системы ∆Н.
Тепловой эффект химической реакции обозначается символами Q или ΔH, причем их значения равны по величине, но противоположны по знаку:
Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими.
Они характеризуются положительным тепловым эффектом (Q> >0), и соответственно уменьшением энтальпии (теплосодержания) системы (ΔH 0, а это приводит к образованию термодинамических неустойчивых веществ. В отличие от термодинамики, в термохимии выделяемую теплоту считают положительной, а поглощаемую – отрицательной. Теплота в термохимии обозначается Q. Единица измерения теплоты – Дж/моль или кДж/моль. В зависимости от условий протекания процесса, различают изохорный и изобарный тепловые эффекты.
Изохорным (QV) тепловым эффектом называют количество теплоты, которое выделяется или поглощается в ходе данного процесса при постоянном объеме (V = const) и равенстве температур конечного и начального состояния (Т1 = Т2).
Изобарным (Qр) тепловым эффектом называют количество теплоты, которое выделяется или поглощается в ходе данного процесса при постоянном давлении (р = const) и равенстве температур конечного и начального состояния (Т1 = Т2).
Для жидких и твердых систем изменение объема мало и можно принять, что Qр » QV. Для газообразных систем
где ∆n – изменение числа молей газообразных участников реакции
∆n = nпрод. реакции – nисх. веществ. (4.4)
Во всех случаях преобразование части внутренней (химической) энергии в тепловую (или другие виды) и наоборот, тепловой в химическую происходит в строгом соответствии с законом сохранения энергии и первым законом термодинамики.
В термохимии принято использовать термохимические уравнения — это уравнения химических реакций, в которых в левой части равенства приведены исходные вещества, а в правой – продукты реакции плюс (или минус), тепловой эффект, а также показано агрегатное состояние веществ и их кристаллические формы. Например,
Н2 + 1/2О2 = Н2О(ж) — 289,95 кДж
С термохимическими уравнениями можно производить все алгебраические действия: складывать, вычитать, умножать, переносить члены и т.д.
Тепловые эффекты многих химических и физических процессов определяют опытным путем (калориметрия) или рассчитывают теоретически, используя величины теплот образования (разложения) и теплот сгорания тех или иных химических соединений.
Теплотой образованияданного соединения называется количество выделяющейся или поглотившейся теплоты при образовании 1 моля его из простых веществ в кДж. Теплоты образования простых веществ, находящихся при стандартных условиях в устойчивом состоянии, принимают за нуль. В реакциях
Чем больше выделяется теплоты при образовании соединения, тем, следовательно, больше теплоты необходимо затратить на разложение его, и тем прочнее данное соединение при обычных условиях. Химически устойчивыми и прочными веществами являются: SiO2, А12О3, Р2О5, КСl, NaCl и др. Вещества же, образующиеся с поглощением тепла, малоустойчивы (например, NO, CS2, С2Н2, HCN и все взрывчатые вещества). Теплоты образования органических соединений невозможно определить на опыте. Их рассчитывают теоретически по величинам теплот сгорания данных соединений, найденным опытным путем.
Величины тепловых эффектов химических реакций зависят от многих факторов: от природы реагирующих веществ, агрегатного состояния начальных и конечных веществ, условий проведения реакции (температуры, давления, объема систем, концентрации).
1.3. Закон термохимии
Большинство термохимических расчетов основано на важнейшем законе термохимии, которым является закон Гесса. Этот закон, установленный русским ученым Г.И. Гессом в 1840 г., называют также основным законом термохимии.
тепловой эффект химической реакции зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса.
Например, тепловой эффект реакции окисления углерода (графит) в оксид углерода (IV) не зависит от того, проводится ли это окисление в одну стадию (при непосредственном сжигании углерода) до углекислого газа:
или реакция протекает через промежуточную стадию образования оксида углерода (II):
с последующим дожиганием угарного газа в углекислый газ:
Эти превращения можно представить следующей схемой:
При обоих способах проведения процесса система переходит из одного и того же начального состояния (графит) в одно и то же конечное состояние оксид углерода (IV). В соответствии с законом Гесса тепловой эффект реакции 1 равен сумме тепловых эффектов реакций 2 и 3:
Используя закон Гесса можно вычислить тепловой эффект промежуточной стадии реакции, если известны общий тепловой эффект реакции и тепловые эффекты других ее промежуточных стадий.
Например, непосредственное экспериментальное определение теплового эффекта реакции окисления углерода в оксид углерода (II) ΔH2 (реакция 2) осуществить практически невозможно (при сгорании образуется смесь оксидов). Зная легко определяемые тепловые эффекты ΔH1 (реакция 1) и ΔH3 (реакция 3) на основании закона Гесса легко рассчитать тепловой эффект ΔH2 промежуточной стадии (реакция 2):
Из закона Гесса следует два важных следствия.
Энтальпия (тепловой эффект) химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов реакции.
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то энтальпию реакции называют стандартнойи обозначают ∆Н 0 или ∆. Верхний индекс отвечает стандартному давлению (101,3 кПа), нижний индекс соответствует стандартной температуре, принятой по международному соглашению равной 298 К.
Величина стандартной энтальпии реакции соответствует разности между энтальпиями исходного и конечного состояний реакции:
Энтальпия конечного состояния определяются суммой стандартных энтальпий (теплот) образования веществ, получившихся в результате реакции. Энтальпия начального состояния определяется суммой стандартных энтальпий (теплот) образования веществ, вступающих в химическую реакцию.
Стандартной энтальпией образования веществаназывается количество теплоты, которое выделяется или поглощается при образовании одного моля этого вещества из простых веществ при стандартных условиях (Р = 101,3 кПа, T = 298 К). Она измеряется в кДж/моль.
Теплота образования простого вещества, в наиболее устойчивой при стандартных условиях форме, принимается равной О.
Например, стандартная энтальпия реакции:
определяется по формуле:
где ∆Н 0 – стандартная энтальпия образования соединения, значение которой приводится в соответствующих таблицах [7].
Энтальпия (тепловой эффект) химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (с учетом коэффициентов):
Стандартная энтальпия сгорания (теплота сгорания) (∆H 0 сгор.)– это теплота, выделяющаяся при сгорании 1 моль вещества в кислороде при стандартных условиях с образованием оксида элемента в высшей степени окисления. Теплоты сгорания негорючих веществ равны нулю.
Данные по величинам стандартных энтальпий образования и сгорания многих веществ приводятся в справочных термодинамических таблицах.
Два следствия из основного закона термохимии делают термохимические уравнения похожими на математические.
В термохимических уравнениях реакций можно переносить члены из одной части в другую, почленно складывать, вычитать и сокращать формулы химических соединений. Однако, при этом следует учитывать коэффициенты в уравнениях реакций и агрегатное состояние веществ [7].
ГЛАВА 2. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ КРИСТАЛЛОГИЛРАТОВ
Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода — кристаллизационной.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат. Например, кристаллогидрат сульфата меди (медный купорос), содержащий на один моль CuSO4 пять молей воды, изображается формулой CuSO4*5H2O кристаллогидрат сульфатанатрия (глауберова соль)-формулой Na2SO4*10H2O [3].
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре. Так, прозрачные кристаллы соды Na2CO3*10H2O легко «выветриваются», — теряя кристаллизационную воду, становятся тусклыми и постепенно рассыпаются в порошок. Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание [3].
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается из теплового эффекта собственно растворения и теплового эффекта гидратации. Поскольку первый из этих процессов эндотермичен, а второй экзотермичен, то общий тепловой эффект процесса растворения, равный алгебраической сумме тепловых эффектов отдельных процессов, может быть как положительным, так и отрицательным [6].
Теплота образования кристаллогидратов.
Сущность калориметрии. Описание калориметра.
Описание калориметрической установки и методика проведения опытов. Экспериментальное определение тепловых эффектов реакций, протекающих в растворах, проводят с помощью установки, показанной на рисунке 1.
Рис. 1. Схема калориметрической установки
По данным таблицы постройте на миллиметровой бумаге график зависимости изменения температуры от времени. На рис.2. приведен примерный вид этого графика.
Рис. 2. Изменение температуры раствора в ходе реакции.
ГЛАВА 3. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ТЕПЛОТВ ОБРАЗОВАНИЯ
Цель работы: Определение теплоты образования: FeSO4*7H2O, MgSO4*7H2O, NiSO4*7H2O.