Гтф в биохимии что такое
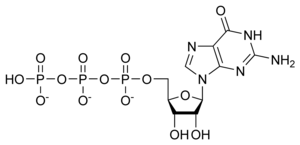
Гуанозинтрифосфат
| Гуанозинтрифосфат | |
 | |
| Общие | |
|---|---|
| Сокращения | ГТФ, GTP |
| Традиционные названия | Гуанозинтрифосфат |
| Эмпирическая формула | C10H16N5O14P3 |
| Физические свойства | |
| Молярная масса | 523,18 г/моль |
| Термические свойства | |
| Классификация | |
| Рег. номер CAS | 86-01-1 |
| SMILES | c1nc2c(n1[C@H]3[C@@H]([C@@H]([C@H](O3)CO[P@@](=O)(O)O[P@](=O)(O)OP(=O)(O)O)O)O)[nH]c(nc2=O)N |
Биологическая роль
ГТФ является субстратом для синтеза РНК в процессе транскрипции. Структура ГТФ похожа на гуаниловый нуклеозид, но отличается наличием трёх фосфатных групп, присоединённых к 5′ атому углерода. [1]
ГТФ играет роль как источник энергии для активации субстратов в метаболических реакциях, при этом ГТФ более специфичен, чем АТФ. Используется как источник энергии в биосинтезе белка.
ГТФ принимает участие в реакциях передачи сигнала, в частности связывается с G-белками, и превращается в ГДФ при участии ГТФаз. [2]
Примечания
монофосфаты (АМФ • ГМФ • UMP • ЦМФ) • дифосфаты (АДФ • ГДФ • УДФ • ЦДФ) • трифосфаты (АТФ • ГТФ • УТФ • ЦТФ) • циклические (цАМФ • цГМФ • cADPR)
Полезное
Смотреть что такое «Гуанозинтрифосфат» в других словарях:
gTP гуанозинтрифосфат — gTP, гуанозинтрифосфат * GTP, гуаназінтрыфасфат * gTP or guanosine triphosphate см … Генетика. Энциклопедический словарь
ГТФ — гуанозинтрифосфат … Словарь сокращений русского языка
Гуанозинтрифосфорная кислота — Гуанозинтрифосфат, ГТФ Гуанозинтрифосфат (ГТФ, GTP) это пуриновый нуклеотид. Биологическая роль ГТФ является субстратом для синтеза РНК в процессе транскрипции. Структура ГТФ похожа на гуаниловый нуклеозид, но отличается наличием трёх фосфатных… … Википедия
гуанозин — нуклеозид, состоящий из пуринового основания гуанина и углевода рибозы. В живых организмах входит в состав нуклеиновых кислот, ряда коферментов и других биологически важных веществ. Гуанозинтрифосфат богатое энергией соединение, участвующее в… … Энциклопедический словарь
ГИЛМАН (Gilman) Альфред — (р. 1941) американский фармаколог. Установил совместно с М. Родбеллом молекулярный механизм передачи информации в организме между клетками и внутри клеток. Так же вместе с М. Родбеллом открыл белки посредники, связывающие гуанозинтрифосфат (т. н … Большой Энциклопедический словарь
ГУАНОЗИН — нуклеозид, состоящий из пуринового основания гуанина и углевода рибозы. В живых организмах входит в состав нуклеиновых кислот, ряда коферментов и других биологически важных веществ. Гуанозинтрифосфат богатое энергией соединение, участвующее в… … Большой Энциклопедический словарь
Гуанозин — нуклеозид (См. Нуклеозиды), состоящий из углевода рибозы (См. Рибоза) и азотистого основания гуанина; молярная масса 283,26, бесцветные кристаллы; tпл 235°C. Свободный Г. промежуточный продукт обмена веществ. Г. входит в состав… … Большая советская энциклопедия
Нуклеотиды — нуклеозидфосфаты, соединения, из которых состоят Нуклеиновые кислоты, многие Коферменты и др. биологически активные соединения; каждый Н. построен из азотистого основания (обычно пуринового или пиримидинового), углевода (рибозы или… … Большая советская энциклопедия
Рибосомы — внутриклеточные частицы, осуществляющие биосинтез белка; Р. обнаружены в клетках всех без исключения живых организмов: бактерий, растений и животных; каждая клетка содержит тысячи или десятки тысяч Р. Форма Р. близка к… … Большая советская энциклопедия
Углеводный обмен — процессы усвоения углеводов (См. Углеводы) в организме; их расщепление с образованием промежуточных и конечных продуктов (деградация, диссимиляция), а также новообразование из соединений, не являющихся углеводами (глюконсогенез), или… … Большая советская энциклопедия
Повышена гамма-ГТ: причины, что значит и о чем говорит
Гамма-ГТ — фермент, который участвует в процессе обмена кислот, оттока желчи. При повышении показателей возникают проблемы с пищеварением, воспаления различных внутренних органов. Уровень гамма-ГТ в крови определяют при помощи биохимического анализа.
Что такое Гамма-ГТ, нормы показателей для мужчин и женщин?
ГТГ — гамма глютамилтрансфераза, фермент который содержится в цитоплазме и лизосомах головного мозга, печени, почек, селезенки и поджелудочной железы, простаты. Если клетки этих органов разрушаются, фермент проникает в системный кровоток, повышается его концентрация в крови.
При каких симптомах назначают анализ на ГТГ?
Биохимический анализ крови для определения уровня гамма-ГТ может назначить терапевт, кардиолог, гастроэнтеролог при наличии следующих жалоб:
Диагностику проводят для выявления заболеваний печени, отслеживания динамики при инфаркте миокарда, циррозе, хронических гепатитах, раке поджелудочной железы. Анализ назначают людям с алкогольной зависимостью, для оценки воздействия некоторых лекарственных препаратов на печень.
Кровь для определения уровня гамма-ГТ берут из вены. За 48 часов до анализа нужно исключить из рациона жирную, соленую, жареную, тяжелую, пряную пищу. За 12 часов до забора биоматериала необходимо исключить физические нагрузки, не употреблять спиртные напитки, избегать стрессов, не посещать сауну и баню. Кровь нужно сдавать натощак, последний прием пищи — за 12 часов до обследования. Утром можно пить только чистую воду.
При каких патологиях повышаются показатели гамма-ГТ?
Увеличение концентрации ГТГ в крови может быть признаком следующих заболеваний:
Тест на ГТГ — один из самых чувствительных анализов для выявления застоя желчи. При холестазе показатели фермента повышаются раньше, чем возникает активность щелочной фосфатазы. Чем выше активность ГТГ, тем сильнее повреждена печень или желчевыводящие ходы. При опухолях печени, остром гепатите и холангите, алкогольной интоксикации, закупорке желчных протоков значения возрастают более, чем в 10 раз. При хроническом гепатите, циррозе и болезнях желчного пузыря — в 5-10 раз.
Высокие показатели гамма-ГТ наблюдаются у людей с лишним весом, алкогольной зависимостью, во время беременности. Концентрация фермента возрастает при длительном приеме противозачаточных таблеток, антибиотиков, противомикробных средств, антидепрессантов, препаратов для стимуляции синтеза тестостерона. Активность ГТГ возрастает при приеме медикаментов с ацетилсалициловой кислотой, парацетамолом, лекарств для снижения уровня холестерина, препаратов для лечения эпилепсии или туберкулеза.
Снижение показателей ГТГ наблюдается при гипотиреозе — снижении функций щитовидной железы, при декомпенсированном циррозе печени, при длительном приеме аскорбиновой кислоты.
Как нормализовать показатели?
Чтобы снизить уровень ГТГ, необходимо вылечить основное заболевание, прекратить прием медикаментов-индукторов, алкоголя.
Какие препараты может назначить врач:
Диета при высоком уровне ГТГ
Диетотерапия — одна из важных составляющих при лечении болезней печени, желчевыводящих путей. Для снижения показателей ГТГ нужно питаться дробно — принимать пищу 5-6 раз в день небольшими порциями. Последний прием пищи за 2 часа до сна. Суточная норма углеводов — 350-400 г, при этом быстрых углеводов должно быть не более 70 г. В день выпивать до 1,5 л жидкости.
Продукты мелко нарезать или измельчать в блендере. Блюда готовить на пару, запекать, варить. Пища должна быть средней температуры — 15-65 градусов, горячая и холодная еда стимулирует синтез желчи.
Разрешенные блюда и продукты:
Из рациона необходимо исключить жирные блюда, фастфуд, ограничить количество соли до 10 г в день. Полностью противопоказаны алкогольные и газированные напитки, пряности, любые кислые овощи, фрукты, копчености, консервы, колбасные изделия, какао.
Патологии печени, желчевыводящих путей могут долгое время протекать без выраженных симптомов. Боль, диспепсические расстройства часто появляется при запущенных формах болезни. Чтобы снизить риск развития заболеваний, необходимо отказаться от вредных привычек, правильно питаться, регулярно проходить профилактические осмотры.
Гтф в биохимии что такое
Активные формы кислорода (АФК) выступают в качестве основных свободнорадикальных веществ, играющих ключевую роль в этиологии и патогенезе различных нозологических форм, в том числе патологии, связанной с употреблением алкоголя. Данные субстанции отвечают за формирование состояния окислительного стресса, при котором продукция свободных радикалов превалирует над возможностью компонентов антиоксидантной системы по их нейтрализации.
Окислительный стресс рассматривается не только как простой дисбаланс в соотношении генерации и устранения АФК, но и как проявление нарушения функционирования ферментов, вовлеченных в образование свободных радикалов. Одним из важнейших ферментативных направлений может считаться работа супероксидпродуцирующих энзимов, главными из которых является семейство НАДФН-оксидаз [1; 2].
Цель исследования: анализ данных литературы в аспекте значимости НАДФН-оксидаз в патогенезе алкоголизма.
НАДФН-оксидазы (КФ 1.6.99.6) или ферменты «дыхательного взрыва» представляют собой сложные ферментные комплексы, основная функция которых связана с генерацией активных форм кислорода [3]. Другие ферменты (циклооксигеназы, ферменты дыхательной цепи, семейство цитохромов) продуцируют активные кислородные метаболиты только в качестве побочных продуктов при выполнении основной функции и расцениваются как вторичные пути образования АФК.
Общая функция НАДФН-оксидаз, расположенных на плазматической мембране, заключается в переносе электронов от цитозольного НАДФН2 (никотинамидадениндинуклеитидфосфат восстановленный) через кофермент ФАД (флавинадениндинуклеотид) и гем к кислороду с формированием супероксидного анион-радикала и пероксида водорода [4].
Экспрессия НАДФН-оксидаз наблюдается в клетках фагоцитарного ряда (нейтрофильные лейкоциты, макрофаги) для обеспечения устранения чужеродных веществ белковой и иной природы. В умеренных, нецитотоксических количествах ферменты синтезируются в нефагоцитирующих типах клеток для выполнения регуляторных функций [5].
Выделяют семь изоформ НАДФН-оксидаз, среди которых пять вариантов представляют ферментные комплексы типа NOXs (NADPH oxidases): NOX-1, 2, 3, 4, 5. Две формы относят к DUOX (dual oxidases): DUOX-1, 2 [6; 7].
Структурно ферменты семейства NOXs представлены белковыми компонентами, объединенными в комплекс. Мультимерный ферментный комплекс NOX1, открытый 20 лет назад, осуществляет свое функционирование посредством активности каталитической субъединицы NOX1 [8; 9].
Каталитическая субъединица NOX1 имеет общие структурные характеристики с другими представителями семейства NOXs. В связи с тем что все описываемые ферментные комплексы являются трансмембранными НАДФН-оксидазами, в данном участке имеется НАДФН-связывающий участок в области С-конца белковой цепи, участок связывания кофермента ФАД и шесть высококонсервативных доменов [10].
Активация NOX1 сопряжена с взаимодействием с белком р22phox, который вызывает стабилизацию каталитической субъединицы. Дальнейшее формирование активности NOX1 связано с необходимостью присоединения предварительно фосфорилированного цитоплазматического белка р47phox к уже образованному комплексу NOX1/p22phox.
Белок р47phox, известный также как нейтрофильный цитозольный фактор-1 (NCF-1, neutrophil cytosolic factor 1), выполняет функцию сопровождения (шаперон) другого цитоплазматического белка р67phox к образуемому комплексу NOX1.
Данный белок (р67phox) предназначен для запуска конформационных изменений в доменах каталитической субъединицы, что способствует переносу электронов от НАДФН2 к кислороду [11].
Дополняет комплекс ГТФ-аза Rac1 (Ras-related C3 botulinum substrate 1), способствуя соединению р67phox с мембраной и каталитической субъединицей NOX1 [12].
В фагоцитирующих клетках основной изоформой НАДФН-оксидаз является NOX2, открытая в 1986 г. [13]. Для функционирования NOX2, как и для NOX1, регуляторные субъединицы мультимерного ферментного комплекса включают: мембраносвязанный протеин р22phox, белок р47phox, Rac1. Дополнительный белок комплекса NOX2 представлен протеином р40phox (нейтрофильный цитозольный фактор-4, neutrophil cytosolic factor 4, NCF-4). Данный протеин вовлечен в механизмы базальной продукции АФК [14].
Изоформа NOX3 структурно и функционально родственна NOX1 и NOX2. Необходимо отметить, что экспрессия данного вида НАДФН-оксидаз в 50 раз выше в клетках вестибулярного и кохлеарного отделов внутреннего уха по сравнению с другими клетками организма человека [15].
Особой изоформой ферментов семейства NOXs, которая синтезируется в эндотелиальных клетках кровеносных сосудов, считается NOX4. В отличие от других вариантов НАДФН-оксидаз, данный фермент является пероксид-генерирующим. Возможно, указанный момент связан с отличительными чертами его строения. Так, NOX4 для функционирования использует только один регуляторный белок р22phox. Также установлено, что для активности NOX4 требуется белок, взаимодействующий с полимерами [16].
Изоформа NOX5 имеет существенные особенности строения и работы по сравнению с другими представителями семейства NOXs. Это единственная форма фермента, осуществляющая генерацию супероксида без использования регуляторных субъединиц типа «phox» и «Rac». Кроме того, в структуре присутствует N-концевой кальмодулиноподобный домен, содержащий четыре участка связывания для катионов кальция, что может свидетельствовать о возможности регуляции каталитической активности путем изменения интрацеллюлярного уровня катионов кальция [17].
Ферменты DUOX1, DUOX 2 функционируют в комплексе с активирующими белками А1 и А2 (DUOXА1, DUOXА2), которые образуют ковалентные связи с каталитическими протомерами. Сформированный комплекс обеспечивает продукцию пероксида водорода [18].
Основываясь на данных о высоком уровне экспрессии в клетках щитовидной железы, указанные ферменты идентифицируют как тиреоидные оксидазы, но их наличие определяется и в нетиреоидных тканях [19]. Синтезируемый в ходе реакции пероксид водорода необходим для осуществления функциональной активности тиреопероксидазы в рамках образования гормонов щитовидной железы [18].
Одним из важных механизмов повреждения клеточных структур при таком распространенном заболевании, как алкоголизм, считается усиление продукции свободных радикалов. Существуют различные способы, с помощью которых происходит активация формирования АФК при алкогольной патологии. В целом широко применяется понятие «алкоголь-индуцированный окислительный стресс» [20].
В аспекте значимости НАДФН-опосредованной продукции АФК при алкогольной патологии выявлено, что моделирование влияния этилового алкоголя на активность НАФДН-оксидазы вызывает активацию фермента путем индуцирования транслокации белка р47phox по редокс-зависимому механизму.
Показательно, что аскорбиновая кислота предупреждала этанол-индуцированную генерацию супероксида [21]. Также в экспериментах с оценкой воздействия интраперитонеального введения 25 %-ного раствора этанола мышам линии C57D/6J показано, что основные изменения экспрессии NOX1 происходят в нервной ткани: увеличен уровень мРНК NOX1, DUOX2 [22].
В другом экспериментальном исследовании токсического влияния этилового алкоголя на активность каталитических субъединиц и уровень мРНК регуляторных субъединиц ферментов семейства NOX отмечено увеличение активности DUOX2 и уровня мРНК для белков p22phox и p67phox. Использование ингибитора НАДФН-оксидазы – дифениленйодония – предотвращало алкоголь-зависимое увеличение активности НАДФН-оксидаз в тканях алкоголизированных мышей [23].
Важную роль в механизмах формирования компонентов нервной системы Miozzo F. et al. (2018) отводят ферментам ДНК-метилтрансферазам, регуляция активности которых зависит от посттранскрипционных механизмов.
Данные механизмы опосредованы НАДФН-зависимой продукцией активных кислородных метаболитов. Авторами продемонстрировано влияние этилового алкоголя на механизмы регуляции активности различных изоформ ДНК-метилтрансфераз. С использованием нейронной клеточной линии-предшественника и первичных эмбриональных фибробластов мыши показано, что этанол увеличивает уровень мРНК ДНК-метилтрансфераз в результате влияния активных форм кислорода, образованных НАДФН-оксидазами.
Применение другого ингибитора НАДФН-оксидазы – апоцинина – при анализе эффектов алкоголя устраняло повышение активности NOX2 и увеличение генерации супероксида в крови крыс линии Wistar [24]. Аналогичным образом апоцинин воздействует на экспрессию NOX2 в ткани аорты алкоголизированных крыс указанной линии [25].
Применение ингибиторов фермента создает предпосылки для оценки эффективности превентивной терапии с использованием лекарственных веществ, обладающих антиоксидантным потенциалом. Так, в альвеолярных макрофагах, где НАДФН-оксидазный путь генерации АФК является основным, отмечено увеличение экспрессии NOX1, 2 in vivo и in vitro при анализе влияния алкоголя на организм человека и животных соответственно. Пероральное введение экзогенного глутатиона восстанавливало его внутриклеточный пул в альвеолярных макрофагах мышей и устраняло негативное влияние этилового спирта в отношении экспрессии NOX1, 2 [26; 27].
Кроме классических антиоксидантных веществ оценивалось действие иных классов лекарственных средств, для которых антиоксидантный эффект не отмечается в качестве основного. В этом аспекте кардиоселективный бета-блокатор III поколения – невиболол – предупреждал этанол-зависимую, НАДФН-опосредованную продукцию АФК по механизму уменьшения экспрессии каталитической субъединицы NOX2 и экспрессии ГТФ-азы Rac-1 в ткани почек алкоголизированных крыс линии Wistar [28].
Помимо нейронов, ткани аорты, альвеолярных макрофагов, ткани почек, анализировалось состояние клеток костной ткани при воздействии этилового алкоголя в отношении системы ферментов НАДФН-оксидаз. Считается, что в норме НАДФН-зависимая продукция супероксидного анион-радикала в остеокластах – это фактор, обеспечивающий их дифференцировку. При моделировании хронического действия этанола in vitro Chen J. et al. (2011) отмечали активацию NOX 1,2,4 в остеобластах. Предположительно данное обстоятельство может быть механизмом, который лежит в основе модификации остеообразовательных процессов и стимуляции резорбтивных явлений (активация дифференцировки остеокластов) при хроническом злоупотреблении алкоголя in vivo. Это подтверждается эффектом дифениленйодония, вызывающего уменьшение процессов резорбции костной ткани [29].
Алкоголизация мышей, «нокаутированных» по белку р47phox, показала, что в данном случае потеря функциональной активности NOX2 является положительным фактором, поскольку не происходит активации остеокластов [30]. Также отсутствие действия NOX4 у мышей в условиях алкогольной зависимости продемонстрировало протективное влияние данного вида модификации активности фермента в отношении остеобластогенеза [31].
Особое внимание отводится НАДФН-зависимым механизмам свободнорадикального повреждения гепатоцитов при алкогольной патологии. Исследование протективных эффектов индол-3-карбинола, проявляющего антиоксидантные и противовоспалительные свойства, на экспериментальной модели алкоголь-индуцированного повреждения ткани печени у мышей выявило существенное уменьшение проявлений окислительного стресса в печеночной ткани, которое, в частности, выражалось в увеличенной активности NOX4. Применение данного вещества также устраняло высокую интенсивность перекисного окисления липидов мембран гепатоцитов и уровень главного тиолового антиоксиданта – восстановленного глутатиона [32].
Гепатопротективный эффект лекарственных средств при хроническом воздействии алкоголя изучался в работе, посвященной применению метилферуловой кислоты в условиях влияния этанола на клетки. Использование указанного соединения, помимо устранения гиперферментемии (аланиновая аминотрансфераза, АЛТ; аспарагиновая аминотрансфераза, АСТ), оказывало благоприятное влияние на ферментативную составляющую антиоксидантной системы (супероксиддисмутаза, каталаза, глутатионпероксидаза). Выявленные изменения активности ферментов антиоксидантной защиты отрицательно коррелировали с уровнем экспрессии NOX4. Механизмом развития данных эффектов феруловой кислоты авторы считают ингибирование сигнального пути, сопряженного с участием NOX4, АФК и митоген-активируемых протеинкиназ [33].
Кроме феруловой кислоты, другие соединения фенольной природы растительного происхождения также тестировались относительно эффективности использования при алкогольной болезни печени. В частности, флавоноид фисетин оценивался в качестве средства, способного оказать положительный эффект на интенсивность свободнорадикального окисления в печени при экспериментальном моделировании токсического влияния этанола. Длительный эксперимент по алкоголизации мышей на фоне введения фисетина выявил его потенциал в следующих направлениях:
1) уменьшение активности в крови ферментов – АЛТ, АСТ;
2) снижение уровня экспрессии в печени NOX4 и одновременное падение уровня супероксидного анион-радикала и 4-гидроксиноненаля в печеночной ткани;
3) предупреждение алкоголь-индуцированного апоптоза гепатоцитов [34].
Научный поиск фармакологических агентов, способных нормализовать морфологические параметры и функциональное состояние печени при алкоголизме, также связан с изучением возможности воздействия на деятельность митохондрий. Так, оценка экспрессии NOX4 в ткани печени и митохондриальной фракции гепатоцитов при влиянии этилового алкоголя, проведенная Sun Q. et. al. (2017), показала индукцию экспрессии данной изоформы NOX. Это сопровождалось повышением уровня активных форм кислорода в митохондриях. «Нокаутирование» по NOX4 восстанавливало электрохимический потенциал митохондрий, снижало митохондриальный уровень супероксида с одновременным повышением уровня аденозинтрифосфата и соотношения окисленных и восстановленных форм никотинамидадениндинуклеотида [35].
Кроме печени, отмечается также НАДН-опосредованное повреждение клеток половой системы при алкогольной патологии. Считается, что половые клетки одни из наиболее чувствительных к длительному злоупотреблению алкоголем. Это связано с индукцией ферментов микросомальной этанолокисляющей системы клеток и сопровождается угнетением биологических и метаболических эффектов гормонов группы тестостерона. Снижение эффективности действия гормонов объясняется ускорением их биотрансформации с образованием неактивных форм.
Проведенные исследования по оценке уровня активности НАДФН-оксидаз в клетках придатка яичка показали увеличение скорости образования свободнорадикальных форм кислорода в результате действия данных ферментов при экспонировании клеток этанолом. Исследователи считают, что обнаруженные изменения определяют одновременное повышение содержания маркера окислительной деструкции ДНК – модифицированного дезоксигуанозина – в указанных клетках. С тем же изменением активности ферментов «дыхательного взрыва» предположительно связаны выраженные фибротические изменения в ткани органа.
Таким образом, данные литературы свидетельствуют о том, что:
а) продукция АФК, осуществляемая НАДФН-оксидазами, интенсифицируется при воздействии этилового алкоголя на клеточные структуры;
б) указанные изменения имеют печеночную и внепеченочную локализацию;
в) ингибиторы НАДФН-оксидаз и вещества с антиоксидантной активностью устраняют негативные проявления и последствия влияния алкоголя в отношении экспрессии различных изоформ NOXs.