Д воздуха в химии это что
Химия, Биология, подготовка к ГИА и ЕГЭ
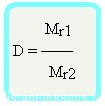
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 г\моль • D
Mr(вещества)=29 г\моль • 1.448 = 42 г\моль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 г\моль · 0.8571=36 г\моль
x=Mr(Cx)\Ar(C)=36 г\моль ÷ 12 г\моль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 г\моль · 0.1429=6 г\моль
x=Mr(Hy)\Ar(H)=6 г\моль ÷ 1 г\моль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 г\моль ·1.05=42 г\моль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y\2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V\22,4 л\моль = 33.6\22.4=1.5
Соотношение х : y\2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
Наше вещество — C3H6 — пропен
Еще на эту тему:
Обсуждение: «Относительная плотность по… задачи»
Поясните, пожалуйста, как решать задачу : Укажите относительную плотность по кислороду паров дибромпроизводного алкана, молекула которого содержит 5 атомов углерода.
Спасибо.
Так. давайте по-порядку:
1) у нас дибромпроизводное алкана, содержащего 5 атомов С, т.е. его формула будет С5H10Br2
2) Mr( С5H10Br2 )= 230 г\моль
3) указать надо плотность паров по кислороду, т.е. нам нужна Mr (O2). Mr(O2)=32 г\моль
и, наконец,
4) D = Mr (( С5H10Br2 ) \ Mr(O2) = 230\32 = 7,1875
Спасибо, Лолита. Была у меня загвоздка с 4-м пунктом. Делила наоборот.
Спасибо Вам большое за помощь и прекрасные и доступные объяснения (уже не в первый раз 🙂 ).
Ой как приятно! И вам спасибо за добрый отзыв! Кстати, у вас осталось 2 тематических комментария — и вы получите подарочек от сайта! 🙂
Здравствуйте! Бьюсь над такой задачей. Если можете — помогите. Относительные плотности по неону паров высшего хлорида и бромида одного и того же элемента равны соответственно 8,5 и 17,4. Установите элемент. Буду признательна!
Добрый день! Все решается по формулам:
Mr(ЭxCly) = Mr(Ne) * D(Ne) = 8.5 * 20 г/моль = 170 г/моль;
M(ЭxBry) = Mr(Ne) * D(Ne) = = 17.4 * 20 г/моль = 348 г/моль;
Методом подбора по таблице Менделеева
Если хлора 1 атом, то Ar(Э) = 170-35.5 =134.5 г\моль
нет такого элемента
Если хлора 2 атома, то Ar(Э) = 170-71 =99г\моль
Возможно, это Те
Проверим по брому: Ar(Э) =348-160 = 188
не подходит
Значит, элемент трехвалентный — считаем, там тоже не подходит.
Остается валентность 4:
Ar(Эх) = 28 г\моль — получаем либо кремний: SiCl4 \SiBr4, либо галогеналкен: C2Cl4 \С2Br4
Оксид трехвалентного металла массой 12г восстановили смесью водородом с оксидом углерода. В результате реакции образовалось 5,4г воды и 413,2г диоксида углерода. Определите металл.
Э2О3 + 2H2 + CO = 2Э + 2H2O + CO2
n(H2O)=m\Mr = 0.3 моль
n(Э2О3) = 0.15 моль
Mr=m\n=12\0.15 = 80 г\моль
Ar(Me)=(80-48)\2 = 16 — такого металла нет
Пробуем по CO2:
n(CO2)=m\Mr=413.2\44 = 9.4 моль
n(оксида)=n(CO2)
Mr=m\n = … не получается
Проверьте условие задачи. Что-то там не то с числами…
CxHy+O2 = xCO2 + y/2H2O
Что означает уравнение реакции? сколько атомов вступило в реакцию, столько же и образовалось, Значит, если в веществе х атомов С (Сх), то и CO2 будет х молекул.
Если водорода вступило y атомов, то образуется y\2 молекул воды.
Проще на примере:
допустим, сожгли этан:C2H6
вот уравнение:
С2Н6 + O2 = 2CO2 + 3H2O
Понятно?
Здравствуйте,помогите пожалуйста с задачей:при сжигании органического в-ва массой 8.6 г получили V(СО2)=13.44 дм3 и m(H2O)=12.6г.
Относительная плотность этого в-ва по кислороду равна 2.6875.
определите молекулярную формулу в-ва.
Относительная плотность вещества по воздуху = M(вещества) \ M(воздуха) (29 г\моль)
Относительная плотность вещества по водороду = M(вещества) \ M(H2)
M(вещества)=M(N2)*D=28г\моль*1.57
M(Cx)=M(вещества)*0.818
X=M(Cx)\12 г\моль
Количество водорода = М(вещества)-М(Сх)
Ответ вам уже дан 🙂
Здраствуйте,смотрите я не могу понять как это решить((
1.Укажите относительную плотность карбона(IV) оксида с азотом
2.Укажите малярную масу газов относительная густота какого за водородом равняеться 32
3.Укажите относительную густоту пропану за C3H3воздухом
4.Укажите формулу газа который тяжелее воздуха(надеюсь вы мне ответите по тому что я в химии полный ноль()
W(H)=14,3%
Относительная плотность по водороду 21.
Найти формулу CхHy
Добрый день!
Тут все ровно по 2-м формулам:
M(CxHy)=21*2 г\моль = 42 г\моль
M(Hy)=42 г\моль* 0.143 = 6 г\моль
y = M(Hy)\Ar(H) = 6\6 = 1
значит, M(Cy)=42-6 = 36 г\моль
y = M(Cy)\Ar(C) = 36\12 = 3
C3H6
Помогите пожалуйста. Природный газ состоящий из этана, пропан, метана имеет относительную плотность по водороду 10.8. Рассчитайте массовую долю углерода в газе.
Помогите, пожалуйста, решить задачу:
Плотность смеси озона с кислородом по водороду равна 18. Найти, исходя из этого, объёмный состав смеси.
Средняя молярная масса смеси равна M(смеси) = M(H2)*D(H2) =18*2 = 36 г/моль
Пусть доля кислорода в ней будет Х, тогда доля озона будет 1 — Х
Тогда уравнение будет выглядеть так:
16Х = 12
Х = 0,75 ии 75 %
В смеси 75 % кислорода и 25 % озона
Относительные плотности по водороду оксидов элементов Х и Y равны, соответственно, 14 и 15. Определите формулы этих оксидов. Как решить, пожалуйста!
Добрый день!
M( оксида 1) = 14*2 г\моль = 28 г\моль, предположим, что в оксиде 1 атом О, тогда 12 г\моль — атомная масса элемента. Это С
M( оксида 2) = 15*2 г\моль = 30 г\моль. Если у нас 1 атома О, то 14 г\моль — приходится на элемент, но такого в Периодической системе нет. Предположим, то элемент одновалентный, т.е. оксид состоит из двух атомов элемента, по 7 г\моль — это Li
Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 4,9 пропустили над нагретым паладиевым катализатором. При этом образовалась газовая смесь с плотностью по водороду на 20% больше исходной газовой смеси. Определите объемные доли веществ в полученной газовой смеси
Что такое D воздуха?
Что такое D воздуха?
Имеется в виду относительная плотность газа по воздуху!
Очевидно, что между Dвозд и 29г / моль у автора вопроса отсутствует знак умножения, ибо
М = Dвозд * 29г / моль
2Cherry, хотя, он на верняка не прочитает ((( Это Вам, пофих, какую букву в формуле писать, а в науке физ.
Химии и химии, вообще, существуют установившаяся система обозначений.
Как называются мельчайшие капли жидкости в воздухе?
Как называются мельчайшие капли жидкости в воздухе?
Такие, как от освежителя воздуха.
Установите молекулярную формулу сложного эфира, имеющего такую же плотность паров по воздуху, как и предельная одноосновная карбоновая кислота, содержащая 53, 33 % кислорода?
Установите молекулярную формулу сложного эфира, имеющего такую же плотность паров по воздуху, как и предельная одноосновная карбоновая кислота, содержащая 53, 33 % кислорода.
Что такое воздух?
Как можно доказать состав воздуха?
Воздух и его состав?
Воздух и его состав.
Дайте характеристику химических свойств воздуха?
1 : Что такое фильтрование и фильтрат?
1 : Что такое фильтрование и фильтрат?
Какие вещества и материалы могут использоваться для изготовления фильтра?
2 : Приведите примеры способов фильтрования воздуха, которые используются в быту и на производстве?
3 : Что такое центрифугирование?
На чем основан этот процесс?
Где он применяется.
Почему воздухоплаватели наполняют воздух не водородом, а горячим воздухом?
Почему воздухоплаватели наполняют воздух не водородом, а горячим воздухом?
Верно ли утверждения о воздухе : 1?
Верно ли утверждения о воздухе : 1.
Воздух иногда имеет запах?
Малярная масса воздуха, что такое жидкий воздух, где его применяют?
Малярная масса воздуха, что такое жидкий воздух, где его применяют?
Какие есть молекулы в воздухе к примеру : воздух и духи?
Какие есть молекулы в воздухе к примеру : воздух и духи.
Состав воздуха?
И чему равно молекулярная масса воздуха?
1)2K2CrO4 + 16HCl = 2CrCl3 + 3Cl2 + 4KCl + 8H2O 2)Cu + 2NaNO3 + 2H2SO4 = 2NO2 + CuSO4 + Na2SO4 + 2H2O 3)3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
Я попаду в рай. Смотри фотку.
Количества вещества находится по формуле : n(P) = m(P) / M(P) = 12, 4 / 31 = 0, 4 моль. Это же элементарно.
Решение : M(P) = 31г / моль m(P) = 12. 4г n(P) = m / M = 12. 4 / 31 = 0. 4моль Ответ : 0. 4моль.
C2H5OH + H2SO4конц = C2H4 + H2SO4aq C2H4 + HCl = C2H5Cl C2H5Cl + KOH(сп) = C2H4 + KCl + H2O C2H4 + H2O(H + ) = C2H5OH.
Воздух
Содержание:
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Воздух
Молекулярная и химическая формула воздуха, в основном азот N₂ и кислород О₂. Воздух – естественная смесь газов, образующая атмосферу Земли.
В 1774 г. французский ученый А. Лавуазье доказал, что воздух — это смесь в основном двух газов: азота и кислорода, содержание азота составляет 4/5 и 1/5 кислорода (по объему).
Качественный состав воздуха можно доказать посредством следующего опыта. Заполненный воздухом колокол опускают в воду. В железную ложечку помешают кусочек фосфора, его зажигают и вносят под колокол. При этом вода в колоколе поднимается на 1/5, так как при горении фосфора расходуется только кислород. Газ, оставшийся под колоколом — азот, он в реакцию не вступает (рис. 16).
Рис. 16. Сжигание фосфора пои колоколом: а — горение фосфора; б — уровень волы поднялся на 1/5 объема
В конце XIX в. было установлено, что в состав воздуха, кроме кислорода и азота, входят пять газообразных веществ: аргон (Аr), ксенон (Хе), криптон (Кг), гелий (Не), неон (Ne). Эти газы называются благородными из-за их химической неактивности.
Кроме того, в воздухе содержатся оксид углерода (IV) и водяные пары. Примерный состав воздуха показан в табл. 6.
Антуан Лоран Лавуазье (1743—1794)
Французский ученый в 1774 г. установил состав воздуха, ввел понятия «химический элемент» и «химическое соединение». Лавуазье был автором первой классификации химических веществ и учебника «Элементарный курс химии».
Содержание углекислого газа (СО2) и водяных паров изменяется в зависимости от условий. Например, при сырой и теплой погоде в воздухе содержится больше водяных паров, а при сухой и прохладной — меньше. Процессы горения увеличивают долю оксида углерода (IV) и уменьшают содержание кислорода.
Состав воздуха
| Составные части | Содержание газов (в %) | |
| по объему | по массе | |
| Азот | 78,08 | 75,50 |
| Кислород | 20,95 | 23,10 |
| Благородные газы (в основном аргон) | 0,94 | 1,30 |
| Оксид углерода (IV) | 0,03 | 0,046 |
В результате природных явлений и деятельности человека (при землетрясении, вулканических извержениях, при сгорании топлива и выбросах из заводских труб) в атмосферу поступают такие газы, как оксиды азота — NO и NO2, оксиды серы — SO2 и SO3, сероводород — H2S.
В настоящее время на долю автомобильного транспорта приходится больше половины всех вредных выбросов в окружающую среду, которые являются главным источником загрязнения атмосферы, особенно в мегаполисах. В среднем при пробеге 15 тыс. км в год каждый автомобиль сжигает 2 т топлива и около 26—30 т воздуха, в том числе 4,5 т кислорода, что в 50 раз больше потребностей человека.
Атмосферный воздух является одним из основных жизненно важных элементов окружающей среды.
Средства защиты атмосферы
Средства защиты атмосферы должны ограничивать наличие вредных веществ в воздухе на уровне не выше ПДК (предельно допустимой концентрации).
Для очистки газов от частиц широко применяют сухие пылеуловители — циклоны различных типов.
Один из наиболее совершенных видов очистки газов от взвешенных в них частиц пыли и тумана — электрическая очистка (электрофильтр).
Для высокоэффективной очистки выбросов применяют аппараты многоступенчатой очистки.
В крупных городах для снижения вредного влияния загрязнения воздуха на человека применяют специальные градостроительные мероприятия. Построены и строятся автомагистрали в обход городов, принявшие весь поток транзитного транспорта, который раньше нескончаемой лентой тянулся по городским улицам.
Предприятия или их отдельные здания и сооружения, технологические процессы которых являются источником выделения в атмосферный воздух неприятно пахнущих веществ, отделяют от жилой застройки санитарно-защитными зонами.
Для повышения эффективности санитарно-защитных зон на их территории высаживают древесно-кустарниковую и травянистую растительность, снижающую концентрацию промышленной пыли и газов.
Знаешь ли ты?
Атмосфера земного шара весит 5 300 000 000 000 000 т. Если бы, например, потребовалось перевезти из Астаны в Алматы груз, равный весу земной атмосферы, и если бы каждый поезд имел 100 вагонов и проходил весь путь за 10 ч, на перевозку этого груза было бы потрачено почти 4 млрд. лет.
Самое важное
В воздухе содержится (по объему) 78% азота, 21% кислорода, 1% инертных и других газов. Кроме вышеприведенных простых веществ, в составе воздуха находятся углекислым газ и водяные пары, содержание которых может изменяться в зависимости от условии.
Горение
В повседневной жизни мы часто наблюдаем, как горит такое топливо, как природный газ. дрова, уголь. Знаете ли вы, что горение происходит с участием кислорода, входящего в состав воздуха? Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называются реакциями горения. При горении атомы простых веществ соединяются с атомами кислорода и образуются оксиды. Общая схема взаимодействия простых веществ с кислородом такова:
| простое вещество + кислород = оксид |
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Оксиды — это сложные вещества, которые состоят из двух элементов, один из которых кислород. При горении веществ в воздухе образуются те же продукты, т. е. оксиды. Однако горение веществ в воздухе происходит медленнее, чем в кислороде, так как последнего в воздухе содержится примерно в пять раз меньше.
Если опустить в сосуд с кислородом О2, тлеющий уголек (рис. 17а), то он раскаляется добела и сгорает, образуя оксид углерода (IV) СО2 (углекислый газ):
Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — она мутнеет. Это доказывает наличие углекислого газа.
В железную ложечку поместим кусочек серы и подожжем над пламенем спиртовки, затем внесем в сосуд с кислородом. Сера S горит в кислороде О2 ярким синим пламенем (рис. 17 б) с образованием газа с резким запахом оксида серы (IV) (опыт проводится под тягой):
| сера + кислород = оксид серы (IV) |
Фосфор Р сгорает в кислороде О2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V) (рис. 17 в):
| фосфор + кислород = оксид фосфора (V) |
В кислороде горят и такие вещества (рис. 17 г), которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. Реакцию горения железа в кислороде можно выразить следующим уравнением:
| железо+кислород | железная окалина — (смесь оксидов железа) |
Другие металлы также могут взаимодействовать с кислородом, хотя эти реакции не всегда сопровождаются горением. Если сильно нагреть медь в кислороде, она, не сгорая, превратится в черный порошок — оксид меди (II):
Рис. 17. Горение в кислороде: а — угля; б — серы; в — фосфора; г — железа
Вам уже известно, что при горении простых веществ образуются оксиды, теперь выясним, как происходит горение сложных веществ. При горении парафиновой свечи в химическом стакане на его стенках появляются капельки воды. Если в стакан налить известковую воду, то она мутнеет, что доказывает наличие оксида углерода. Таким образом, при горении сложного вещества образовались оксиды тех элементов, которые входят в состав сложного вещества. Парафин состоит из двух элементов — углерода и водорода.
Медленное окисление
Если какое-либо вещество медленно реагирует с кислородом, то теплота выделяется постепенно. Такой процесс называется медленным окислением.
Это явление наблюдается довольно часто. Например, в процессе гниения (окисления) навоза выделяется теплота, которая может использоваться в парниках.
♦ Вещества, при горении которых выделяется большое количество теплоты, называют топливом. На практике используют топливо трех видов: твердое, жидкое и газообразное.
К твердому топливу относятся антрацит, каменный уголь, бурый уголь, торф и дрова; к жидкому — продукты переработки нефти: бензин, керосин, мазут и др.; к газообразному — природный и попутный нефтяной газы, а также другие промышленные газы.
Условия возникновения и прекращения горения
Огонь возникает, когда есть три составляющие (схема 5). Первая — это топливо, которым может служить дерево, бумага, спирт, газ и т. д Второе, что необходимо, — это кислород, который взаимодействует с топливом, результатом чего является горение. Третья необходимая составляющая — это тепло. Только нагретое до определенной температуры топливо будет гореть в воздухе. Для того чтобы погасить огонь, необходимо или перекрыть доступ кислорода, или максимально понизить температуру, или устранить источник возгорания (то, что горит).
При тушении огня на пламя направляют углекислый газ или пену, которые затрудняют доступ воздуха к горючему веществу. Небольшие очаги пожара можно потушить, накрыв их сверху брезентом или одеялом. Можно также использовать песок. Для тушения угля или горящей древесины используют воду. Она охлаждает их, а образующиеся водяные пары затрудняют доступ воздуха.
Самое важное
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Горение веществ в воздухе происходит медленнее, чем в кислороде. При горении простых и сложных веществ образуются оксиды. Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Образование основных и кислотных оксидов
Изучая горение серы, фосфора и железа, вы убедились, что металлы и неметаллы горят в воздухе, образуя оксиды. Для изучения свойств оксидов проделаем следующие опыты.
Опыт 1
В фарфоровую чашку помещаем немного свежепрокаленного оксида кальция СаО, (жженая известь), обливаем его водой. При этом выделяется большое количество теплоты, что свидетельствует о протекании химической реакции. В результате образуется рыхлый порошок гашеной извести, при растворении которого в воде получается мыльный на ощупь раствор. Изменение окраски лакмуса в синюю подтверждает об образовании основания. Схема реакции оксида кальция с водой следующая:
оксид кальция + вода  гидроксид кальция (основание) гидроксид кальция (основание) |
Растворимые в воде основания изменяют цвет индикаторов*.
* Информация индикаторах дана в § 11.
Из этого можно заключить, что оксиды металлов являются основными оксидами.
Опыт 2
Наливаем в химический стакан немного горячей воды, добавляем несколько капель раствора фиолетового лакмуса и сжигаем над водой в металлической ложечке красный фосфор. Образовавшийся в виде белого дыма оксид фосфора постепенно растворяется в воде, и образуется фосфорная кислота. Это подтверждает изменение окраски лакмуса на красную. Как видим, оксидам неметаллов соответствует кислота. Таким образом, оксиды неметаллов являются кислотными оксидами. Схема реакции:
оксид фосфора (V) + вода  фосфорная кислота фосфорная кислота |
Самое важное
При горении металлов образуется основной оксид. Основным оксидам соответствуют основания. Растворимые основания называются щелочами. При горении неметаллов образуются кислотные оксиды, им соответствуют кислоты. Существуют вещества, которые под действием кислот и щелочей изменяют свой цвет. Эти вещества называются индикаторами.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔ 
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.