Что значит типичный металл и неметалл
Металлы и неметаллы – в чем разница и как понять, когда металлические свойства усиливаются, а когда ослабевают
Одни отдают электроны, другие принимают.
Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
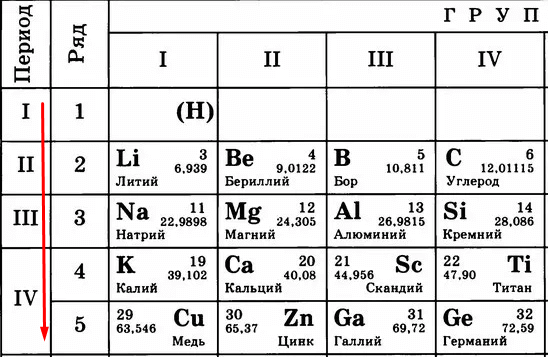
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.
Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:
Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в комментариях. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Буду рад каждому вашему отзыву и комментарию.
Что значит типичный металл и неметалл
Положение в периодической системе
У атомов металлов небольшое количество электронов (ē) на внешнем энергетическом уровне и большие радиусы атомов ( R )
Кристаллическая решетка – металлическая: состоит из чередующихся в пространстве атомов и положительных ионов, внутри-общие электроны– «электронный газ».
Тип химической связи – металлическая.
Металлические (восстановительные) свойства в группе (А п/гр) усиливаются (растет R атома , и электроны легче отрываются), в периоде – ослабляются (растет заряд ядра, электроны внешнего уровня сильнее удерживаются).
Восстановительные свойства уменьшаются (активность металлов уменьшается)
Li, Cs,Rb,K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Cd, Co, Sn, Ni, Pb, H2, Cu, Ag, Hg, Pt, Au
Наличие свободных электронов обуславливает:
· Пирометаллургия— получение из руд при высоких температурах при взаимодействии с хорошими восстановителями (H2, CO,C и др.)
Выделяют два этапа: 1) Обжиг металлсодержащей руды; 2) Получение чистого металла
· Металлотермия— восстановление металлами (алюминотермия, кальцийтермия, магнийтермия и т.д.):
· Гидрометаллургия— соединения металлов переводят в раствор и восстанавливают:
· Электрометаллургия – электролиз растворов и расплавов:
Запомнить: Алюминий получают из оксида (глинозема, бокситов и т.д.) в расплаве криолита Na 3 AlF 6
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Неметаллы
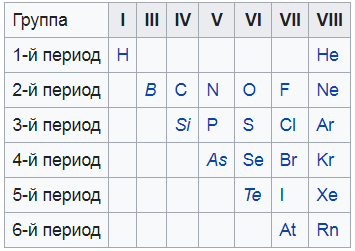
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | III | IV | V | VI | VII | VIII |
| 2-й период | B | C | N | O | F | Ne |
| 3-й период | Si | P | S | Cl | Ar | |
| 4-й период | As | Se | Br | Kr | ||
| 5-й период | Te | I | Xe | |||
| 6-й период | At | Rn |
Кроме того, к неметаллам относят также водород [источник?] и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
См. также
Полезное
Смотреть что такое «Неметаллы» в других словарях:
НЕМЕТАЛЛЫ — НЕМЕТАЛЛЫ, химические элементы, которые не обладают свойствами, характерными для металлов. Неметаллы как правило плохие проводники тепла и электричества (они обычно являются изоляторами тепла и электричества). К неметаллам относятся углерод,… … Научно-технический энциклопедический словарь
НЕМЕТАЛЛЫ — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твердые тела бор,… … Большой Энциклопедический словарь
НЕМЕТАЛЛЫ — хим. элементы, которые образуют в свободном состоянии простые вещества, не обладающие физ. и хим. свойствами (см.); устаревшее название металлоиды. К Н. принято относить 22 элемента Периодической системы элементов Д. И. Менделеева (см.): водород … Большая политехническая энциклопедия
неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твёрдые тела бор,… … Энциклопедический словарь
Неметаллы — [nonmetals, metalloids] химические элементы, которые образуют простые тела, не обладающие характерными для металлов свойствами. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии Н, N, О, F, Cl … Энциклопедический словарь по металлургии
Неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов (См. Металлы). Название Металлоиды, которое иногда применяют для Н., выходит из употребления. К Н. относятся 22 элемента. Из них при… … Большая советская энциклопедия
НЕМЕТАЛЛЫ — простые в ва, не обладающие св вами металлов. Хотя резкой границы между металлами и Н. провести нельзя, к Н. принято относить благородные газы, водород, галогены, кислород, халькогены, азот, фосфор, мышьяк, углерод, кремний и бор … Большой энциклопедический политехнический словарь
НЕМЕТАЛЛЫ — хим. элементы, к рые образуют простые тела, не обладающие свойствами, характерными для металлов. К Н. обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; тв. тела бор, углерод, кремний, фосфор,… … Естествознание. Энциклопедический словарь
НЕМЕТАЛЛЫ — простые вещества, не обладающие свойствами металлов: они не имеют металлического блеска, нековки, плохо проводят теплоту и электричество. Резкой границы между неметаллами и металлами нет. К неметаллам относятся 22 элемента. Из них при нормальной… … Металлургический словарь
Неорганическая химия — Неорганическая химия раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических… … Википедия