Что значит одинаковая электронная конфигурация
Электронная конфигурация
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
С точки зрения квантовой механики электронная конфигурация — это полный перечень одноэлектронных волновых функций, из которых с достаточной степенью точности можно составить полную волновую функцию атома (в приближении самосогласованного поля).
Вообще говоря, атом, как составную систему, можно полностью описать только полной волновой функцией. Однако такое описание практически невозможно для атомов сложнее атома водорода — самого простого из всех атомов химических элементов. Удобное приближённое описание — метод самосогласованного поля. В этом методе вводится понятие о волновой функции каждого электрона. Волновая функция всей системы записывается как надлежащим образом симметризованое произведение одноэлектронных волновых функций. При вычислении волновой функции каждого электрона поле всех остальных электронов учитывается как внешний потенциал, зависящий в свою очередь от волновых функций этих остальных электронов.
В результате применения метода самосогласованного поля получается сложная система нелинейных интегродифференциальных уравнений, которая всё ещё сложна для решения. Однако уравнения самосогласованного поля имеют вращательную симметрию исходной задачи (то есть они сферически симметричны). Это позволяет полностью классифицировать одноэлектронные волновые функции, из которых составляется полная волновая функция атома.
Для начала, как в любом центрально симметричном потенциале, волновую функцию в самосогласованном поле можно охарактеризовать квантовым числом полного углового момента 








Содержание
Расшифровка электронной конфигурации
По историческим причинам в формуле электронной конфигурации квантовое число 























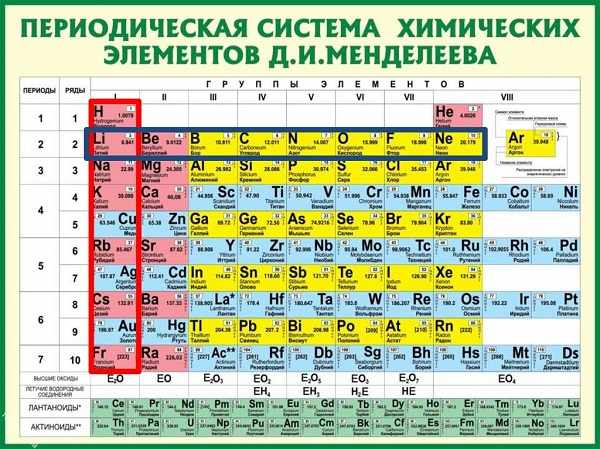
Периодический закон и строение атома
Все занимавшиеся вопросами строения атома в любых своих исследованиях исходят из инструментов, которые предоставлены им периодическим законом, открытым химиком Д. И. Менделеевым; только в своём понимании этого закона физики и математики пользуются для истолкования зависимостей, показанных им, своим «языком» (правда, известен довольно ироничный афоризм Дж. У. Гиббса на этот счёт [1] ), но, в то же время, изолированно от изучающих вещество химиков, при всём совершенстве, преимуществах и универсальности своих аппаратов ни физики ни математики, конечно, строить свои исследования не могут.
Взаимодействие представителей этих дисциплин наблюдается и в дальнейшем развитии темы. Открытие вторичной периодичности Е. В. Бироном (1915), дало ещё один аспект в понимании вопросов, связанных с закономерностями строения электронных оболочек. C. А. Щукарев, ученик Е. В. Бирона и М. С. Вревского, одним из первых ещё в начале 1920-х годов высказал мысль о том, что «периодичность есть свойство, заложенное в самом ядре».
При том, что полной ясности в понимании причин вторичной периодичности нет до сих пор, существует взгляд на эту проблему, подразумевающий то, что одной из важнейших причин этого феномена является открытая С. А. Щукаревым кайносимметрия — первое проявление орбиталей новой симметрии (др.-греч. καινός — новый и др.-греч. συμμετρία — симметрия; «кайносимметрия», то есть «новая симметрия»). Кайносимметрики — водород и гелий, у которых наблюдается орбиталь s, — элементы от бора до неона (орбиталь — р), — элементы первого переходного ряда от скандия до цинка (орбиталь — d), а также — лантаноиды (термин предложен С. А. Щукаревым, как и актиноиды) (орбиталь — f). Как известно, элементы, являющиеся кайносимметриками, во многих отношениях имеют физико-химические свойства, отличные от свойств других элементов, принадлежащих к той же самой подгруппе.
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
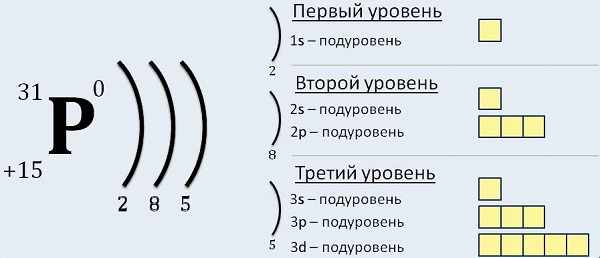
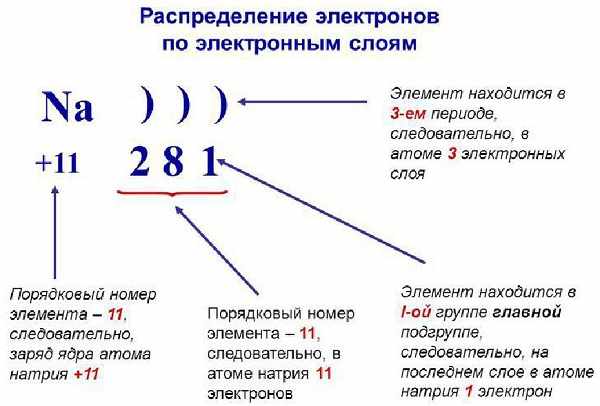
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
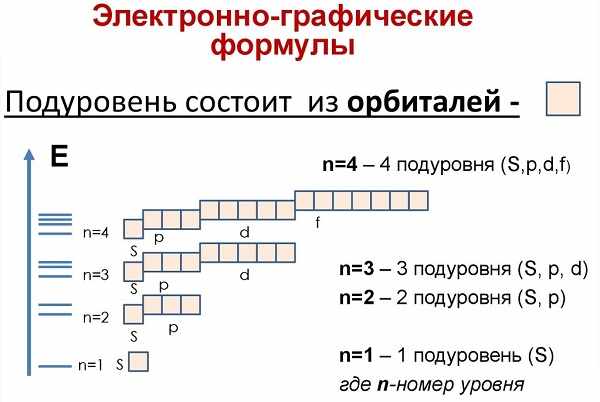
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Электронная конфигурация атомов и ионов
В химии есть очень увлекательный, но сложный раздел – электронная конфигурация атомов и ионов.
Молекулу любого из элементов таблицы Менделеева можно изучить с точки зрения как физики, так и химии.
Дивный молекулярный мир на атомном уровне отличается от привычного. Разберем подробно, как образуется электронная формула элементов.
Строение «электронных» оболочек атомов
Для лучшего понимания электронных окружающих ядро оболочек, нужно знать об ионе – частице, в основе которой, кроме электронов, присутствуют так называемые протоны.
Если число протонов больше числа электронов, то такой атом называется катионом (положительный заряд). В противном случае атом называется анионом (заряд отрицательный).
Каждый из электронов занимает свой собственный уровень относительно ядра.
Конфигурация электронов для отдельно взятого атома может строиться в порядке атомных чисел. В качестве первоначального элемента выбирается водород, а далее продолжается добавление одного протона к ядру согласно с подсхемой и местом в периодической таблице, пока не опишутся все химические элементы.
Такая процедура называется принципом Aufbau (Ауфбау). Название принципа происходит от немецкого слова и переводится «построить».
Можно сделать вывод, что появление ионов связано с моментом, когда атомы получают или теряют заряды. Катион (положительно заряженный ион) образуется, когда один или несколько зарядов удаляются из «родительского атома».
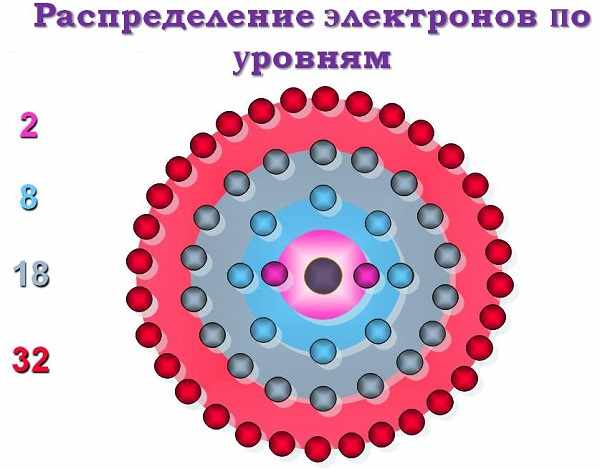
Распределение электронных зарядов по уровням
Как уже говорилось выше, молекула любого элемента периодической таблицы – это своеобразный микрокосмос, где в разные стороны (спины) двигаются заряженные частицы (лептон). По-английски spin означает «вращение». Их полуцелые «спины» были описаны Вольфгангом Паули в 1925 году.
Всего принципов построения графических распределительных схем существует три:
Теперь рассмотрим состав «квартир» для лептонов. В зависимости от уровня и энергии, орбитальные места можно разделить на четыре формы:
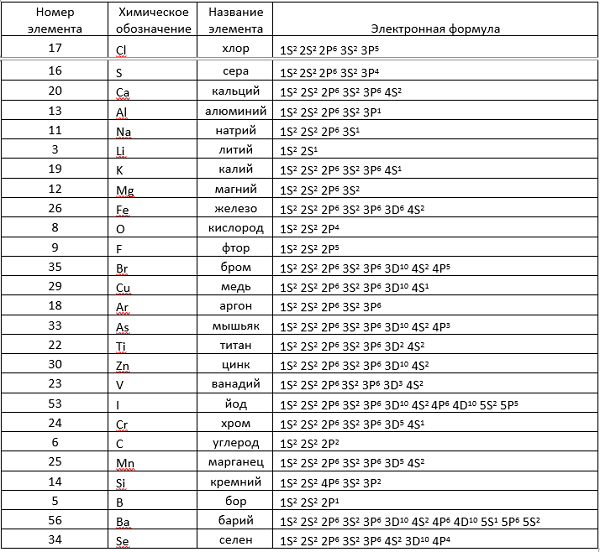
Электронные формулы химических элементов
Здесь приводится таблица-подсказка для некоторых химических элементов.
Теперь, руководствуясь данными таблицы, разберем электронные записи элементов на примере «аргона» (Ar).
В таблице Менделеева его номер восемнадцать. Руководствуясь описанным выше, высчитываем количество частиц (всего их 18).
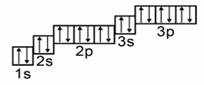
Ещё до построения электронно-графической формулы Аргона, вспомним, как формируются орбитали и строятся ячейки:
Начинаем распределять электроны Ar:
Графическое изображение формулы аргона
Важно знать: непарные заряды во внешних орбиталях, называемые валентными зарядами, отвечают за большинство химических и физических проявлений элементов.
Заключение
Чтобы немного отстранится от научных теорий, стоит пофантазировать. Представьте атомное ядро и окружающие его заряды вселенной. Ядро – это солнце, а заряды планеты. Формула наглядно описывает положение подобных «планет» в космосе (атомного вещества). Чтобы перейти с одного уровня на другой, потребуется большая энергия.
В квантовой физике некоторые специалисты выдвинули теорию о том, что при вмешательстве в структуру атома можно сделать объект невидимым. Ведь если подумать, то фотон (мельчайшая частица света) может не вступать в связь с электронами атома и, не встречая сопротивления, преодолевать объект.
Впечатляет? Химическая формула элемента очень важна для физики. Благодаря труду Менделееву и его таблице, нам стали доступны современные технологии. Химические формулы и эксперименты скучны и сложны, хочется верить, что эта статья сделала их более понятными.
Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
Содержание:
Электронная конфигурация атомов
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула. Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Количество электронов на внешнем энергетическом уровне определяется по таблице Менделеева. У элементов главных подгрупп номер группы – это и есть количество электронов на внешнем уровне. У элементов побочных подгрупп количество электронов на внешнем уровне не больше двух.
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.
Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.
Электронная конфигурация атома
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему. Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину. Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
Орбиталь
Орбитальное квантовое число l
Магнитное квантовое число ml
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0, Ml=1,Ml=2.
Спиновое квантовое число ms
Главное квантовое число n
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни и цветом разделены подуровни:
| 1 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 8 | |||||||||||||||||||
| Таблица 1. Распределение электронов по энергетическим уровням | |||||||||||||||||||
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у 24Cr, 29Cu, 41Nb, 42Mo, 44Ru, 45Rh, 46Pd, 47Ag, 78Pt, 79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #3, #12 и #21, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 2 2s 1 | 2 |
| 4 | Be | бериллий | 1s 2 2s 2 | 2 |
| 5 | B | бор | 1s 2 2s 2 2p 1 | 2 |
| 6 | C | углерод | 1s 2 2s 2 2p 2 | 2 |
| 7 | N | азот | 1s 2 2s 2 2p 3 | 2 |
| 8 | O | кислород | 1s 2 2s 2 2p 4 | 2 |
| 9 | F | фтор | 1s 2 2s 2 2p 5 | 2 |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 | 2 |
| 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 | 3 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 | 3 |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 | 3 |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 | 3 |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 | 3 |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 | 3 |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 | 3 |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 | 3 |
| 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 | 4 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | 4 |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | 4 |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | 4 |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | 4 |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 | 4 |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | 4 |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | 4 |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | 4 |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | 4 |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 | 4 |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | 4 |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | 4 |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | 4 |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | 4 |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | 4 |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | 4 |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 | 4 |
| 37 | Rb | рубидий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 | 5 |
| 38 | Sr | стронций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 | 5 |
| 39 | Y | иттрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 | 5 |
| 40 | Zr | цирконий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 | 5 |
| 41 | Nb | ниобий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 4 | 5 |
| 42 | Mo | молибден | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 5 | 5 |
| 43 | Tc | технеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5 | 5 |
| 44 | Ru | рутений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7 | 5 |
| 45 | Rh | родий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 8 | 5 |
| 46 | Pd | палладий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 | 5 |
| 47 | Ag | серебро | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 | 5 |
| 48 | Cd | кадмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 | 5 |
| 49 | In | индий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 | 5 |
| 50 | Sn | олово | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 | 5 |
| 51 | Sb | сурьма | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 3 | 5 |
| 52 | Te | теллур | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 | 5 |
| 53 | I | йод | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 | 5 |
| 54 | Xe | ксенон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 | 5 |
| 55 | Cs | цезий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 | 6 |
| 56 | Ba | барий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 | 6 |
| 57 | La | лантан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 | 6 |
| 58 | Ce | церий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 2 | 6 |
| 59 | Pr | празеодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 3 | 6 |
| 60 | Nd | неодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 4 | 6 |
| 61 | Pm | прометий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 5 | 6 |
| 62 | Sm | самарий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 6 | 6 |
| 63 | Eu | европий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 | 6 |
| 64 | Gd | гадолиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 5d 1 | 6 |
| 65 | Tb | тербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 9 | 6 |
| 66 | Dy | диспрозий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 10 | 6 |
| 67 | Ho | гольмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 11 | 6 |
| 68 | Er | эрбий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 | 6 |
| 68 | Tm | тулий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 13 | 6 |
| 70 | Yb | иттербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 | 6 |
| 71 | Lu | лютеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 1 | 6 |
| 72 | Hf | гафний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2 | 6 |
| 73 | Ta | тантал | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 3 | 6 |
| 74 | W | вольфрам | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 | 6 |
| 75 | Re | рений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5 | 6 |
| 76 | Os | осмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 6 | 6 |
| 77 | Ir | иридий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7 | 6 |
| 78 | Pt | платина | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 9 | 6 |
| 79 | Au | золото | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10 | 6 |
| 80 | Hg | ртуть | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 | 6 |
| 81 | Tl | таллий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1 | 6 |
| 82 | Pb | свинец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 | 6 |
| 83 | Bi | висмут | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 3 | 6 |
| 84 | Po | полоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 4 | 6 |
| 85 | At | астат | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 5 | 6 |
| 86 | Rn | радон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 | 6 |
| 87 | Fr | франций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 1 | 7 |
| 88 | Ra | радий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 | 7 |
| 89 | Ac | актиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 1 | 7 |
| 90 | Th | торий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 2 5f 0 | 7 |
| 91 | Pa | протактиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 2 6d 1 | 7 |
| 92 | U | уран | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 3 6d 1 | 7 |
| 93 | Np | нептуний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 4 6d 1 | 7 |
| 94 | Pu | плутоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1 | 7 |
| 95 | Am | америций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 | 7 |
| 96 | Cm | кюрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 6d 1 | 7 |
| 97 | Bk | берклий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 8 6d 1 | 7 |
| 98 | Cf | калифорний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 10 | 7 |
| 99 | Es | эйнштейний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 11 | 7 |
| 100 | Fm | фермий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 12 | 7 |
| 101 | Md | менделеевий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 13 | 7 |
| 102 | No | нобелий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 | 7 |
| 103 | Lr | лоуренсий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 1 | 7 |
| 104 | Rf | резерфордий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 2 | 7 |
| 105 | Db | дубний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 3 | 7 |
| 106 | Sg | сиборгий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 4 | 7 |
| 107 | Bh | борий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 5 | 7 |
| 108 | Hs | хассий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 6 | 7 |
| 109 | Mt | мейтнерий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 7 | 7 |
| 110 | Ds | дармштадтий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 8 | 7 |
| 111 | Rg | рентгений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 9 | 7 |
| 112 | Cn | коперниций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 | 7 |
| 113 | Nh | нихоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 1 | 7 |
| 114 | Fl | флеровий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 2 | 7 |
| 115 | Mc | московий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 3 | 7 |
| 116 | Lv | ливерморий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 4 | 7 |
| 117 | Ts | теннесcин | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 5 | 7 |
| 118 | Og | оганесон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 | 7 |
| Таблица 2. Электронная конфигурация атомов | ||||
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье «как написать электронную конфигурацию»