Что значит неинвазивная ивл
Искусственная вентиляция легких (ИВЛ): инвазивная и неинвазивная респираторная поддержка
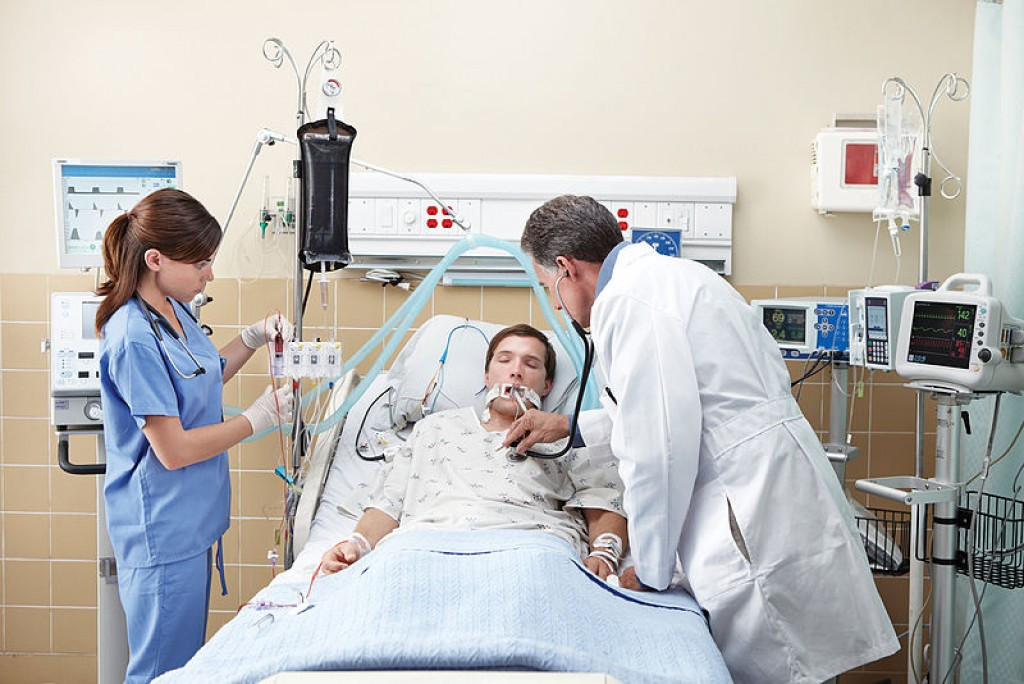
К искусственной вентиляции легких (ИВЛ) прибегают для оказания помощи пациентам с острой или хронической дыхательной недостаточностью, когда больной не может самостоятельно вдыхать необходимый для полноценного функционирования организма объем кислорода и выдыхать углекислый газ. Необходимость в ИВЛ возникает при отсутствии естественного дыхания или при его серьезных нарушениях, а также во время хирургических операций под общим наркозом.
Что такое ИВЛ?
Искусственная вентиляция в общем виде представляет собой вдувание газовой смеси в легкие пациента. Процедуру можно проводить вручную, обеспечивая пассивный вдох и выдох путем ритмичных сжиманий и разжиманий легких или с помощью реанимационного мешка типа Амбу. Более распространенной формой респираторной поддержки является аппаратная ИВЛ, при которой доставка кислорода в легкие осуществляется с помощью специального медицинского оборудования.
Показания к искусственной вентиляции легких
Искусственная вентиляция легких проводится при острой или хронической дыхательной недостаточности, вызванной следующими заболеваниями или состояниями:
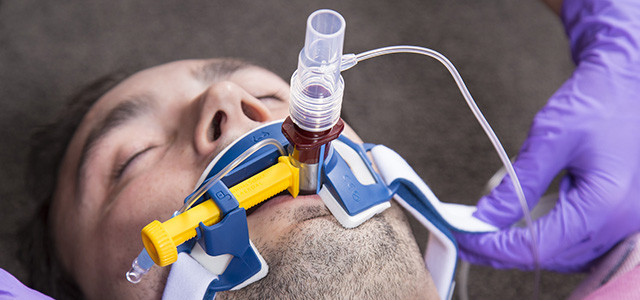
Инвазивная вентиляция легких
Эндотрахеальная трубка вводится в трахею через рот или через нос и подсоединяется к аппарату ИВЛ
При инвазивной респираторной поддержке аппарат ИВЛ обеспечивает принудительную прокачку легких кислородом и полностью берет на себя функцию дыхания. Газовая смесь подается через эндотрахеальную трубку, помещенную в трахею через рот или нос. В особо критических случаях проводится трахеостомия – хирургическая операция по рассечению передней стенки трахеи для введения трахеостомической трубки непосредственно в ее просвет.
Инвазивная вентиляция обладает высокой эффективностью, но применяется лишь случае невозможности помочь больному более щадящим способом, т.е. без инвазивного вмешательства.
Кому и когда необходима инвазивная ИВЛ?
Подключенный к аппарату ИВЛ человек не может ни говорить, ни принимать пищу. Интубация доставляет не только неудобства, но и болезненные ощущения. Ввиду этого пациента, как правило, вводят в медикаментозную кому. Процедура проводится только в условиях стационара под наблюдением специалистов.
Инвазивная вентиляция легких отличается высокой эффективностью, однако интубация предполагает введение пациента в медикаментозную кому. Кроме того, процедура сопряжена с рисками.
Традиционно инвазивную респираторную поддержку применяют в следующих случаях:
Как работает аппарат инвазивной ИВЛ?
Принцип работы приборов для инвазивной ИВЛ можно описать следующим образом.
Особенности оборудования для инвазивной вентиляции
Оборудование для инвазивной вентиляции легких имеет ряд характерных особенностей.
Неинвазивная вентиляция легких
За последние два десятилетия заметно возросло использование оборудования неинвазивной искусственной вентиляции легких. НИВЛ стала общепризнанным и широко распространенным инструментом терапии острой и хронической дыхательной недостаточности как в лечебном учреждении, так и в домашних условиях.
Одним из ведущих производителей медицинских респираторных устройств является австралийская компания ResMed
НИВЛ — что это?
Неинвазивная вентиляция легких относится к искусственной респираторной поддержке без инвазивного доступа (т.е. без эндотрахеальной или трахеостомической трубки) с использованием различных известных вспомогательных режимов вентиляции.
Оборудование подает воздух в интерфейс пациента через дыхательный контур. Для обеспечения НИВЛ используются различные интерфейсы – носовая или рото-носовая маска, шлем, мундштук. В отличие от инвазивного метода, человек продолжает дышать самостоятельно, но получает аппаратную поддержку на вдохе.
Когда применяется неинвазивная вентиляция легких?
Ключом к успешному использованию неинвазивной вентиляции легких является признание ее возможностей и ограничений, а также тщательный отбор пациентов (уточнение диагноза и оценка состояния больного). Показаниями для НИВЛ являются следующие критерии:
Неинвазивная вентиляция легких
Неинвазивная вентиляция легких (НПВЛ) является одним из методов лечения бокового амиотрофического синдрома (БАС) или болезни двигательного нейрона. Искусственная вентиляция легких позволяет поддерживать дыхание с помощью специального устройства. В сравнении с инвазивным методом неинвазивная вентиляция легких имеет ряд преимуществ.
Синдром БАС неизлечим, однако существует множество методов, направленных на улучшение состояния больного. В клинике неврологии Юсуповской больницы высококвалифицированные специалисты оказывают помощь пациентам с БАС. Врачами-неврологами используются новейшие разработки, которые успешно используются в мировой практике лечения болезни двигательного нейрона.
Инвазивная и неинвазивная вентиляция легких
Для поддержки дыхания пациентов с различными заболеваниями применяется вентиляция легких, которая может проводиться инвазивным и неинвазивным способом. Традиционная инвазивная вентиляция осуществляется с помощью трахеостомы, через которую в трахеи вводится пластиковая трубка для подключения шлангов аппарата.
Отличием неинвазивной вентиляции легких является использование специальной маски, обеспечивающей поступление воздуха в дыхательные пути. НПВЛ позволяет больному нормально питаться, разговаривать и выполнять другие физиологические функции. Кроме этого, при использовании данного метода отсутствуют риски, связанные с повреждением трахеи и поражением инфекцией дыхательных путей.
Неинвазивная искусственная вентиляция легких проводится с использованием мобильного вентиляционного аппарата. Принцип работы устройства заключается в поступлении воздуха, его последующей фильтрации и подаче через максу.
Неинвазивная вентиляция легких при БАС применяется для решения нескольких задач:
При появлении признаков дыхательной недостаточности важно сразу обратиться к специалисту. Врачи-неврологи Юсуповской больницы круглосуточно принимают пациентов, находящихся в тяжелом состоянии. В данном случае больному может потребоваться непрерывная НПВЛ. Для купирования неприятных симптомов БАС, вентиляция легких проводится только в те моменты, когда беспокоит одышка, усталость и нарушения сна.
НПВЛ: показания
Инвазивная и неинвазивная вентиляция легких имеет определенные показания. Показанием к НПВЛ является снижение в крови содержания кислорода в состоянии покоя. Данное состояние сопровождается у больных БАС слабостью мышц, одышкой, повышенной дневной сонливостью, головными болями утром.
Основными показаниями для применения неинвазивной вентиляции легких при болезни двигательного нейрона являются:
НПВЛ противопоказана при БАС больным, находящимся в состоянии комы. Проведение неинвазивной вентиляции легких может быть осложнено скоплением в дыхательных путях мокроты. К числу основных противопоказаний для данной процедуры относятся: опухоли головы и шеи, высокая вероятность остановки дыхания и травмы головы.
При обращении пациентов в Юсуповскую больницу с признаками нарушения дыхательной функции проводится комплексная диагностика, позволяющая выявить причины патологии и определить состояние больного. При обследовании пациентов с БАС используется высокоточное оборудование.
Неинвазивная вентиляция легких на дому
Неинвазивный вентилятор является незаменимым прибором для пациентов с БАС, он формирует необходимый для нормальной жизнедеятельности объем воздуха и поддет его в специальную маску. Приборы для неинвазивной вентиляции легких имеют множество параметров, регулируемых в зависимости от целей использования и состояния пациенты.
Неинвазивная вентиляция легких на дому возможна за счет использования специальных аппаратов, важными критериями при выборе которых являются: безотказность аппарата, чувствительность к вдоху и выдоху, функционирование в объемном режиме.
Возможность проведения неинвазивной вентиляции легких в домашних условиях определяется лечащим врачом. Однако в Юсуповской больнице созданы комфортные условия для стационарного лечения пациентов с БАС. За лежачими больными ухаживают профессиональные медицинские сестры и сиделки, кроме этого, родственники пациента имеют возможность навещать его в удобное время.
Если Вам или близкому человеку необходима помощь врача-невролога в лечении БАС или болезни двигательного нейрона, обратитесь в Юсуповскую больницу.
Что значит неинвазивная ивл
Неинвазивная вентиляция легких при COVID-19
Во время пандемии COVID-19 у примерно 5–6% пациентов отмечается тяжелая гипоксемия с необходимостью интенсивной терапии, а некоторым из этих пациентов требуется инвазивная или неинвазивная вентиляция легких. Причиной гипоксемической дыхательной недостаточности является или тяжелая пневмония, или развившееся вследствие этой пневмонии состояние, сходное с ОРДС. Тяжелая пневмония характеризуется лихорадкой или подозрением на инфекцию дыхательных путей и частотой дыхания более 30 в минуту, тяжелым диспноэ или сатурацией (SpO2) менее 90% при дыхании атмосферным воздухом. Диагноз ОРДС ставится на основании действующих в текущий момент клинических руководств или рекомендации с соответствующей градацией по степени тяжести: ОРДС легкой, умеренной и тяжелой степени в зависимости от отношения парциального давления кислорода в артериальной крови к фракции кислорода вдыхаемого воздуха. В данной статье мы рассмотрим возможности и ограничения неинвазивной вентиляции легких (НИВЛ) при острой дыхательной недостаточности.
Причиной тяжелой дыхательной недостаточности при ОРДС традиционно принято считать нарушение вентиляционно-перфузионных отношений или внутрилегочный шунт. Более новые данные в отношении ОРДС, вызванного COVID-19, говорят о том, что патофизиологические изменения, лежащие в основе ОРДС, могут быть весьма разнообразными. В частности, у этих пациентов может наблюдаться не классический ОРДС, а так называемый атипичный ОРДС. Атипичный ОРДС характеризуется нарушением механизмов перфузии и снижением гипоксической вазоконстрикции на фоне сохраненной легочной механики.
У пациентов с COVID-19 динамика развития заболевания от возникновения первых респираторных симптомов до ОРДС и до интубации может быть очень быстрой и занимать всего несколько дней, поэтому может потребоваться принять быстрое решение в отношении проведения вентиляции легких. При наличии у пациента гипоксемии или дыхательной недостаточности первоначально на первый план выходят такие возможности терапии, как подача кислорода через носовые канюли, или маску Вентури и высокопоточная назальная оксигенотерапия. При ухудшении газообмена и повышении кислородозависимости в динамике следует рассмотреть наличие показаний для CPAP-терапии или ИВЛ. Наряду с определением показаний следует определить не только форму ИВЛ (будь то инвазивная или неинвазивная вентиляция легких), но и момент времени перевода на ИВЛ.
НИВЛ может способствовать благоприятному исходу при ее применении у пациентов с классическим ОРДС только в том случае, если с ее помощью удается обеспечить протективную вентиляцию легких с соответствующим высоким уровнем PEEP. У пациентов с гипоксемической дыхательной недостаточностью и недостаточной эффективностью применения чистого кислорода или же при легкой форме ОРДС, а также при гиперкапнической дыхательной недостаточности (например, при сопутствующем заболевании сердца, ХОБЛ, гипервентиляции, вызванной ожирением, нейромышечном заболевании) следует предпринять попытку лечения с применением НИВЛ или же с применением CPAP-терапии на первом этапе и затем переходом на НИВЛ. При этом порог интубации должен быть низким, и при ухудшении состояния (повышение кислородозависимости, резко или постоянно снижающийся показатель сатурации артериальной крови и/или частоты дыхания и усиление работы дыхания), следует незамедлительно выполнить интубацию и начать механическую ИВЛ. Таким образом, НИВЛ может применяться у отдельных пациентов на ранних этапах и с легкой формой острой гипоксемической дыхательной недостаточности. В то же время накапливается все больше данных, что у пациентов, у которых не наступило улучшение на раннем этапе, НИВЛ лишь откладывает проведение интубации, а не помогает ее избежать.
Как НИВЛ, так и высокопоточная назальная оксигенотерапия, которая проводится с интервалами (в зависимости от применяемых настроек и при увеличении показателей потока) сопровождается повышенным образованием аэрозоля, что в случае COVID-19 приводит к потенциальному риску контаминации вирусом. Поэтому обеспечению защиты персонала от инфекции следует уделить особое внимание. По этой же причине следует своевременно определять неэффективность неинвазивной ИВЛ, а затем правильно готовить и выполнять интубацию пациента. Это позволяет избежать экстренной интубации, которая не только сопряжена с менее благоприятным исходом для пациента, но и вследствие увеличения времени реакции и недостаточных мер предосторожности ведет к повышенному опасности для бригады за счет увеличения вирусной нагрузки. Ввиду тех же причин, при проведении инвазивной ИВЛ утечки воздуха следует свести к минимуму. Следует применять рото-носовые и полнолицевые кислородные маски, а также шлемы для кислородотерапии и отдавать предпочтение аппаратам с реверсивным контуром. При применении аппаратов ИВЛ с нереверсивным контуром между маской и клапаном сброса (или клапаном выдоха) следует установить вирусный фильтр.
Что значит неинвазивная ивл
Пациент А., 49-ти лет, поступил в ФГБУ «НМИЦ Кардиологии» МЗ РФ Центр COVID-19 с жалобами на кашель с трудноотделяемой мокротой, одышку, нехватку воздуха, боль в груди, головную боль и повышение температуры до 39,4 о С, SpO2 93-94% на атмосферном воздухе. У пациента был положительный назофаренгеальный мазок на SARS-CoV-2.
В течение нескольких дней у пациента нарастала симптоматика дыхательной недостаточности, по данным компьютерной томографии увеличился процент поражения легких до 90% (КТ-4).
Пациент находился на антибактериальной терапии, антикоагулянтной терапии, специфической терапии: гидроксихлорохином, азитромицином, лопинавир-ритонавиром. В последующем, в связи с развитием цитокинового «шторма» больному вводился тоцилизумаб.
Пациент пробыл в блоке интенсивной терапии 6 дней и в дальнейшем учитывая стабилизацию клинического состояния – отсутствие необходимости в проведении респираторной поддержки с применением СРАР – терапии, пациент был переведен в отделение.
При контрольном КТ исследовании: выраженная положительная динамика в виде частичного разрешения вирусной пневмонии, новых участков инфильтрации в паренхиме легких не определяется. Средне-тяжелая степень, процент поражения легочной ткани – 50-60% (КТ2).
Учитывая стабилизацию состояния, отсутствие признаков дыхательной недостаточности и хорошее самочувствие, пациент был выписан из стационара.
Во время проведения СРАР – терапии врачами и медицинским персоналом применялись следующие защитные средства: респиратор FFP3, очки, щиток, костюм индивидуальной защиты влагонепроницаемый, перчатки (2-3 пары). За время использования пациентом СРАР – терапии и в течение 14 дней после ни один сотрудник не заболел, положительных назофаренгиальных мазков на SARS-CoV-2 так же зафиксировано не было.
После выписки пациент выразил благородность всему коллективу ФГБУ «НМИЦ кардиологии».
Полностью клинический пример планируется к публикации в журнале «Анестезиология и реаниматология», ссылка на номер будет размещена на сайте.
Случай предоставлен Литвиным Александром Юрьевичем и Елфимовой Евгенией Михайловной.
Что значит неинвазивная ивл
ВДП — верхние дыхательные пути
ВПО — высокопоточная (высокоскоростная) оксигенотерапия
ДН — дыхательная недостаточность
ДО — дыхательный объем
ЗСН — застойная сердечная недостаточность
ИВЛ — искусственная вентиляция легких
НИВЛ — неинвазивная вентиляция легких
НП — нозокомиальная пневмония
ОДН — острая дыхательная недостаточность
ОРДС — острый респираторный дистресс-синдром
ОРИТ — отделение реанимации и интенсивной терапии
ОСН — острая сердечная недостаточность
РП — респираторная поддержка
ХОБЛ — хроническая обструктивная болезнь легких
ЧД — частота дыхания
CPAP (continuous positive airway pressure) — непрерывное положительное давление в дыхательных путях
EPAP (expiratory positive airway pressure) — давление в дыхательных путях на выдохе
FiO2 — фракция кислорода во вдыхаемой газовойсмеси
IPAP (inspiratory positive airway pressure) — инспираторное давление
PaO2 — парциальное давление кислорода в артериальной крови
PaO2/FiO2 — индекс оксигенации
PaCO2 — парциальное давление углекислого газа в артериальной крови
PEEP (positive end-expiratory pressure) — положительное давление конца выдоха (положительное конечное экспираторное давление)
PS (pressure support) — величина поддержки инспираторного давления
PSV (pressure support ventilation) — вентиляция с поддержкой инспираторного давления
SрO2 — насыщение гемоглобина кислородом (по пульсоксиметру)
Термины и определения
Дыхательная недостаточность — состояние организма, при котором не обеспечивается поддержание нормального газового состава артериальной крови, либо оно достигается за счет повышенной работы внешнего дыхания, приводящей к снижению функциональных возможностей организма, либо поддерживается искусственным путем.
Острая дыхательная недостаточность — это неспособность системы дыхания обеспечить поступление кислорода и выведение углекислого газа, необходимые для поддержания нормального функционирования организма.
1. Краткая информация
1.1. Определение
Неинвазивная вентиляция легких (НИВЛ) является вариантом респираторной поддержки без эндотрахеального доступа (через носовые или лицевые маски, шлемы) с использованием всех известных вспомогательных режимов вентиляции. В ряде клинических ситуаций НИВЛ имеет неоспоримые преимущества перед традиционной искусственной вентиляцией легких (ИВЛ), так как приводит к снижению частоты нозокомиальных инфекций, осложнений и летальности [1—5].
1.2. Эпидемиология
В современной реаниматологии и интенсивной терапии одной из наиболее актуальных проблем является тяжелая острая дыхательная недостаточность (ОДН), требующая протезирования функции внешнего дыхания. По разным оценкам, в США регистрируется до 137 случаев тяжелой ОДН на 100 000 населения, 31-дневная летальность составляет 31,4% [1]. В странах Европы распространенность тяжелой ОДН составляет от 77,6 до 88,6 случая на 100 000 населения в год, для острого респираторного дистресс-синдрома (ОРДС) эти цифры колеблются в пределах 12—28 случаев на 100 000 населения в год. В России, по разным данным, в год в среднем регистрируется 15 000 случаев ОРДС, с более частым развитием тяжелой ОДН в отделении реанимации в зависимости от характера заболеваний, повреждений и травм (в среднем от 18 до 56% от всех больных в ОР). Частота применения НИВЛ в России составляет не более 1% [5].
В настоящее время искусственная вентиляция легких (ИВЛ) остается основным видом помощи в отделениях анестезиологии-реанимации [2]. Имеются данные, что 33% пациентов, поступивших в палату интенсивной терапии, требуется ИВЛ по крайней мере на 12 ч. Показания к ИВЛ: ОДН (69% случаев), кома (16%), дыхательная недостаточность при хронических заболеваниях легких (13%), нейромышечные заболевания (2%) [2, 3]. Продолжительность ИВЛ в среднем составляет 5 дней, однако у 1% пациентов ИВЛ применяется более 28 дней. Сводные данные о частоте применения НВЛ отсутствуют.
1.3. Кодирование по МКБ-10
J12 — Вирусная пневмония, не классифицированная в других рубриках.
J13 — Пневмония, вызванная Streptococcus pneumoniae.
J17 — Пневмония при болезнях, классифицированных в других рубриках.
J18 — Пневмония без уточнения возбудителя.
J46 — Астматический статус [status asthmaticus].
J80 — Синдром респираторного расстройства [дистресса] у взрослого.
J81 — Легочный отек.
J96 — Дыхательная недостаточность, не классифицированная в других рубриках.
1.4. Кодирование по номенклатуре медицинских услуг
Кодирование по номенклатуре медицинских услуг согласно приказу Министерства здравоохранения РФ от 13 октября 2017 г. № 804н «Об утверждении номенклатуры медицинских услуг» (с изменениями и дополнениями):
1.5. Основные преимущества и недостатки неинвазивной респираторной поддержки
К неинвазивной респираторной поддержке относят собственно НИВЛ (через маски или шлемы), а также высокопоточную оксигенацию, осуществляемую через специальные назальные канюли.
НИВЛ (по сравнению с инвазивной ИВЛ, осуществляемой через эндотрахеальную трубку, и стандартной оксигенотерапией) имеет ряд преимуществ и недостатков.
Преимущества НИВЛ перед инвазивной ИВЛ следующие:
1) отсутствие осложнений от интубации трахеи и длительного нахождения эндотрахеальной трубки;
2) уменьшение частоты нозокомиальных инфекций;
3) уменьшение потребности в медикаментозной седации;
4) неинвазивная природа процедуры и ее простота;
5) возможность более ранней мобилизации пациента;
6) экономическая эффективность.
Преимущества НИВЛ перед стандартной оксигенотерапией через лицевую маску или носовые канюли следующие:
1) обеспечение положительного конечно-экспираторного давления (PEEP) или постоянного положительного давления в дыхательных путях (CPAP);
2) обеспечение инспираторного давления (Pinsp или инспираторное положительное давление в дыхательных путях — IPAP) с регулировкой триггера вдоха и выдоха;
3) адекватное увлажнение и обогрев дыхательной смеси.
1) необходимость активного сотрудничества пациента с медицинским персоналом;
2) невозможность применять высокий уровень инспираторного и экспираторного давления;
3) отсутствие прямого доступа к дыхательным путям для санации;
4) высокий риск аэрофагии;
5) высокий риск аспирации содержимого полости рта и желудка;
6) мацерация и некрозы кожи в местах прилеганиямаски;
7) гипоксемия при смещении маски;
9) высыхание рото- и носоглотки;
10) носовое кровотечение.
Рекомендация 1. Исходя из патофизиологии ДН и технологии НИВЛ, ее преимущества реализуются при следующих ситуациях:
1. Экспираторное закрытие мелких дыхательных путей, хроническая обструктивная болезнь легких (ХОБЛ) — пациенту необходима кислородотерапия в сочетании с умеренным уровнем РЕЕР/СРАР для облегчения экспираторного потока и умеренным уровнем инспираторного давления для разгрузки дыхательных мышц (уровень достоверности доказательств — 1, уровень убедительности рекомендаций — А).
2. Гипоксемическая (паренхиматозная) ОДН с невысоким потенциалом рекрутабельности альвеол (пневмония, ушиб легких, тромбоэмболия легочной артерии (ТЭЛА) с развитием инфарктной пневмонии, состояние после резекции легкого) — пациенту необходима кислородотерапия в сочетании с низким уровнем РЕЕР/СРАР и низким уровнем инспираторного давления (IPAP, PS) для разгрузки дыхательных мышц (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В).
3. Гипоксемическая ОДН с невысоким потенциалом рекрутабельности альвеол в сочетании с иммуносупрессией (пневмоцистная пневмония, ОДН в онкогематологии, ОДН после трансплантации солидных органов) — пациенту необходима кислородотерапия в сочетании с умеренным уровнем РЕЕР/СРАР и умеренным уровнем инспираторного давления для разгрузки дыхательных мышц (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В).
4. Острая левожелудочковая недостаточность и кардиогенный отек легких — пациенту необходима кислородотерапия в сочетании с умеренным уровнем РЕЕР/СРАР для уменьшения ударной работы левого желудочка и умеренным инспираторным давлением для разгрузки дыхательных мышц (уровень достоверности доказательств — 1, уровень убедительности рекомендаций — А).
5. Профилактика послеоперационных ателектазов у пациентов групп высокого риска (ожирение, иммуносупрессия, ХОБЛ с гиперкапнией, торакальные хирургические вмешательства) — потребность пациента в умеренном уровне РЕЕР/СРАР для профилактики ателектазов (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В).
НИВЛ обеспечивает адекватный заданный уровень кислорода в сочетании с умеренным уровнем РЕЕР/CPAP и инспираторного давления, что обусловливает преимущества перед стандартной оксигенотерапией через лицевую маску или носовые канюли у пациентов с ограничением экспираторного потока вследствие экспираторного закрытия мелких дыхательных путей (ХОБЛ), так как облегчает экспираторный поток, уменьшая работу дыхания и снижая собственный уровень (ауто)РЕЕР, а также разгружая дыхательные мышцы [6].
НИВЛ обеспечивает адекватный заданный уровень кислорода в сочетании с умеренным уровнем РЕЕР/CPAP и инспираторного давления, что обусловливает преимущества перед стандартной оксигенотерапией через лицевую маску или носовые канюли у пациентов с гипоксемической (паренхиматозной) ОДН при невысокой рекрутабельности альвеол (пневмония, ателектазы), когда нужен умеренный уровень РЕЕР и инспираторного давления для предотвращения коллапса альвеол и ателектазирования.
НИВЛ обеспечивает умеренный уровень РЕЕР/CPAP, который снижает пред- и постнагрузку левого желудочка, уменьшая ударную работу левого желудочка, что имеет преимущества перед стандартной оксигенотерапией через лицевую маску или носовые канюли у пациентов с острой левожелудочковой недостаточностью и/или отеком легких.
Рекомендация 2. Условиями применимости НИВЛ являются сохранность сознания, возможности сотрудничать с персоналом, отсутствие клаустрофобии (при применении шлемов) и функционирование всего механизма откашливания мокроты (уровень достоверности доказательств — 3, уровень убедительности рекомендаций — C).
Комментарии. При нарушении сознания при НИВЛ высока вероятность аспирации желудочного содержимого и раздувания желудка. При нарушении откашливания мокроты (например, при парезе голосовых связок) и бронхорее необходима частая санация трахеи, что невозможно при применении НИВЛ [6]. Для реализации преимуществ НИВЛ и улучшения исходов необходимо длительное постоянное ношение маски (шлема), что в условиях нарушения сознания (например, при делирии) и отказе сотрудничать с персоналом невозможно [7].
Перед началом НИВЛ в предварительной беседе пациенту следует разъяснить принцип действия аппарата ИВЛ, особенности масочной вентиляции, необходимость сотрудничества пациента с персоналом, важность понимания им смысла и целей проводимой процедуры.
Кроме того, на эффективность НИВЛ влияют структурные и функциональные особенности верхних дыхательных путей (ВДП).
Рекомендация 3. Применение НИВЛ наиболее эффективно для предотвращения интубации трахеи при компенсированной ОДН у пациентов групп риска: обострение ХОБЛ, внебольничная пневмония, пневмония при иммуносупрессии, ЗСН, кардиогенный отек легких.
Получены доказательства уровня, А о снижении летальности и количества осложнений при раннем использовании НИВЛ у этих пациентов. Проведение НИВЛ возможно не только в условиях отделения интенсивной терапии, но и в палатах общего профиля и на дому.
2. Основные показания и противопоказания к проведению неинвазивной респираторной поддержки
2.1. Показания к применению НИВЛ
Рекомендация 4. Применение НИВЛ приводит к улучшению газообмена, уменьшению работы дыхания и улучшению прогноза по сравнению с кислородотерапией (через лицевую маску или канюли) при следующих состояниях:
— обострение ХОБЛ (при развитии умеренного респираторного ацидоза (7,35>рН>7,25) и компенсированной ОДН) (уровень достоверности доказательств — 1, уровень убедительности рекомендаций — A);
— внебольничная пневмония у пациентов с ХОБЛ (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В);
— кардиогенный отек легких (уровень достоверности доказательств — 1, уровень убедительности рекомендаций — A);
— гипоксемическая ОДН у иммунокомпрометированных пациентов (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В);
— предотвращение постэкстубационной ОДН у пациентов с гиперкапнией на фоне ХОБЛ или ожирения (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В);
— синдром гиповентиляции при ожирении (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В).
Рекомендация 5. Критерием для выбора НИВЛ при обострении ХОБЛ является наличие респираторного ацидоза, а не уровень гиперкапнии: в отсутствие респираторного ацидоза НИВЛ не имеет преимуществ перед стандартной оксигенотерапией, при рН 7,25—7,35 НИВЛ следует использовать для предотвращения интубации трахеи, а при рН менее 7,20 — как альтернативу ИВЛ (уровень достоверности доказательств — 1, уровень убедительности рекомендаций — A).
Комментарии. Рандомизированные контролируемые исследования [8—11] не показали снижения летальности и частоты интубации трахеи при использовании НИВЛ по сравнению со стандартной оксигенотерапией при обострении ХОБЛ в отсутствие респираторного ацидоза, однако в этих исследованиях отмечено снижение степени диспноэ.
Наиболее клинически значимые результаты получены у пациентов с обострением ХОБЛ и рН 7,25—7,35 — увеличение рН и/или снижение частоты дыхания, уменьшение степени диспноэ [12, 13], которое возникает у респондеров через 1—4 ч после начала НИВЛ, а также уменьшение инфекционных и неинфекционных осложнений [14, 15].
В результатах рандомизированных исследований сравнительной оценки НИВЛ с инвазивной ИВЛ у пациентов с обострением ХОБЛ и средним рН 7,20 отмечено, что, несмотря на более быстрое увеличение рН и снижение парциального давления углекислого газа в артериальной крови (PaCO2) в группе инвазивной ИВЛ, у респондеров снижались длительность ИВЛ и продолжительность лечения в ОРИТ, частота инфекционных осложнений, а также частота повторных госпитализаций в течение последующего года без снижения летальности [16—18].
Рекомендация 6. При тяжелом обострении бронхиальной астмы НИВЛ малоприменима, достаточно медикаментозной терапии в сочетании с оксигенотерапией, при прогрессировании ОДН (жизнеугрожающая астма) — только инвазивная ИВЛ, НИВЛ противопоказана (уровень достоверности доказательств — 3, уровень убедительности рекомендаций — В).
Комментарии. При жизнеугрожающем обострениибронхиальной астмы («near-fatal asthma»), для которого характерны возникновение зон «немого» легкого при аускультации, пиковый поток на выдохе менее 33% от максимума [19], бронхообструкция настолько сильна, что приводит к запредельной нагрузке на дыхательные мышцы; такой уровень нагрузки делает невозможным использование не только НИВЛ, но и инвазивной ИВЛ в полностью вспомогательных режимах. Ввиду невысокой частоты развития тяжелой степени обострения бронхиальной астмы, при котором необходима госпитализация в ОРИТ, контролируемых исследований не проводили. При легкой и средней степени бронхообструкции (пиковый поток на выдохе более 50% от максимального для пациента) более выражен клинический эффект от применения бронходилататоров. Метаанализ неконтролируемых исследований не показал улучшения состояния у пациентов от применения НИВЛ по сравнению со стандартной терапией [20]. Тем не менее в ретроспективном исследовании выявлена группа пациентов, у которых отмечен положительный клинико-физиологический эффект от применения НИВЛ [21]. В этом исследовании описаны три типа обострения бронхиальной астмы: при тяжелом обострении астмы все пациенты интубированы; при легком обострении большинству пациентов было достаточно медикаментозной терапии; и только некоторые пациенты с компенсированной ДН, плохо отвечавшие на медикаментозную терапию, отметили клиническое улучшение в результате применения НИВЛ.
Рекомендация 7. При кардиогенном отеке легких следует применять НИВЛ, так как это приводит к ускорению разрешения отека легких, улучшению газообмена, уменьшению работы дыхания и, возможно, снижению летальности; не установлено преимущества использования какого-либо режима НИВЛ перед CPAP (уровень достоверности доказательств — 1, уровень убедительности рекомендаций — A).
Комментарии. НИВЛ при кардиогенном отеке легких уменьшает постнагрузку и преднагрузку левого желудочка, снижая индекс ударной работы левого желудочка, уменьшает работу дыхания пациента и улучшает газообмен [22—24]. С 80-х годов ХХ века опубликовано более 30 исследований об использовании НИВЛ при кардиогенном отеке легких, большая часть которых были одноцентровыми с малой выборкой пациентов. Продемонстрировано улучшение оксигенации, снижение степени гиперкапнии и более быстрое разрешение отека легких при применении НИВЛ по сравнению с оксигенотерапией [25]. В нескольких исследованиях отмечено снижение частоты интубации трахеи при применении НИВЛ по сравнению с оксигенотерапией при кардиогенном отеке легких. Несколько мультицентровых рандомизированных исследований подтвердили эти данные. Самое крупное мультицентровое рандомизированное контролируемое исследование (n=1069), проведенное в 26 отделениях экстренной помощи, продемонстрировало улучшение клинико-физиологических параметров в группах CPAP и CPAP + Pressure support (PS) по сравнению с оксигенотерапией, но отсутствие снижения частоты интубации трахеи [26]. В рандомизированном исследовании при сравнении стандартной оксигенотерапии, CPAP и CPAP + PS отмечено улучшение клинико-физиологических параметров, снижение частоты интубации трахеи и снижение 15-суточной летальности при применении НИВЛ в любом режиме по сравнению с оксигенотерапией [27]. В мультицентровом рандомизированном исследовании показано ускорение купирования отека легких при применении CPAP + PS по сравнению с CPAP, но без различий по исходам [28]. Исследователи на основании метаанализов и систематических обзоров всех проведенных исследований [29—37] пришли к следующим выводам: 1. НИВЛ снижает частоту интубации трахеи. 2. НИВЛ уменьшает работу дыхания и ускоряет купирование отека легких. 3. НИВЛ и СРАР вызывают сходные физиологические эффекты, однако НИВЛ с заданным уровнем IPAP имеет преимущества у пациентов с гиперкапнией. 4. НИВЛ не увеличивает частоту развития инфаркта миокарда.
Рекомендация 8. При гипоксемической (паренхиматозной) ОДН НИВЛ показана пациентам в случаях сочетания низкой рекрутабельности альвеол с незначительно сниженной или нормальной податливостью легких и грудной стенки (первичная патология паренхимы легких) как терапия первой линии, особенно у пациентов с иммуносупрессией; этим пациентам обычно требуются невысокие уровни РЕЕР и инспираторного давления (Pinsp, IPAP или PS) в сочетании с увеличением инспираторной фракции кислорода. Возможно, высокопоточная оксигенация имеет преимущество у этой категории пациентов. К таким состояниям относят: внебольничную пневмонию при исходном индексе PaO2/FiO2 более 150 мм рт.ст. (уровень достоверности доказательств — 1, уровень убедительности рекомендаций — A), ушиб легких без нарушения каркасности грудной клетки (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В), синдром гиповентиляции при ожирении, ОДН после резекции легкого (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — А).
Комментарии. В когортных исследованиях и метаанализе исследований продемонстрирован положительный эффект от применения НИВЛ как терапии первой линии при гипоксемии у пациентов с внебольничной пневмонией и индексом оксигенации (PaO2/FiO2) более 150 мм рт.ст., однако неудача такой терапии с задержкой интубации трахеи и начала ИВЛ приводила к увеличению летальности, положительный эффект был особенно выражен при иммуносупрессии и у пациентов с хронической сердечной недостаточностью [38—43].
В мультицентровом рандомизированном исследовании, включившем пациентов с первичной патологией легких (внебольничная пневмония более чем у 60% пациентов), продемонстрировано снижение частоты интубации трахеи и летальности при применении высокопоточной оксигенации по сравнению со стандартной оксигенотерапией и НИВЛ [44].
В 3 рандомизированных исследованиях получены данные о снижении частоты интубации трахеи, уменьшении частоты нозокомиальной пневмонии (НП) при применении НИВЛ по сравнению со стандартной оксигенотерапией при ушибе легких [45—47].
В рандомизированном контролируемом исследовании при сравнении НИВЛ и стандартной оксигенотерапии у пациентов с гипоксемией после резекции легкого получено снижение частоты интубации трахеи и летальности в группе НИВЛ [48].
Рекомендация 9. Возможно применение НИВЛ при ОРДС легкой и средней степени как терапия первой линии (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — А); задержка интубации трахеи при неэффективности НИВЛ при ОРДС приводит к увеличению летальности.
Комментарии. Метод позволяет избежать интубации трахеи у некоторых пациентов с легким и умеренным ОРДС, успешное применение НИВЛ при ОРДС приводит к резкому снижению частоты НП и летальности [49—51]. Оценку клинической неэффективности НИВЛ при ОРДС осуществляют через 1 ч: при снижении показателя PaO2/FiO2 менее 175 мм рт.ст., десинхронизации с респиратором, нарастании частоты дыхания (ЧД) выше 25—30 дыхательных движений в минуту, увеличении PaCO2, возникновении ацидоза показаны интубация трахеи, инвазивная ИВЛ [49].
Рекомендация 10. НИВЛ и высокопоточная оксигенация у пациентов с гипоксемической (паренхиматозной) ОДН при иммуносупрессии (онкогематология, пневмоцистная пневмония, состояние после трансплантации органов) снижает частоту интубации трахеи, НП и летальность (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — A).
Комментарии. По данным 5-летнего мультицентрового обсервационного исследования применения НИВЛ в онкогематологии, получено снижение летальности в случае применения НИВЛ как терапии первой линии по сравнению с ингаляцией кислорода [52]. При развитии гипоксемической ОДН у пациентов онкогематологии применение НИВЛ через шлем в режиме СРАР в профильном отделении привело к снижению госпитализаций в ОРИТ, снижению частоты интубации трахеи и летальности [53].
В мультицентровом рандомизированном исследовании при сравнении оксигенотерапии с НИВЛ у пациентов онкогематологии не получено значимых различий по частоте интубации трахеи и летальности, однако в этом исследовании у 40% вместо стандартной оксигенотерапии использована высокопоточная оксигенация [54]. Post hoc-анализ этого исследования продемонстрировал преимущества высокопоточной оксигенации перед стандартной оксигенотерапией и, возможно, НИВЛ по снижению частоты интубации трахеи и летальности [55].
В исследовании типа случай—контроль у пациентов с пневмоцистной пневмонией вследствие синдрома приобретенного иммунодефицита (ВИЧ-инфекции) применение НИВЛ по сравнению с инвазивной ИВЛ привело к снижению частоты интубации трахеи и летальности [56].
Применение НИВЛ по сравнению с оксигенотерапией у пациентов после пересадки солидных органов (печени, почки, легких) привело к снижению частоты интубации трахеи, сепсиса и летальности в ОРИТ [57].
Рекомендация 11. НИВЛ показана для профилактики развития постэкстубационной ОДН после оперативных вмешательств у пациентов группы риска (ХОБЛ с гиперкапнией, ожирение с гиперкапнией, ЗСН); применение НИВЛ у пациентов этих групп при уже развившейся постэкстубационной ОДН неэффективно и может приводить к задержке интубации трахеи и ухудшению прогноза (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — А).
Комментарии. Мультицентровое рандомизированное исследование сравнительной оценки эффективности НИВЛ и стандартной оксигенотерапии при развившейся гипоксемической послеоперационной ОДН через 48 ч и более после плановой экстубации трахеи продемонстрировало отсрочку интубации трахеи и увеличение летальности в группе НИВЛ [58]. В другом рандомизированном исследовании сравнительной оценки эффективности НИВЛ и стандартной оксигенотерапии при развившейся гипоксемической послеоперационной ОДН у пациентов с сопутствующей хронической сердечной недостаточностью и ХОБЛ не получено различий по частоте реинтубации и летальности [59]. В нескольких рандомизированных исследованиях продемонстрировано снижение частоты реинтубации трахеи, летальности в ОРИТ и 90-дневной летальности при профилактике развития постэкстубационной ОДН у пациентов высокого риска (ХОБЛ с гиперкапнией, ЗСН, ожирение с гиперкапнией) [60—63].
2.2. Противопоказания к применению НИВЛ
Рекомендация 12. Противопоказания к применению НИВЛ (уровень достоверности доказательств — 3, уровень убедительности рекомендаций — В).
Неинвазивная респираторная поддержка не должна применяться в следующих случаях:
1) отсутствие самостоятельного дыхания (апноэ);
2) нестабильная гемодинамика (гипотензия, ишемия или инфаркт миокарда, жизнеугрожающая аритмия, неконтролируемая артериальная гипертензия);
3) невозможность обеспечить защиту дыхательных путей (нарушение кашля и глотания) и высокий риск аспирации;
4) избыточная бронхиальная секреция;
5) признаки нарушения сознания (возбуждение или угнетение сознания), неспособность пациента к сотрудничеству с медицинским персоналом;
6) лицевая травма, ожоги, анатомические нарушения, препятствующие установке маски;
7) выраженное ожирение;
8) неспособность пациента убрать маску с лица в случае рвоты;
9) активное кровотечение из желудочно-кишечного тракта;
11) дискомфорт от маски;
12) операции на ВДП.
3. Методика проведения неинвазивной респираторной поддержки
Рекомендация 13. Рекомендуется при проведении НИВЛ использовать специализированные аппараты для НИВЛ или аппараты ИВЛ в режиме НИВЛ, в которых компенсируются утечки и применяются специализированные лицевые/носовые маски или шлемы (уровень достоверности доказательств — 4, уровень убедительности рекомендаций — С).
Комментарии. Для проведения НИВЛ предпочтительнее использовать специализированные аппараты ИВЛ, приспособленные для компенсации утечек из-под маски, но НИВЛ можно успешно проводить любым из существующих современных вентиляторов, которые могут работать в режиме НИВЛ. Наилучшим образом себя показали системы (вентиляторы), использующие для доставки воздушной смеси нереверсивный контур, так как это значительно уменьшает «мертвое» пространство и облегчает выдох пациента, который осуществляется в окружающую среду, а не обратно в дыхательный контур. Для работы с нереверсивным контуром требования к аппарату ИВЛ еще более ужесточаются, и здесь на первый план выходят аппараты, оснащенные турбокомпрессором с высокой производительностью (порядка 200 л/мин и более) для компенсации очень больших утечек (до 80 л/мин).
Очень важен правильный подбор режима НИВЛ для каждого пациента, а также вида маски (лицевая или носовая) и ее размера, так как пациенты с высоким назальным сопротивлением (в том числе при инфекциях ВДП) могут быть менее чувствительны к назальной вентиляции.
Для неинвазивной респираторной поддержки могут использоваться назальные маски, оральные («загубники») или лицевые (ороназальные) маски, а также шлемы. Выбор типа маски очень важен. При некоторых видах ДН тип маски влияет на результаты применения НИВЛ даже больше, чем режим вентиляции. По сравнению с носовой маской лицевую маску легче подобрать по размеру, и ее использование связано с меньшими утечками воздуха. Однако клаустрофобия, кашель или рвота могут усложнять использование лицевой маски. Носовая маска в отличие от лицевой не нарушает речь и глотание, лучше переносится, имеет меньшее «мертвое» пространство (100 мл) по сравнению с лицевой маской (около 200 мл). Кроме того, при ее использовании снижается риск раздувания желудка, так как при назальной вентиляции губы исполняют роль предохранительного клапана во время повышения давления в дыхательном контуре. Поскольку больные с тяжелым диспноэ, как правило, дышат через рот, на начальном этапе рекомендуется использовать лицевую маску. Назальная же вентиляция может быть методом резерва для тех пациентов, у которых ОДН менее выражена. Возможно использование комбинации лицевой и носовой масок в следующем сочетании: носовая — в дневное время суток, лицевая — ночью.
Маска должна прилегать комфортно и без чрезмерных утечек. Очень важен правильный подбор размера маски. Иногда для фиксации подбородка дополнительно используются специальные ремни. В контур может включаться увлажнитель, но нагреватель следует выключить, так как функция ВДП при неинвазивной вентиляции сохраняется.
Маска, как правило, позволяет поддерживать довольно высокий уровень СРАР — до 15 см вод.ст., но более высокие уровни давления (>18 см вод.ст.) при неинвазивной технике СРАР генерировать трудно из-за утечек из-под маски.
Важную роль играют также тип и свойства триггера, используемого для обеспечения вспомогательной вентиляции, а именно — время задержки аппаратного вдоха. Чем меньше время задержки, тем быстрее обеспечивается поддержка усилия дыхательных мышц на вдохе и тем лучше синхронизация больного и респиратора. Желательно, чтобы «отклик» респиратора на инспираторную попытку больного начинался не позже чем через 0,05—0,1 с, иначе пациенту придется совершать дополнительную работу во время вдоха по преодолению сопротивления контура аппарата.
Имеются данные о лучшей переносимости пациентами, большей эффективности НИВЛ и меньшем количестве осложнений при использовании специальных шлемов для НИВЛ по сравнению с масочной вентиляцией легких [64, 65].
Рекомендация 14. При проведении НИВЛ рекомендуется начинать со стандартной методики (см. Приложение Б) (уровень достоверности доказательств — 3, уровень убедительности рекомендаций — С).
Для неинвазивной респираторной поддержки традиционно использовали режим РЕЕР (CPAP, EPAP) с уровнем давления от 5 до 10—12 см вод.ст. либо его сочетание с поддержкой инспираторного давления (PSV) — (IPAP). В настоящее время режимы НИВЛ практически ничем не отличаются от режимов инвазивной ИВЛ (CPAP, CPAP+PS, вентиляция с управляемым давлением и гарантированным дыхательным объемом (ДО) (Pressure-controlled ventilation volume guaranteed — PCV-VG), пропорциональная вспомогательная вентиляция (Proportional Assist Ventilation — PAV+и Proportional Pressure Support Ventilation — PPS), адаптивная поддерживающая вентиляция (Adaptive Support Ventilation — ASV). В настройках аппарата существует настройка резервного режима вентиляции, а также возможна настройка как инспираторного, так и экспираторного триггеров. Рандомизированные исследования не показали преимуществ какого-либо режима при НИВЛ. У пациентов с сонным апноэ используют НИВЛ в режиме CPAP.
Стандартная методика проведения НИВЛ:
— Установить величину РЕЕР 5 см вод.ст.
— Подобрать уровень поддержки инспираторного давления (PS, IPAP) индивидуально путем ступенчатого увеличения с 5—8 см вод.ст. до достижения ДО, равного 6—8 мл на 1 кг должной массы тела (ДМТ) (расчет ДМТ (кг) осуществляется по следующим формулам: мужчины = 50 + 0,91 × (рост, см – 152,4), женщины = 45,5 + 0,91 × (рост, см – 152,4). Как правило, это достигается при величине PS 10—16 см вод.ст.
— Установить минимальную чувствительность триггера, при которой нет аутотриггирования, — (–)1,5—(–)2,0 см вод.ст. для триггера давления, 2—3 л/мин для триггера потока.
— Установить инспираторную фракцию кислорода во вдыхаемой газовой смеси (FiO2) на минимальном уровне, который обеспечивает насыщение гемоглобина кислородом (SpO2) 88—95%.
— Настроить чувствительность экспираторного триггера для улучшения синхронизации с респиратором (стандартная настройка 25% обычно не подходит для пациентов с активными попытками вдоха и при ХОБЛ, таким пациентам следует установить чувствительность на 40—50%),
— Увеличить РЕЕР до 8—10 см вод.ст. у пациентов с SpO2 менее 88% на фоне FiO2 0,3 при переносимости повышения РЕЕР.
Высокие уровни PEEP/CPAP (>12 см вод.ст.) и/или PS (>20 см вод.ст.), несмотря на временное улучшение оксигенации, приводят к дискомфорту больного и снижению эффективности НИВЛ.
Уменьшение диспноэ, как правило, достигается вскоре после настройки адекватного режима вентиляции, в то время как коррекция гиперкапнии и/или гипоксемии может занимать нескольких часов.
В первые часы вспомогательная неинвазивная вентиляция легких должна проводиться в постоянном режиме. Далее, после постепенного снижения респираторной поддержки, возможен переход на НИВЛ сеансами по 3—6 ч в день вплоть до полной ее отмены.
Рекомендация 15. Рекомендуется в процессе проведения НИВЛ осуществлять мониторинг и оценку эффективности неинвазивной вентиляции легких. При неэффективности масочной вентиляции следует незамедлительно интубировать трахею и начать инвазивную ИВЛ (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В).
Комментарии. В процессе НИВЛ необходимо проводить мониторинг следующих параметров:
— степень утечки из контура;
— синхронизация с вентилятором;
— уровень артериального давления и частота сердечных сокращений;
— участие в дыхании вспомогательных дыхательныхмышц;
Через час от начала НИВЛ следует оценить ЧД, ДО (в литрах), PaO2/FiO2, PaCO2. При нарастании ЧД, увеличении соотношения ЧД/ДО выше 100, снижении PaO2/FiO2 ниже 175 мм рт.ст., нарастании уровня PaCO2 НИВЛ следует признать неэффективной.
В большинстве случаев первые сутки являются решающим периодом в определении успешности НИВЛ. В этот период пациент должен находиться под особо тщательным контролем. При улучшении физиологических показателей в течение суток высока вероятность эффективности НИВЛ.
При наличии критериев неэффективности НИВЛ следует прекратить проведение НИВЛ, интубировать трахею и продолжить ИВЛ через эндотрахеальную трубку. Задержка времени интубации трахеи в этом случае приводит к ухудшению прогноза.
Критерии неэффективности НИВЛ:
1) неспособность больного переносить маску вследствие дискомфорта или боли;
2) неспособность масочной вентиляции улучшить газообмен или уменьшить диспноэ;
3) необходимость эндотрахеальной интубации для санации секрета трахеобронхиального дерева или защиты дыхательных путей;
4) нестабильность гемодинамики;
5) ишемия миокарда или жизнеугрожающие аритмии;
6) угнетение сознания или делирий;
8) увеличение соотношения ЧД/ДО выше 100;
9) PaO2/FiO2 ниже 175 через час от начала НИВЛ;
10) нарастание PaCO2.
4. Неинвазивная высокопоточная оксигенация
Высокопоточная (высокоскоростная) оксигенотерапия (ВПО) является разновидностью кислородотерапии, однако в большинстве исследований ее сравнивают с НИВЛ ввиду некоторой схожести физиологического и клинического эффектов. В отличие от НИВЛ при использовании ВПО невозможно создать управляемое конечное экспираторное давление, контролировать объем вдоха и минутную вентиляцию легких. В то же время ВПО имеет несомненные преимущества перед традиционной оксигенотерапией, более комфортна, лишена многих недостатков НИВЛ.
4.1. Оборудование
ВПО реализуется посредством генератора высокоскоростного потока газа (до 60 л/мин и более). ВПО включает различные системы для эффективного увлажнения и согревания газовой смеси. Принципиальным является наличие возможности пошаговой регуляции скорости потока и температуры, точной установки фракции кислорода. Современные системы ВПО располагают специальными дыхательными контурами из полупроницаемого материала, не допускающего образования конденсата, а также оригинальными носовыми или трахеостомическими канюлями.
4.2. Механизмы клинической эффективности ВПО
В основе клинической эффективности ВПО лежит возможность создания высокой скорости потока газа (до 60 л/мин), что обеспечивает следующее:
— высокая скорость потока газа, равная или превышающая скорость потока при вдохе больного, минимизирует «примешивание» комнатного воздуха и позволяет поддерживать заданную высокую фракцию кислорода [66];
— высокая скорость потока газа соответствует высокой скорости газа при вдохе больных с ОДН, в результате чего уменьшается ЧД, увеличивается ДО, это приводит к уменьшению гиперкапнии, снижению работы дыхания, увеличению оксигенации и снижению степени ДН;
— высокая скорость потока газа улучшает элиминацию углекислого газа и альвеолярную вентиляцию, уменьшая объем анатомического мертвого пространства, что приводит к уменьшению гиперкапнии, снижению работы дыхания, увеличению оксигенации и снижению степени ДН [67];
— высокая скорость потока газа обеспечивает улучшение газообмена за счет генерирования невысокого (1—4 мбар) положительного давления в гортаноглотке и ВДП (СРАР-подобный эффект) [68—70];
— высокая скорость потока газа снижает работу дыхания пациента [71];
— положительные респираторные эффекты высокой скорости потока газа не сопровождаются ухудшением кардиогемодинамики.
4.3. Показания к применению ВПО
Рекомендация 16. В целом показания к началу ВПО соответствуют показаниям к НИВЛ. Преимущества ВПО перед НИВЛ продемонстрированы у пациентов с внебольничной пневмонией (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В), гипоксемической ОДН при иммуносупрессии (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В), при кардиогенном отеке легких (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — С), при обострении ХОБЛ и в профилактике постэкстубационной ОДН (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — В).
Комментарии. В мультицентровом рандомизированном исследовании, включившем пациентов с первичной патологией легких (внебольничная пневмония — более 60% пациентов, госпитальная пневмония) а также иммуносупрессией, продемонстрировано снижение частоты интубации трахеи и летальности при применении ВПО по сравнению со стандартной оксигенотерапией и НИВЛ [44]. В мультицентровом рандомизированном исследовании продемонстрировано снижение частоты интубации трахеи и летальности при применении ВПО не только по сравнению со стандартной оксигенотерапией, но и по сравнению с НИВЛ [55, 72].
У пациентов с кардиогенным отеком легких легкой и средней степени тяжести в рандомизированном исследовании продемонстрировано снижение частоты дыхания при применении ВПО по сравнению со стандартной оксигенотерапией [73].
У пациентов с ХОБЛ, получающих оксигенотерапию на дому, продемонстрировано уменьшение частоты обострений ХОБЛ при 6-часовом ежедневном использовании ВПО [74—76].
В рандомизированном исследовании у пациентов плановой хирургии с низкой степенью риска развития послеоперационной ДН в послеоперационном периоде продемонстрировано снижение частоты интубации трахеи при применении ВПО по сравнению со стандартной оксигенотерапией [77]. У пациентов в плановой кардиохирургии с развившейся после оперативного вмешательства гипоксемией продемонстрирована эквивалентность ВПО иНИВЛ в частоте интубации трахеи и летальности [78—80].
Рекомендация 17. Рекомендуется использовать ВПО при ожидаемой трудной интубации трахеи и в паллиативной медицине (уровень достоверности доказательств — 2, уровень убедительности рекомендаций — С).
Комментарии. В клинических исследованиях продемонстрировано обеспечение адекватной артериальной оксигенации у пациентов с прогнозируемой трудной интубацией трахеи (Mallampati score, 2—4-я степень) в течение 5—6 мин [81, 82].
У пациентов, получающих паллиативную помощь, ВПО позволяет уменьшить степень диспноэ и избежать применения НИВЛ [83].
4.4. Алгоритм применения ВПО
Рекомендация 18. При настройке ВПО следует использовать определенный алгоритм (уровень достоверности доказательств — 4, уровень убедительности рекомендаций — С).
Комментарии. В настоящее время нет однозначного мнения относительно наиболее оптимального алгоритма выбора первичных настроек ВПО и последующей их коррекции у больных с ДН различного генеза.
Основными критериями использования ВПО являются:
— Развитие Д.Н. различного генеза в отсутствие показаний для немедленной интубации и начала ИВЛ.
— Начинать ВПО следует только после достижения температуры газовой смеси не менее 37 °C и постоянно контролировать этот показатель.
— При манифестации паренхиматозной ОДН целесообразно начинать ВПО с фракцией кислорода 0,3—0,4.
— При манифестации паренхиматозной ОДН целесообразно начинать ВПО с невысокой скоростью потока газа — 20—30 л/мин, при необходимости с последующим увеличением скорости потока.
— В отсутствие эффекта целесообразно постепенно увеличивать скорость потока газа, ориентируясь на показатели газообмена и состояние больного.
— В отсутствие эффекта можно увеличивать фракцию кислорода.
— При развитии гиперкапнической ОДН можно начинать ВПО с высокой скоростью потока газа — 50—60 л/мин.
— На этапе прекращения ИВЛ в раннем постэкстубационном периоде можно начинать ВПО с высокой скоростью потока газа — 50—60 л/мин.
— В настоящее время отсутствуют четкие рекомендации по прекращению ВПО. Общие алгоритмы отлучения от ВПО аналогичны основным принципам снижения РП:
— Постепенное снижение скорости потока газа — на5 л/мин каждые 6—8 часов.
— Переход на традиционную оксигенотерапию или спонтанное дыхание при скорости потока газа ≤20 л/мин и FiO2 
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория клинических рекомендаций:
1. Врач анестезиолог-реаниматолог.
2. Студенты медицинских вузов, ординаторы, аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме (табл. 2, 3). 

Порядок обновления клинических рекомендаций
Клинические рекомендации обновляются каждые3 года.
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 919н «Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология» (с изменениями и дополнениями).
2. Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 г. № 203н «Об утверждении критериев оценки качества медицинской помощи».
3. Приказ Министерства здравоохранения Российской Федерации от 17 декабря 2015 г. № 1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
Алгоритм ведения пациента представлен в Приложении Б.
Приложение А1. Состав рабочей группы
Власенко А.В. — д.м.н., профессор кафедры анестезиологии и неотложной медицины ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России.
Грицан А.И. — д.м.н., проф., заведующий кафедрой анестезиологии и реаниматологии ИПО ФГБОУ ВО «Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого» Минздрава России, директор КГБОУ ДПО «Красноярский краевой центр повышения квалификации специалистов со средним медицинским образованием», президент Красноярской краевой ассоциации анестезиологов и реаниматологов, главный внештатный специалист анестезиолог-реаниматолог Министерства здравоохранения Красноярского края, главный внештатный анестезиолог-реаниматолог Сибирского федерального округа, вице-президент Общероссийской общественной организации «Федерация анестезиологов и реаниматологов».
Киров М.Ю. — д.м.н., проф., заведующий кафедрой анестезиологии и реаниматологии ФГБОУ ВО «Северный государственный медицинский университет» Минздрава России.
Колесниченко А.П. — д.м.н., проф., профессор кафедры анестезиологии и реаниматологии ИПО ФГБОУ ВО «Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого» Минздрава России.
Лебединский К.М. — д.м.н., проф., заведующий кафедрой анестезиологии и реаниматологии им. В.Л. Ваневского ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России.
Николаенко Э.М. — д.м.н., проф., руководитель Центра анестезиологии и реанимации НЧУЗ «Научный клинический центр открытого акционерного общества «Российские железные дороги».
Проценко Д.Н. — главный врач ГБУЗ города Москвы «Городская клиническая больница № 40» Департамента здравоохранения города Москвы, к.м.н., доц., зав. кафедрой анестезиологии и реаниматологии ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, член Президиума Общероссийской общественной организации «Федерация анестезиологов и реаниматологов».
Ярошецкий А.И. — д.м.н., заведующий отделом анестезиологии и реаниматологии НИИ клинической хирургии ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
Приложение В. Информация для пациента
Заболевания органов дыхания встречаются очень часто. Существуют убедительные доказательства в поддержку использования неинвазивной вентиляции легких у пациентов с острой дыхательной недостаточностью на фоне обострения хронических обструктивных заболеваний легких, острого кардиогенного отека легких или иммуносупрессии. Кроме этого, применение неинвазивной вентиляции легких сокращает частоту неудачных экстубаций у пациентов с хроническими обструктивными заболеваниями легких.
Неинвазивная вентиляция сокращает риск развития нозокомиальной пневмонии в 3—5 раз по сравнению с инвазивной вентиляцией легких, особенно у пациентов с иммуносупрессией.
Однако следует помнить о следующих осложнениях неинвазивной вентиляции легких:
1. Нарушение выведения углекислого газа может быть связано с рециркуляцией газа в дыхательном контуре. Для предотвращения повторного вдыхания углекислого газа необходимо обеспечить адекватный дыхательный объем, увеличить время выдоха, использовать достаточный уровень положительного давления в конце выдоха.
2. Клаустрофобия может проявляться дискомфортом, страхом, чувством стеснения и удушья. Это может быть одной из причин, по которой придется отказаться от проведения неинвазивной вентиляции легких. Для купирования данного состояния необходимо правильно подобрать маску, аккуратно приложить ее к лицу и зафиксировать. Начинать вентиляцию нужно с осторожностью, например с режима СРАР 5 см вод.ст. и затем постепенно добавлять поддержку давлением до улучшения состояния пациента. Можно попытаться успокоить пациента или рассмотреть использование легкой седации, сменить аппарат для проведения неинвазивной вентиляции легких.
3. Повреждение кожи лица (эритема, язвы) в области прилегания маски происходит в 5—30% случаев после нескольких часов вентиляции и в 100% случаев после двух суток процедуры. Это состояние является одним из основных факторов, который может ограничить толерантность и сроки проведения неинвазивной вентиляции легких. Необходим корректный подбор маски, важно использовать интерфейс с меньшей зоной маски и большей областью упругой прокладки в области лба.
4. Аэрофагия и растяжение желудка встречаются у 5—40% пациентов. Во время неинвазивной вентиляции легких объем вентиляции распределяется между легкими и желудком. То, насколько это будет существенно, влияет на сопротивление дыхательных путей, состояние пищеводного сфинктера, скорость потока, величину дыхательного объема, время вдоха. При необходимости следует рассмотреть вопрос об установке желудочного зонда и использовании прокинетиков. Раздувание желудка может спровоцировать рвоту и аспирацию желудочного содержимого с развитием серьезных осложнений.
Выбор респиратора, адекватные параметры вентиляционной поддержки, навыки персонала, детальный клинический и инструментальный мониторинг имеют решающее значение для минимизации риска осложнений во время проведения неинвазивной вентиляции легких.
После проведенного курса лечения в стационаре при выписке больному рекомендуют продолжить лечение. Необходимо наблюдать за своим состоянием и регулярно посещать врача.
Финансирование. Исследование не имело финансовой поддержки.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts interest.
Сведения об авторах
Ярошецкий А.И. — д.м.н., зав. отделом анестезиологии и реаниматологии НИИ клинической хирургии ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, 117997, Москва; е-mail: dr.intensivist@gmail.com; https://orcid.org/0000-0002-1484-092X
Автор, ответственный за переписку: Ярошецкий А.И. —
е-mail: dr.intensivist@gmail.com
* Особенности применения НИВЛ при различных нозологиях описаны в разделе 2 «Основные показания и противопоказания для проведения неинвазивной респираторной поддержки».
* Подробное описание представлено в разделе 2 «Основные показания и противопоказания для проведения неинвазивной респираторной поддержки».