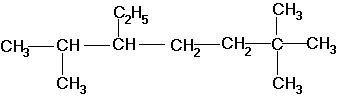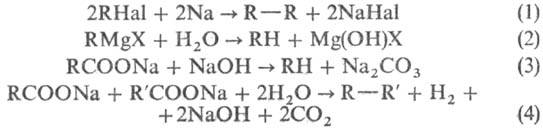Что значит насыщенные углеводороды
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
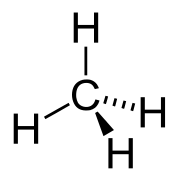
(предельные углеводороды), орг. соед., углеродные атомы к-рых соединены между собой простыми (ординарными) связями. В статье рассмотрены алифатич. насыщ. углеводороды общей ф-лы С n Н 2n+2 (алканы, парафины, метановые углеводороды). О циклич. Н. у. см. в ст. Алщиклические соединения.
Распространение в природе. Осн. источник Н. у. в природе-нефть; фракции нефти 200-430 °С содержат 30-50% (по массе) Н. у. (из них до 60% углеводородов нормального строения); низшие газообразные Н. у. входят в состав прир. газа (до 98% метана) и растворены в нефти; твердые встречаются в виде залежей озокерита, а также образуют восковые покрытия листьев, цветов и семян растений, входят в состав пчелиного воска.
Свойства. Длины связей СЧС в Н. у.
0,109 нм, угол ССС в газообразном состоянии 109,47°, в кристаллическом-на 2-3° больше.
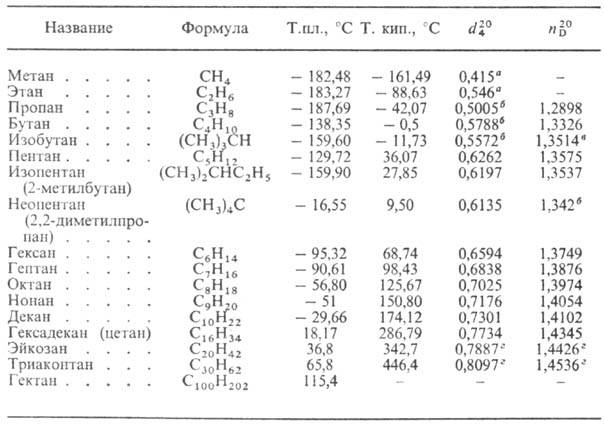
ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ
Нагревание Н. у. без доступа воздуха выше 450 С С приводит к гомолитич. разрыву связей СЧСu образованию олефинов (термич. крекинг). Пром. значение имеет пиролиз легких нефтяных фракций в этилен. В отличие от термического каталитич. крекинг Н. у. протекает по ионному механизму и служит для получения высокооктановых бензинов из более тяжелых фракций нефти. В присут. Н 2 под давлением и катализаторов (Ni, Pt) идет гидрогенолиз (гидрокрекинг) с образованием Н. у. меньшей мол. массы. Каталитич. риформинг на Pt/Al 2 O 3 приводит к дегидроциклиза-ции Н. у. в ароматич. и циклопентановые углеводороды и сопровождается гидрокрекингом и изомеризацией. При дегидрировании Н. у. на разл. катализаторах при 500-600 °С образуются олефиновые и диеновые углеводороды, в присут. АlСl 3 или Pt/Al 2 O 3 Н. у. нормального строения изомеризуются в Н. у. с разветвленной углеродной цепью.
Нитрование Н. у. HNO 3 или N 2 O 4 в газовой фазе приводит к образованию смеси нитропроизводных и протекает по радикальному механизму с разрывом связей СЧС (р-ция Коновалова). По ионному механизму протекает нитрование устойчивыми нитрониевыми солями, напр. NOPFeT в р-рах HF или HSO 3 F. Н. у. вступают в р-ции сульфохлорирования и сульфоокисления; образующиеся соед. используют в синтезе ПАВ. Обработка Н. у. нитрозилхлоридом или смесью NO и Cl 2 приводит к нитрозоалканам-промежут. продуктам в произ-ве полиамидов. При фосфонилировании смесью РСl 3 и О 2 образуются дихлориды фосфоновых к-т, а при карбоксилировании фосгеном или оксалилхлоридом-ацил-хлориды.
Для Н. у. характерно образование клатратных соед. (см. Газовые гидраты). Н. у. нормального строения, начиная с гексана, образуют комплексы с мочевиной, что используется в пром-сти при карбамидной депарафинизации нефтепродуктов. Н. у. изостроения образуют аналогичные соед. с тиомочевиной, циклодекстрином и холевой к-той. Низшие газообразные Н. у., особенно под давлением, склонны к образованию клатратных соед. с водой (6 молекул воды), к-рые могут вымерзать на внутр. стенках газопроводов.
В лаб. условиях Н. у. получают гидрированием олефинов на катализаторах (Pt, Pd, Ni, Rh); восстановлением гало-генопроизводных Н. у. амальгамой Na, гидридами металлов, а также Н 2 на Pd/BaCO 3 ; по р-ции Вюрца [в основном симметрич. Н. у. (1)]; гидролизом реактивов Гриньяра (2); окислит. декарбоксилированием к-т (3) (полученные Н. у. содержат на 1 атом углерода меньше, чем исходная к-та). Н. у. образуются также при фотохим. декарбоксилировании первичных карбоновых к-т Рb(ОСОСН 3 ) 4 в СНСl 3 или электрохим. синтезом Кольбе (4):
Применение. Н. у. применяют гл. обр. в составе моторных и реактивных топлив, как сырье для хим. и нефтехим. пром-сти; жидкие Н. у. и хлорпроизводные метана и этана используют в качестве р-рителей, твердые (парафин, церезин)-в произ-ве пластмасс, каучуков, синтетич. волокон, моющих средств, а также в пищ. пром-сти, электро- и радиотехнике.
Лит.: Петров Ал. А., Химия алканов, М., 1974; его же, Углеводороды нефти, М., 1984; Несмеянов А. Н., Несмеянов Н. А., Начало органической химии, 2 изд., кн. 1, М., 1974; Общая органическая химия, пер. с англ., т. 1, М., 1981. А. А. Братков.
Насыщенные углеводороды
Эта статья — о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Содержание
Номенклатура
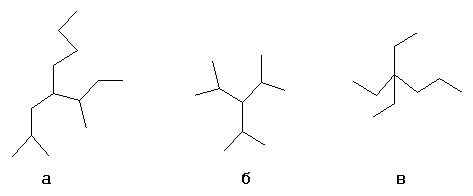
Рациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название алкил1алкил2алкил3алкил4метан, например:
а- н-бутил-втор-бутил-изобутилметан б- триизопропилметан в- триэтил-пропилметан
Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы не одинаковые, то их названия перечисляются в алфавитном порядке. Например:
Гомологический ряд и изомерия
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
| Гомологический ряд алканов (первые 10 членов) | ||
|---|---|---|
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| н-Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| н-Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| н-Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| н-Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| н-Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| н-Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| н-Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H22 |
Физические свойства
Спектральные свойства
ИК-спектроскопия
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектроскопия
Масс-спектрометрия
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
В общем случае уравнение реакции горения для любого углеводорода CxHy, можно записать в следующем виде:
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450°С и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
Восстановление карбонильных соединений
Гидрирование непредельных углеводородов
Синтез Кольбе
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор Ni:
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идёт в ТГФ при температуре −80 °C.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)
Синтез Фишера-Тропша
Биологическое действие
Обладают наркотическим действием, которое возрастает с увеличением числа атомов углерода. При хроническом действии нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов.
Литература
Ссылки
Углеводороды
| Органические вещества | |
|---|---|
| Углеводороды | Алканы · Алкены · Алкины · Диены · Циклоалканы · Арены |
| Кислородсодержащие | Спирты · Простые эфиры · Альдегиды · Кетоны · Кетены · Карбоновые кислоты · Сложные эфиры · Углеводы · Жиры · Хиноны |
| Азотсодержащие | Амины · Амиды · Нитросоединения · Нитрозосоединения · Оксимы · Нитрилы · Аминокислоты · Белки · Пептиды |
| Серосодержащие | Меркаптаны · Тиоэфиры · Сульфокислоты · Тиоальдегиды · Тиокетоны · Тиокарбоновые кислоты |
| Фосфорсодержащие | Фосфины · Фосфонистые кислоты · Фосфиновые кислоты · Фосфоновые кислоты · Нуклеиновые кислоты · Нуклеотиды |
| Кремнийорганические | Силаны · Силазаны · Силтианы · Силоксаны · Силиконы |
| Элементоорганические | Германийорганические · Борорганические · Оловоорганические · Свинецорганические · Алюминийорганические · Ртутьорганические · Другие металлоорганические |
| Другие важные классы | Галогенуглеводороды · Гетероциклические соединения · Перфторуглеводороды |
Полезное
Смотреть что такое «Насыщенные углеводороды» в других словарях:
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ — в органической химии класс (см.), в молекулах которых атомы (см.) соединены друг с другом и с атомами (см.) одинарными (простыми) связями. Все валентности атомов углерода в них насыщены до предела атомами водорода, поэтому их называют еще… … Большая политехническая энциклопедия
насыщенные углеводороды — 3.1.3 насыщенные углеводороды: Алканы и циклоалканы. Источник: ГОСТ Р 52063 2003: Нефтепродукты жидкие. Определение группового углеводородно … Словарь-справочник терминов нормативно-технической документации
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ — (предельные углеводороды), орг. соед., углеродные атомы к рых соединены между собой простыми (ординарными) связями. В статье рассмотрены алифатич. насыщ. углеводороды общей ф лы С n Н 2n+2 (алканы, парафины, метановые углеводороды). О циклич. Н.… … Химическая энциклопедия
НАСЫЩЕННЫЕ СОЕДИНЕНИЯ — (предельные соединения) органические соединения, в молекулах которых атомы соединены между собой только простыми связями в открытые цепи (алифатические насыщенные соединения) или циклы (алициклические насыщенные соединения). К насыщенным… … Большой Энциклопедический словарь
насыщенные соединения — (предельные соединения), органические соединения, в молекулах которых атомы соединены между собой только простыми связями в «открытые» цепи (алифатические насыщенные соединения) или циклы (алициклические насыщенные соединения). К насыщенным… … Энциклопедический словарь
Углеводороды — класс органических соединений, молекулы которых состоят только из атомов углерода и водорода. В зависимости от строения различают ациклические, или алифатические, У., в молекулах которых атомы углерода связаны друг с другом в линейные или … Большая советская энциклопедия
УГЛЕВОДОРОДЫ — орг. соед., молекулы к рых состоят только из атомов С и H. Различают алифатические, или ациклические, У. (см. Алифатические соединения), в молекулах к рых углеродные атомы образуют линейные или разветвленные открытые цепи (напр., этан, изопрен),… … Химическая энциклопедия
НАСЫЩЕННЫЕ СОЕДИНЕНИЯ — (предельные сосд.), органич. соед., в молекулах к рых атомы соединены между собой только простыми связями в открытые цепи (алифатич. Н. с.) или циклы (алициклич. Н. с.). К Н. с. относятся, напр., алканы, или парафины, общей ф лы СnН2n+2 (метан… … Естествознание. Энциклопедический словарь
УГЛЕВОДОРОДЫ НАСЫЩЕННЫЕ (ПРЕДЕЛЬНЫЕ) — углеводороды, в молекулах которых все атомы углерода связаны между собой простыми связями, в силу чего У. н. лишены способности к реакции присоединения и полимеризации. К У. н. принадлежат метановые (парафиновые) и нафтеновые (полиметиленовые)… … Геологическая энциклопедия
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ (предельные углеводороды), орг. соед., углеродные атомы к-рых соединены между собой простыми (ординарными) связями. В статье рассмотрены алифатич. насыщ. углеводороды общей ф-лы С n Н 2n+2 (алканы, парафины, метановые углеводороды). О циклич. насыщенных углеводородах см. в ст. Алщиклические соединения.
Распространение в природе. Осн. источник насыщенных углеводородов в природе-нефть; фракции нефти 200-430 °С содержат 30-50% (по массе) насыщенных углеводородов (из них до 60% углеводородов нормального строения); низшие газообразные насыщенные углеводороды входят в состав прир. газа (до 98% метана) и растворены в нефти; твердые встречаются в виде залежей озокерита, а также образуют восковые покрытия листьев, цветов и семян растений, входят в состав пчелиного воска.
Свойства. Длины связей С—С в насыщенных углеводородах
0,109 нм, угол ССС в газообразном состоянии 109,47°, в кристаллическом-на 2-3° больше.
ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ
Нагревание насыщенных углеводородов без доступа воздуха выше 450 С С приводит к гомолитич. разрыву связей С—Сu образованию олефинов (термич. крекинг). Пром. значение имеет пиролиз легких нефтяных фракций в этилен. В отличие от термического каталитич. крекинг насыщенных углеводородов протекает по ионному механизму и служит для получения высокооктановых бензинов из более тяжелых фракций нефти. В присут. Н 2 под давлением и катализаторов (Ni, Pt) идет гидрогенолиз (гидрокрекинг) с образованием насыщенных углеводородов меньшей мол. массы. Каталитич. риформинг на Pt/Al 2 O 3 приводит к дегидроциклиза-ции насыщенных углеводородов в ароматич. и циклопентановые углеводороды и сопровождается гидрокрекингом и изомеризацией. При дегидрировании насыщенных углеводородов на разл. катализаторах при 500-600 °С образуются олефиновые и диеновые углеводороды, в присут. АlСl 3 или Pt/Al 2 O 3 насыщенные углеводороды нормального строения изомеризуются в насыщенные углеводороды с разветвленной углеродной цепью.
Нитрование насыщенных углеводородов HNO 3 или N 2 O 4 в газовой фазе приводит к образованию смеси нитропроизводных и протекает по радикальному механизму с разрывом связей С—С (р-ция Коновалова). По ионному механизму протекает нитрование устойчивыми нитрониевыми солями, напр. NOPFeT в р-рах HF или HSO 3 F. Насыщенные углеводороды вступают в р-ции сульфохлорирования и сульфоокисления; образующиеся соед. используют в синтезе ПАВ. Обработка насыщенных углеводородов нитрозилхлоридом или смесью NO и Cl 2 приводит к нитрозоалканам-промежут. продуктам в произ-ве полиамидов. При фосфонилировании смесью РСl 3 и О 2 образуются дихлориды фосфоновых к-т, а при карбоксилировании фосгеном или оксалилхлоридом-ацил-хлориды.
Для насыщенных углеводородов характерно образование клатратных соед. (см. Газовые гидраты). Насыщенные углеводороды нормального строения, начиная с гексана, образуют комплексы с мочевиной, что используется в пром-сти при карбамидной депарафинизации нефтепродуктов. Насыщенные углеводороды изостроения образуют аналогичные соед. с тиомочевиной, циклодекстрином и холевой к-той. Низшие газообразные насыщенные углеводороды, особенно под давлением, склонны к образованию клатратных соед. с водой (6 молекул воды), к-рые могут вымерзать на внутр. стенках газопроводов.
В лаб. условиях насыщенные углеводороды получают гидрированием олефинов на катализаторах (Pt, Pd, Ni, Rh); восстановлением гало-генопроизводных насыщенных углеводородов амальгамой Na, гидридами металлов, а также Н 2 на Pd/BaCO 3 ; по р-ции Вюрца [в основном симметрич. насыщенные углеводороды (1)]; гидролизом реактивов Гриньяра (2); окислит. декарбоксилированием к-т (3) (полученные насыщенные углеводороды содержат на 1 атом углерода меньше, чем исходная к-та). Насыщенные углеводороды образуются также при фотохим. декарбоксилировании первичных карбоновых к-т Рb(ОСОСН 3 ) 4 в СНСl 3 или электрохим. синтезом Кольбе (4):
Применение. Насыщенные углеводороды применяют гл. обр. в составе моторных и реактивных топлив, как сырье для хим. и нефтехим. пром-сти; жидкие насыщенные углеводороды и хлорпроизводные метана и этана используют в качестве р-рителей, твердые (парафин, церезин)-в произ-ве пластмасс, каучуков, синтетич. волокон, моющих средств, а также в пищ. пром-сти, электро- и радиотехнике.
Лит.: Петров Ал. А., Химия алканов, М., 1974; его же, Углеводороды нефти, М., 1984; Несмеянов А. Н., Несмеянов Н. А., Начало органической химии, 2 изд., кн. 1, М., 1974; Общая органическая химия, пер. с англ., т. 1, М., 1981. А. А. Братков.