Что означают квантовые числа электронов в атоме
Что означают квантовые числа электронов в атоме
Орбитальное квантовое число `l` показывает, сколько энергетических подуровней составляют данный уровень и характеризует форму орбиталей. Принимает значения от `0` до `(n-1)`.
При `n=3`, `l` принимает уже три значения: `0` `(s)`; `1` `(p)` и `2` `(d)`. Таким образом, на третьем уровне три подуровня. Орбитали `d`-подуровня имеют форму двух перекрещённых объёмных восьмёрок либо объёмной восьмерки с перемычкой (рис. 1).
При `n=4`, значений `l` уже четыре, следовательно, и подуровней на четвёртом уровне четыре. К перечисленным выше добавляется `3` `(f)`. Орбитали `f`-подуровня имеют более сложную, объёмную, форму.
Магнитное квантовое число `ml` определяет число орбиталей на каждом подуровне и характеризует их взаимное расположение.
Принимает значения `-l` до `+l`, включая `0`.
При `l=1`, `m_l` принимает три значения: `−1`; `0`; `+1`. Значит, орбиталей на данном подуровне (`p`-подуровне) три. Так как `p`-орбитали представляют из себя объёмные восьмёрки (то есть линейной структуры), располагаются они в пространстве по осям координат, перпендикулярно друг другу (`p_x`, `p_y`, `p_z`).
При `l=2`, `m_l` принимает уже пять значений: `−2`; `−1`; `0`; `+1`; `+2`. То есть на `d`-подуровне располагаются пять орбиталей. Это плоскостные структуры, в пространстве занимают пять положений.
Спиновое квантовое число `m_s` характеризует собственный момент количества движения электрона и принимает только два значения: `+1//2` и `-1//2`.
Всё вышесказанное можно обобщить в Таблице 2.
Таблица 2. Квантовые числа, атомные орбитали и число электронов на подуровнях (для `n
Квантовые числа электронов.
Квантовые числа – энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1. Главное квантовое число n характеризует общую энергию электрона и размер орбитали. Оно принимает целочисленные значения от 1: n = 1, 2, 3, 4, 5, 6, 7.
2. Орбитальное (побочное) квантовое число l характеризует форму атомной орбитали и принимает значения от 0 до n-1: 0, 1, 2, 3, …, n-1.
Электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого в s-, р-, d-, f-, g-состояниях различна.
Если l=0 (s-орбиталь), то электронное облако имеет сферическую форму и не обладает направленностью в пространстве.
Если l=1 (p-орбиталь) то электронное облако имеет форму гантели.
d- и f-орбитали имеют более сложную форму.
3. Магнитное квантовое число m характеризует количество орбиталей одинаковой формы и их ориентацию относительно внешнего электрического или магнитного поля. Квантовое число m принимает целочисленные значения в интервале –l, … –1, 0, +1, … +l. Для каждого значения разрешено 2l+1 значений числа m. Например, если l=1, то m имеет 2×1+1, т.е. 3 значения: –1, 0, +1.
4. Спиновое квантовое число s характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 (↑) и –1/2 (↓).
Квантовые числа, что и что, упражнения решены
Рассматривая электрон как стоячую волну, он может иметь только конкретные, а не произвольные колебания; другими словами, это означает, что ваши энергетические уровни квантованы. Следовательно, электрон может занимать только те места, которые характеризуются уравнением, называемым трехмерной волновой функцией..
Решения, полученные из волнового уравнения Шредингера, соответствуют определенным узлам в пространстве, через которые проходят электроны внутри ядра: орбитали. Отсюда, также учитывая волновую составляющую электрона, понятно, что только на орбиталях существует вероятность его нахождения.
Но откуда в игру вступают квантовые числа для электрона? Квантовые числа определяют энергетические характеристики каждой орбитали и, следовательно, состояние электронов. Его значения основаны на квантовой механике, сложных математических вычислениях и приближениях, сделанных из атома водорода..
Следовательно, квантовые числа приобретают диапазон предопределенных значений. Их группа помогает идентифицировать орбитали, через которые проходит конкретный электрон, который, в свою очередь, представляет энергетические уровни атома; и кроме того, электронная конфигурация, которая отличает все элементы.
Верхнее изображение показывает художественную иллюстрацию атомов. Хотя центры атомов немного преувеличены, электронная плотность больше их краев. Это означает, что с увеличением расстояния от ядра вероятность обнаружения электрона уменьшается.
Кроме того, в этом облаке есть области, где вероятность нахождения электрона равна нулю, то есть узлы на орбиталях. Квантовые числа представляют собой простой способ понять орбитали и откуда взялись электронные конфигурации.
Что и каковы квантовые числа в химии?
Квантовые числа определяют положение любой частицы. Для случая электрона они описывают его энергетическое состояние и, следовательно, на какой орбите оно находится. Не все орбитали доступны для всех атомов, и они подчиняются основному квантовому числу N.
Основное квантовое число
Он определяет основной энергетический уровень орбитали, поэтому все нижние орбитали должны приспосабливаться к нему, как и его электроны. Это число прямо пропорционально размеру атома, потому что на больших расстояниях от ядра (большие атомные радиусы), тем больше энергии требуется электронам для перемещения через эти пространства.
Квантовый азимут, угловой или вторичный
Обозначается буквой L, и благодаря этому орбита приобретает определенную форму. Из основного квантового числа N, Какие значения принимает это второе число? Поскольку он является вторым, он определяется как (n-1) с точностью до нуля. Например, если N равно 7, L это тогда (7-1 = 6). И его диапазон значений: 6, 5, 4, 3, 2, 1, 0.
Какая польза от L до сих пор? Эти орбитали со своими формами и в соответствии с приближениями волновой функции соответствуют подслоям основного энергетического уровня.
Отсюда, орбита 7s указывает, что это сферический подслой на уровне 7, в то время как орбита 7p указывает на другой, имеющий форму гантели, но на том же энергетическом уровне. Однако ни одно из двух квантовых чисел все еще точно не описывает «вероятностное местонахождение» электрона.
Магнитное квантовое число
Сферы однородны в пространстве, сколь бы они ни вращались, но это не относится к «весам» или «листьям клевера». Это где магнитное квантовое число вступает в игру мл, которая описывает пространственную ориентацию орбитали на трехмерной декартовой оси.
Как только что объяснил, мл зависит от вторичного квантового числа. Поэтому для определения допустимых значений интервал должен быть записан (-L, 0, +L), и завершите это один за другим, от одного конца до другого.
Например, для 7p, р соответствует L= 1, так что их мл являются (-1 или +1). Именно по этой причине существует три p-орбитали (pх, ри и рZ).
Прямой способ подсчета общего количества мл применяет формулу 2L + 1. Итак, если L= 2, 2 (2) + 1 = 5 и как L равно 2 соответствует орбите d, следовательно, есть пять орбиталей d.
Квантовое число спина
Благодаря вкладу Пола А. М. Дирака было получено последнее из четырех квантовых чисел, которое теперь относится конкретно к электрону, а не к его орбите. Согласно принципу исключения Паули, два электрона не могут иметь одинаковые квантовые числа, а разница между ними падает на спиновый момент, более.
Предсказания, сделанные для числа атомных орбиталей и определяющие пространственное положение электрона как стоячей волны, были подтверждены экспериментально с помощью спектроскопических данных..
Решенные упражнения
Упражнение 1
Какую форму имеет 1-орбита атома водорода и каковы квантовые числа, которые описывают его один электрон?
Во-первых, s обозначает вторичное квантовое число L, чья форма сферическая. Потому что s соответствует значению L равен нулю (с-0, р-1, д-2 и т. д.), число состояний мл это: 2L + 1, 2 (0) + 1 = 1. То есть, есть 1 орбита, соответствующая подслою L, и чье значение равно 0 (-L, 0, +L, но L это 0, потому что это подслой s).
Следовательно, он имеет одну орбиту 1 с уникальной ориентацией в пространстве. Почему? Потому что это сфера.
Каково вращение этого электрона? Согласно правилу Хунда, он должен быть ориентирован как +1/2, потому что он первым занимает орбиту. Таким образом, четыре квантовых числа для электрона 1s 1 (электронная конфигурация водорода): (1, 0, 0, +1/2).
Упражнение 2
Какие подслои ожидаются для уровня 5, а также количество орбиталей?
Решая медленным путем, когда N= 5, L= (N-1) = 4. Следовательно, у нас есть 4 подслоя (0, 1, 2, 3, 4). Каждый подслой соответствует разному значению L и имеет свои собственные значения мл. Если бы сначала было определено количество орбиталей, то было бы достаточно продублировать его, чтобы получить число электронов..
Доступны подслои s, p, d, f и g; следовательно, 5s, 5p, 5d, 5d и 5g. И его соответствующие орбитали задаются интервалом (-L, 0, +L):
Первые три квантовых числа достаточно, чтобы закончить определение орбиталей; и по этой причине государства названы мл как таковой.
Чтобы рассчитать количество орбиталей для уровня 5 (не для итогов по атомам), достаточно применить формулу 2L + 1 для каждого ряда пирамиды:
Обратите внимание, что результаты также можно получить, просто посчитав целые числа в пирамиде. Тогда число орбиталей является их суммой (1 + 3 + 5 + 7 + 9 = 25 орбиталей).
Быстрый путь
Итак, для упражнения 2 у вас есть: 2 (5) 2 = 50 Следовательно, слой 5 имеет 50 электронов, и, поскольку на орбиту может быть только два электрона, имеется (50/2) 25 орбиталей..
Упражнение 3
Возможно ли существование 2d или 3f орбиты? объяснять.
Из них видно, что 2 не входит (0, 1) и 3 в (0, 1, 2). Поэтому 2d и 3f орбитали энергетически не разрешены, и ни один электрон не может пройти через определенную ими область пространства..
Это означает, что элементы во втором периоде периодической таблицы не могут образовывать более четырех связей, тогда как элементы, относящиеся к периоду 3, могут делать это в так называемом расширении валентного слоя..
Упражнение 4
Какая орбита соответствует двум следующим квантовым числам: n = 3 и l = 1?
в качестве N= 3, вы находитесь на уровне 3, и L= 1 обозначает орбиталь р. Поэтому просто орбиталь соответствует 3р. Но есть три p-орбитали, поэтому вам понадобится магнитное квантовое число мл выделить среди них три конкретных орбиты.
Упражнение 5
Какова связь между квантовыми числами, электронной конфигурацией и периодической таблицей? объяснять.
Поскольку квантовые числа описывают энергетические уровни электронов, они также раскрывают электронную природу атомов. Таким образом, атомы располагаются в периодической таблице в соответствии с их числом протонов (Z) и электронов..
Группы периодической таблицы имеют общие характеристики наличия одинакового числа валентных электронов, в то время как периоды отражают уровень энергии, в котором находятся указанные электроны. А какое квантовое число определяет уровень энергии? Основной, N. В результате, N равен периоду, занимаемому атомом химического элемента.
Кроме того, из квантовых чисел получены орбитали, которые после упорядочения по правилу построения Ауфбау приводят к электронной конфигурации. Поэтому квантовые числа находятся в электронной конфигурации и наоборот.
Упражнение 6
Каковы квантовые числа для 2p подслоя 4 атома кислорода?
Есть четыре электрона (4 на р). Они все на уровне N равен 2, занимая подслой L равен 1 (орбитали с весами). Там электроны разделяют первые два квантовых числа, но они отличаются в двух других.
в качестве L это то же самое 1, мл принять значения (-1, 0, +1). Следовательно, есть три орбитали. Принимая во внимание правило Хунда о заполнении орбиталей, будет пара электронов и два из них непарные (↑ ↓ ↑ ↑).
Первый электрон (слева направо от стрелок) будет иметь следующие квантовые числа:
Два других оставшихся
А для электрона на последней 2p-орбите стрелка в крайнем правом положении
Обратите внимание, что четыре электрона разделяют первые два квантовых числа. Только первый и второй электрон разделяют квантовое число мл (-1), так как они соединены в одной орбите.
Квантовые числа электронов



Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Для l=0 s- подуровень, s- орбиталь
l=1 p- подуровень, p- орбитали
l=2 d- подуровень, d- орбитали, l=3- f-подуровень, f-орбитали
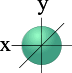 | 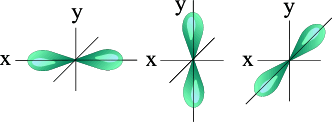 |
| S – орбиталь | Три p – орбитали |
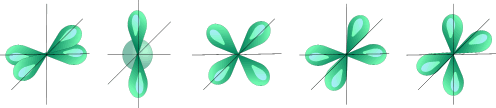 |
| Пять d – орбиталей |
Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения.
Квантовые числа (электронные оболочки)
Квантовые числа это числовое значение квантовой переменной определенного объекта (пример: электронная частица, ядра, атомы), которое характеризует его.
Квантовое число (полностью) характеризует состояние этой частицы.
Согласно современным взглядам стационарные состояния атома или термы характеризуются четырьмя квантовыми числами:
Что такое квантовые числа
При развитии теории Бора оказалось, что для полной характеристики стационарных состояний атома должно учитываться наличие у электронов не только круговых, но и эллиптических орбит (Зоммерфельд), а также и некоторые другие условия, которые увеличивают количество дозволенных энергетических уровней.
Главное квантовое число п определяет дозволенные энергетические уровни атома или в соответствии с моделью Резерфорда—Бора порядковые номера орбит и их радиусы (для эллиптических орбит — большую полуось).
Главное квантовое число может принимать значение любого числа натурального ряда:
Орбитальное или побочное квантовое число l определяет дозволенные значения момента количества движения lэ электрона по орбите.
В модели Бора—Зоммерфельда — дозволенные соотношения малой b и большой а полуосей эллиптических орбит (рис. , а):
где п — главное квантовое число.
Орбитальное квантовое число
Для основной орбиты атома водорода (квантовые числа атома водорода) п = 1 и l = (п — 1) = 0; b/a = 1/n = 1; эта орбита — круговая.
Если п > 1, то орбита имеет форму круга при l = (п — 1). Для примера на рис. , б показана группа орбит с главным квантовым числом n = 3 при трех значениях орбитального квантового числа:
Магнитное квантовое число
Магнитное квантовое число т1 определяет пространственную ориентировку электронных орбит, которая должна удовлетворять дозволенный значениям проекции орбитального момента, на некоторое направление.
В качестве такого направления рассматривается направление внешнего (действующего на атом) магнитного поля.
Движущийся вокруг ядра электрон образует элементарный круговой ток, имеющий собственное магнитное поле.
В результате взаимодействия внешнего магнитного поля с этим полем плоскость орбиты электрона ориентируется в пространстве определенным образом.
Дозволенными являются те положения орбиты, при которых численное значение l‘ э проекции вектора l Э момента количества движения электрона на направление магнитного поля (рис, справа) кратно величине h/2π : l ‘ э = ml (h/2 π), где ml — магнитное квантовое число.
Пример магнитного квантового числа
Для примера на рис. (справа) показано расположение орбиты электрона с некоторыми заданными главным и орбитальным квантовыми числами п и l и различным магнитным квантовым числом, которое изменяется в пределах тl = +1; тl = + 2 и тl — +3 (при отрицательных значениях этих чисел плоскости орбит поворачиваются на 180°).
Таким образом, при данных главном п и орбитальном l квантовых числах электрон в атоме, находящемся под действием магнитного поля, может двигаться по орбитам, имеющим в пространстве (2l + 1) различных положений. Этим положениям соответствуют свои энергетические уровни и, следовательно, линии в спектре (расщепление спектральных линий в магнитном поле называется явлением Зеемана).
Спиновое квантовое число

Тело, вращающееся вокруг своей оси (как, например, волчок), имеет собственный момент количества движения или момент вращения, с которым связаны особые механические свойства тела.
Такие же свойства имеет электрон (и другие элементарные частицы), хотя понятие о вращении вокруг своей оси к ним не применимо, вследствие отсутствия у них определенной внутренней структуры.
Поэтому электрону так же приписывается собственный момент количества движения, который называется спином.
Отсюда следует, что спиновое квантовое число электрона имеет только два значения:
Эти значения обусловливают две дозволенные ориентировки проекции S’ вектора спина S электрона на направление орбитального момента l: параллельную ms= +1/2 (рис. 2, а) и антипараллельную ms = — 1/2 (рис. 2, б).
Квантовые числа сохраняют свое значение и в атомах с большим числом электронов, хотя общая система обозначения состояний (термов) атома при этом усложняется.
Электронные оболочки
Группировка энергетических уровней атома (или орбит электронов по Боровской модели) происходит в соответствии со значением главного и побочного квантовых чисел.
Электроны с одинаковым главным числом п образуют электронные оболочки, которые принято обозначать следующими буквами:
n=1 2 34567.
К L М N О Р Q
Электроны, принадлежащие к определенной оболочке, образуют несколько подоболочек в соответствии с их орбитальным квантовым числом l. Значение этого числа и соответствующих ему подоболочек часто обозначают следующими буквами (буквы заимствованы из названий спектральных линий):
l = 0 1 2 3 4 5
s р d f g h
Поскольку орбитальное квантовое число принимает значения от 0 до (п — 1), число подоболочек равняется порядковому номеру п оболочки. Оболочка К состоит из одной подоболочки s: Оболочка L состоит из двух подоболочек s и р, оболочка М — из трех: s, р,d, и т. д.
Количество электронов в подоболочке обусловливается магнитным и спиновым квантовыми числами.
При этом выполняется принцип Паули: в атоме не может быть двух электронов, находящихся в тождественных состояниях движения, другими словами, не может быть больше одного электрона с четырьмя одинаковыми квантовыми числами.
Поскольку при заданном орбитальном числе l магнитное число тl может иметь (2l + 1) значений и при каждом из них спиновое число ms может иметь два значения, отличающихся знаком, общее количество возможных состояний при этом будет 2•(2l + 1).
Следовательно, подоболочка s (l = 0) может содержать только два электрона, различающиеся знаком спина; подоболочка р (l = 1) — шесть электронов, различающихся тремя магнитными числами и при каждом из них двумя спиновыми; подоболочка d (l = 2) — десять, и т. д.
Число электронов в подоболочке указывается как показатель степени у буквы, ее обозначающей.
Электронная оболочка пример

У гелия на этой же оболочке находится два электрона, отличающиеся спиновыми числами:
1s 2
(рис. 3, а, на котором слева показано схематическое, а справа — условное изображение оболочек).
У элементов второго периода таблицы Менделеева появляется вторая оболочка L. Она может состоять из двух подоболочек s и р.
Сначала запол няется подоболочка 2s (эллиптическая орбита): у лития одним электроном 1s 2 2s, у бериллия — двумя (с разными спиновыми числами) ls 2 2s 2 (рис. 3, б).
Затем заполняется подоболочка 2р (круговые орбиты) электронами с разными значениями магнитного квантового числа: у бора и углерода с ml = 0, у азота и кислорода с ml = + 1, у фтора и неона с тl = —1 (см. таблицу).
Таким образом, у неона подоболочка 2р заполнена шестью электронами:
ls 2 2s 2 2p 6
У натрия появляется третья оболочка М с одним электроном 1s 2 2s 2 2p 6 3s (рис. 3, г), и т. д.
Последовательность заполнения электронных оболочек сохраняется только у атомов первых 18 элементов.
Затем этот порядок усложняется: в одних случаях новый слой может начинать заполняться раньше, чем окончится заполнение предыдущего, в других случаях, наоборот, происходит заполнение оставшихся мест в предыдущей оболочке при неизменном числе электронов в наружном слое.
Количество электронов в наружной оболочке во всех случаях изменяется только от 1 до 8.
Наибольшее возможное число N электронов в оболочке соответствует условию:
N = 2п 2 ,
где п — главное квантовое число (для оболочки К —2, для L — 8, М — 18).
Это условие выполняется только для первых че тырех оболочек (К — N), для остальных — полное число электронов не достигает максимально возможного.
Сопоставление модели строения электронной оболочки атомов отдельных элементов с расположением их в периодической системе Д. И. Менделеева показывает, что периодичность повторения свойств элементов связана со сходством строения их электронных оболочек.
Число электронных оболочек соответствует номеру периода таблицы, к которому данный элемент принадлежит. В каждом периоде физико-химические свойства элементов связаны с числом электронов во внешнем слое, поэтому при образовании каждого нового слоя они повторяются.
Таким образом установленная Менделеевым периодичность свойств элементов получила новое обоснование в строении электронных оболочек атомов.
Спектр электромагнитного излучения
В связи с тем что радиусы электронных оболочек у атомов различных элементов обратно пропорциональны их порядковому номеру, у элементов с высоким номером орбиты электронов расположены значительно ближе к ядру.
Поэтому разность энергий между соседними уровнями, на которых находятся внутренние электроны, значительно выше, чем для внешних электронов, и для перевода их с одной орбиты на другую, особенно у атомов с высоким порядковым номером, требуется энергия, измеряемая сотнями и тысячами электрон-вольт.
Излучение, которое получается при этом, имеет значительно более высокую частоту и относится уже к дальнему ультрафиолетовому и рентгеновскому.
Имеется еще один механизм электромагнитного излучения — это торможение быстро движущихся электронов электрическим полем атома, внутри которого они пролетают. Фотоны излучения при этом имеют высокую энергию и относятся преимущественно к рентгеновскому излучению.
Еще большую энергию фотонов, чем рентгеновское излучение, и, следовательно, меньшую длину волны имеет гамма-излучение радиоактивных веществ, источником которого является атомное ядро.
Виды оптического излучения
В таблице приведены некоторые данные (частота, длина волны, энергия фотонов), характеризующие различные виды оптического излучения, рентгеновского и гамма-излучения.
| Элемент | Квантовые числа | Обозначение | |||
| п | l | тl | тs | ||
| Н | К (l = 0) | 0 | + 1/2 | 1s | |
| Не | -1/2 | 1s 2 | |||
| Li | L (l = 0) | 0 | + 1/2 | 1s 2 2s | |
| Be | -1/2 | 1s 2 2s 2 | |||
| В | р (l = 1) | 0 | + 1/2 | ls 2 2s 2 2p | |
| С | -1/2 | 1s 2 2s 2 2p 2 | |||
| N | +1 | + 1/2 | 1s 2 2s 2 2p 3 | ||
| О | -1/2 | 1s 2 2s 2 2p 4 | |||
| F | —1 | + 1/2 | 1s 2 2s 2 2p 5 | ||
| Ne | -1/2 | ls 2 2s 2 2p 6 | |||
| Вид излучения | Длина волны | Частота в гц | Энергия фотона в ЭВ | |||
| от | до | от | до | от | до | |
| Инфракрасное | 400 мк | 0,76 мк | 7,5•10 11 | 3,94• 10 14 | 0,0031 | 1,65 |
| Видимое | 760 ммк | 380 ммк | 3,94• 10 14 | 7,9• 10 14 | 1,65 | 3,3 |
| Ультрафиолетовое | 380 ммк | 10 ммк | 7,9• 10 14 | 3,0• 10 16 | 3,3 | 124 |
| Рентгеновское | 10 ммк | 0,001 ммк | 3,0•10 16 | 3,0•10 20 | 124 | 1,2•10 6 |
| Гамма | 0,1 ммк | не определен | 3,0•10 18 | 1,2•10 4 | ||
На рис. 3 приведен общий спектр электромагнитных волн, расположенных в порядке убывания длины волны. Разделение спектра на отдельные участки имеет условный характер, поэтому во многих случаях отдельные виды излучения перекрывают границы участков.
Статья на тему Квантовые числа
Похожие страницы:
Понравилась статья поделись ей






