Что означает термин фермент
Фермент
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Содержание
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен [1]
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках.
Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бюхнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии.
Функции ферментов
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10 −10 моль/л и менее. См. также Каталитически совершенный фермент
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии.
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Соглашения о наименовании ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза).
Кинетические исследования
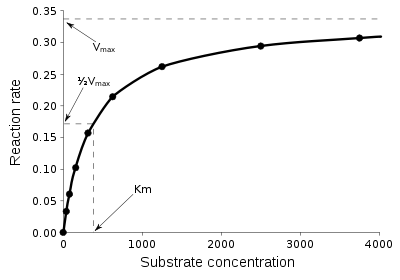
Простейшим описанием кинетики односубстратных ферментативных реакций является уравнение Михаэлиса — Ментен (см. рис.). На сегодняшний момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
Структура и механизм действия ферментов
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
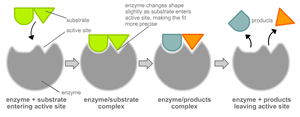
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам. Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты демонстрируют высокий уровень стереоспецифичности, региоселективности и хемоселективности.
Модель «ключ-замок»
Модель индуцированного соответствия
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Еще один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.
Значение слова «фермент»
ФЕРМЕ’НТ, а, м. [латин. fermentum] (биол., хим.). Сложное органическое вещество, вырабатываемое живой клеткой и содействующее различным химическим реакциям, происходящим в организме. Бродильный ф. Ф. гниения. Ф. окисления.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
ферме́нт
1. биохим. белковая молекула или структура из таких молекул, ускоряющая химические реакции в живых системах ◆ Активность ферментов определяется их трёхмерной структурой.
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова флегматичность (существительное):
Ассоциации к слову «фермент»
Синонимы к слову «фермент»
Предложения со словом «фермент»
Цитаты из русской классики со словом «фермент»
Сочетаемость слова «фермент»
Каким бывает «фермент»
Понятия со словом «фермент»
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы (см. ниже).
Отправить комментарий
Дополнительно
Предложения со словом «фермент»
Так, пищеварительные ферменты поджелудочной железы нормально функционируют при рН, равном 8,3.
Подавление активности ферментов имеет значение для тех продуктов, которые консервируют теплом.
По истечении получаса кислый желудочный сок пропитывает пищу целиком, при этом действие ферментов слюны прекращается.
Синонимы к слову «фермент»
Ассоциации к слову «фермент»
Сочетаемость слова «фермент»
Каким бывает «фермент»
Морфология
Правописание
Карта слов и выражений русского языка
Онлайн-тезаурус с возможностью поиска ассоциаций, синонимов, контекстных связей и примеров предложений к словам и выражениям русского языка.
Справочная информация по склонению имён существительных и прилагательных, спряжению глаголов, а также морфемному строению слов.
Сайт оснащён мощной системой поиска с поддержкой русской морфологии.
Ферменты

Этот термин постоянно на слуху, правда, далеко не все понимают, что такое фермент или энзим, какие функции выполняет это вещество, а также чем отличаются ферменты от энзимов и отличаются ли вообще. Все это сейчас и узнаем.
Без этих веществ ни люди, ни животные не смогли бы переваривать пищу. А впервые к применению ферментов в быту человечество прибегло более 5 тысяч лет тому назад, когда наши предки научились хранить молоко в «посуде» из желудков животных. В таких условиях под воздействием сычужного фермента молоко превращалось в сыр. И это только один из примеров работы энзима в качестве катализатора, ускоряющего биологические процессы. Сегодня ферменты незаменимы в промышленности, они важны для производства сахара, маргаринов, йогуртов, пива, кожи, текстиля, спирта и даже бетона. В моющих средствах и стиральных порошках также присутствуют эти полезные вещества – помогают выводить пятна при низких температурах.
История открытия
Энзим в переводе с греческого означает «закваска». А открытию этого вещества человечество обязано голландцу Яну Баптисту Ван-Гельмонту, жившему в XVI веке. В свое время он весьма заинтересовался спиртовым брожением и в ходе исследования нашел неизвестное вещество, ускоряющее этот процесс. Голландец назвал его fermentum, что в переводе означает «брожение». Затем, почти тремя веками позже, француз Луи Пастер, также наблюдая за процессами брожения, пришел к выводу, что ферменты – не что иное, как вещества живой клетки. А через некоторое время немец Эдуард Бухнер добыл фермент из дрожжей и определил, что это вещество не является живым организмом. Он также дал ему свое название – «зимаза». Еще несколькими годами позже другой немец Вилли Кюне предложил все белковые катализаторы разделить на две группы: ферменты и энзимы. Причем вторым термином он предложил называть «закваску», действия которой распространяются вне живых организмов. И лишь 1897 год положил конец всем научным спорам: оба термины (энзим и фермент) решено использовать как абсолютные синонимы.
Структура: цепь из тысяч аминокислот

Каждая аминокислота соединена с другой определенным типом химической связи, а каждый фермент имеет свою уникальную последовательность аминокислот. Для создания большинства из них используются примерно по 20 видов. Даже незначительные изменения последовательности аминокислот могут кардинально менять внешний вид и «таланты» фермента.
Биохимические свойства
Хотя при участии ферментов в природе происходит огромное количество реакций, но все они могут быть разделены на 6 категорий. Соответственно, каждая из этих шести реакций протекает под влиянием определенного типа ферментов.
Реакции при участии энзимов:
Ферменты, участвующие в этих реакциях, называются оксидоредуктазами. В качестве примера можно вспомнить как, алкогольдегидрогеназы преобразуют первичные спирты в альдегид.
Ферменты, благодаря которым происходят эти реакции, называются трансферазами. Они обладают умением перемещать функциональные группы от одной молекулы к другой. Так происходит, например, когда аланинаминотрансферазы перемещают альфа-аминогруппы между аланином и аспартатом. Также трансферазы перемещают фосфатные группы между АТФ и другими соединениями, а из остатков глюкозы создают дисахариды.

Этот вид реакций негидролитическим путем происходит при участии лиазы.
Во многих химических реакциях положение функциональной группы изменяется в пределах молекулы, но сама молекула состоит из того же количества и типов атомов, что были до начала реакции. Иными словами, субстрат и продукт реакции являются изомерами. Такого типа трансформации возможны под влиянием ферментов изомеразы.
Гидролазы разрушают связь, добавляя в молекулу элементы воды. Лиазы осуществляют обратную реакцию, удаляя водную часть из функциональных групп. Таким образом, создают простую связь.
Как работают в организме
Ферменты ускоряют практически все химические реакции, происходящие в клетках. Они имеют жизненно важное значение для человека, облегчают пищеварение и ускоряют метаболизм.
Некоторые из этих веществ помогают разрушать слишком большие молекулы на более мелкие «куски», которые организм сможет переварить. Другие наоборот связывают мелкие молекулы. Но ферменты, говоря научным языком, обладают высокой селективностью. Это значит, что каждое из этих веществ способно ускорять только определенную реакцию. Молекулы, с которыми «работают» ферменты, называются субстратами. Субстраты в свою очередь создают связь с частью фермента, именуемой активным центром.
Существуют два принципа, объясняющие специфику взаимодействия ферментов и субстратов. В так называемой модели «ключ-замок» активный центр фермента занимает в субстрате место строго определенной конфигурации. Согласно другой модели, оба участника реакции, активный центр и субстрат, меняют свои формы, чтобы соединиться.
По какому бы принципу ни происходило взаимодействие результат всегда одинаковый – реакция под воздействием энзима протекает во много раз быстрее. Вследствие такого взаимодействия «рождаются» новые молекулы, которые потом отделяются от фермента. А вещество-катализатор продолжает выполнять свою работу, но уже при участии других частиц.
Гипер- и гипоактивность
Бывают случаи, когда энзимы выполняют свои функции с неправильной интенсивностью. Чрезмерная активность вызывает чрезмерное формирование продукта реакции и дефицит субстрата. В результате – ухудшение самочувствия и серьезные болезни. Причиной гиперактивности энзима может быть как генетическое нарушение, так и избыток витаминов или микроэлементов, используемых в реакции.
Гипоактивность ферментов может даже стать причиной смерти, когда, например, энзимы не выводят из организма токсины либо возникает дефицит АТФ. Причиной такого состояния также могут быть мутированные гены или, наоборот, гиповитаминоз и дефицит других питательных веществ. Кроме того, пониженная температура тела аналогично замедляет функционирование энзимов.
Катализатор и не только

Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться». Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Ферменты в качестве катализаторов ускоряют процессы метаболизма и другие реакции.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине. В частности, служат компонентом ферментативных препаратов, таких как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:

Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию. После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова. Если температура продолжает расти, ковалентные связи рушатся, а каталитическая активность фермента теряется навсегда.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно. Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию. С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
Метаболические «работают» над нейтрализацией токсических веществ, а также способствуют выработке энергии и белков. Ну и, конечно, ускоряют биохимические процессы в организме.
За что отвечают пищеварительные – понятно из названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи. Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости. Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость

Желудок
Здесь пепсин расщепляет белки до состояния пептидов, а желатиназа – желатин и коллаген, содержащиеся в мясе.
Поджелудочная железа
На этом этапе «работают»:
Тонкая кишка
Над пищевыми частицами «колдуют»:
Толстый кишечник

Кроме названных энзимов, существуют еще:
Катализаторы в продуктах
Ферменты имеют решающее значение для здоровья, поскольку помогают организму расщеплять пищевые компоненты до состояния, пригодного для использования питательных веществ. Кишечник и поджелудочная железа производят широкий спектр ферментов. Но кроме этого, многие из полезных веществ, способствующих пищеварению, содержатся также и в некоторых продуктах.
Ферментированные продукты являются практически идеальным источником полезных бактерий, необходимых для правильного пищеварения. И в то время, когда аптечные пробиотики «работают» только в верхнем отделе пищеварительной системы и часто не добираются до кишечника, эффект от ферментативных продуктов ощущается во всем желудочно-кишечном тракте.
Например, абрикосы содержат в себе смесь полезных энзимов, в том числе инвертазу, которая отвечает за расщепление глюкозы и способствует быстрому высвобождению энергии.
Натуральным источником липазы (способствует более быстрому перевариванию липидов) может послужить авокадо. В организме это вещество производит поджелудочная железа. Но дабы облегчить жизнь этому органу, можно побаловать себя, например, салатом с авокадо – вкусно и полезно.
Кроме того, что банан, пожалуй, самый известный источник калия, он также поставляет в организм амилазу и мальтазу. Амилаза содержится также в хлебе, картофеле, крупах. Мальтаза способствует расщеплению мальтозы, так называемого солодового сахара, который в обилии представлен в пиве и кукурузном сиропе.
Другой экзотический фрукт – ананас содержит в себе целый набор энзимов, в том числе и бромелайн. А он, согласно некоторым исследованиям, еще и обладает противораковыми и противовоспалительными свойствами.
Экстремофилы и промышленность
Экстремофилы – это вещества, способны сохранять жизнедеятельность в экстремальных условиях.
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США). Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности. Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
Более того, «услуги» ферментов в таких случаях обходятся дешевле, чем синтетических аналогов. Кроме того, натуральные вещества являются биоразлагаемыми, что делает их использование безопасным для экологии. В природе существуют микроорганизмы, способные расщепить ферменты на отдельные аминокислоты, которые затем становятся компонентами новой биологической цепочки. Но это, как говорится, уже совсем другая история.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru