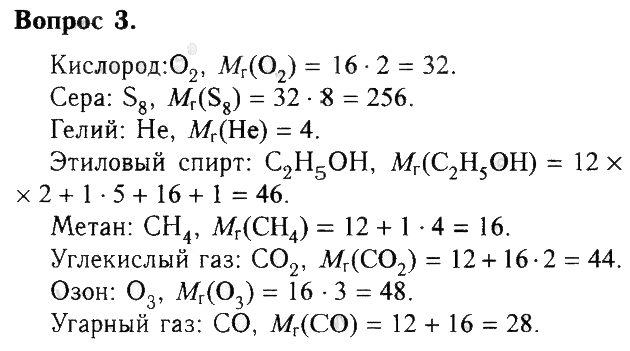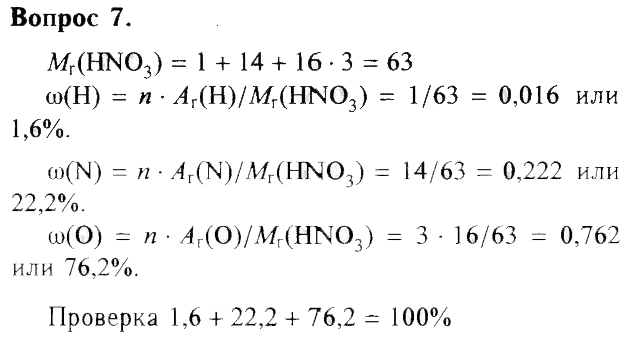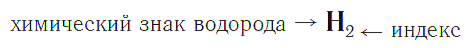Что означает формула 3h2o
Кубок главы по химии 2014. Очный этап. 6 и 7 класс. Решения
КУБОК ГЛАВЫ ПО ХИМИИ 2014. ОЧНЫЙ ЭТАП. 6 И 7 КЛАСС. РЕШЕНИЯ.
2 БАЛЛА ЗА КАЖДЫЙ ПРАВИЛЬНЫЙ ОТВЕТ. МАХ = 20 БАЛЛОВ
1) три молекулы воды 2) шесть молекул воды
3) три молекулы кислорода 4) три молекулы водорода
ПРАВИЛЬНЫЙ ОТВЕТ : 1. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
1) 2; 2) 14; 3) 7; 4) 9; 5) столько же сколько и кислорода
ПРАВИЛЬНЫЙ ОТВЕТ : 2. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
3. Абсолютная масса атома кислорода:
1) 16 г/моль 3) 16 2) 16 г 4) 2,667 ∙ 10-26 кг 5) 6,023 * 1023
ПРАВИЛЬНЫЙ ОТВЕТ : 4. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
4. Формула молекулы вещества, которая состоит из двух атомов натрия,
одного атома кремни я и трех атомов кислорода: ____________________
ПРАВИЛЬНЫЙ ОТВЕТ : Na2SiO3 . ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
5. Выберите формулу пероксида натрия, состоящего из двух атомов натрия и двух атомов кислорода.
1) NaO2 2) Na2O 3) Na2O2 4) Na2O4
ПРАВИЛЬНЫЙ ОТВЕТ : 3 . ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
6. Распределите вещества на простые (А) и сложные (Б).
ПРАВИЛЬНЫЙ ОТВЕТ : В ТАБЛИЦЕ. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
ЕСЛИ ОТВЕТ ВЕРНЫЙ ЧАСТИЧНО, ТО ЗА КАЖДЫЕ ДВЕ ВЕРНЫЕ ЦИФРЫ 0,5 БАЛЛОВ. ВСЕГО НЕ БОЛЕЕ 1,5 БАЛЛОВ.
Формула вещества: А) H2SO4 Б) Cu(OH)2 В) AgNO3 Г) BaCl2
Относительная молекулярная масса:
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА. ЕЛИ ОТВЕТ НЕ ПОЛНЫЙ, ТО ЗА КАЖДОЕ ВЕРНОЕ ЗНАЧЕНИЕ – 0,5 БАЛЛОВ.
8. В составе воздуха больше всего по массе:
1) кислорода 2) углекислого газа 3) воды 4) азота 5) озона 6) глюкозы
9. В воде практически не растворяется одно из следующих веществ:
1) сахар 2) поваренная соль 3) пищевая сода 4) уксусная кислота 5) мел 6) спирт
ПРАВИЛЬНЫЙ ОТВЕТ : 5. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
10. Причиной парникового эффекта может быть избыток в атмосфере одного из газов:
1) водород 2) кислород 3) азот 4) озон 5) углекислый газ 6) гелий
ПРАВИЛЬНЫЙ ОТВЕТ : 5. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Задание № 2. В качестве топлива космических ракет часто используют 1,1-диметилгидразин, который получил техническое название – гептил. Эмпирическая формула этого вещества: N2C2H8 Вопрос 1. Какова массовая доля (в %) азота в гептиле?
РЕШЕНИЕ: ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАС СА ГЕПТИЛА = 60
НА АЗОТ ПРИХОДИТСЯ 28.
МАССОВАЯ ДОЛЯ АЗОТА В ГЕПТИЛЕ: 28/ 60 = 0, 466 ИЛИ 46,6 %
ЗА ПРАВИЛЬНОЕ РЕШЕНИЕ 2 БАЛЛА. ЗА КАЖДОЕ ПРАВИЛЬНОЕ ДЕЙСТВИЕ 0,5 БАЛЛОВ. ЗВ ИНОЕ, НО ВЕРНОЕ РЕШЕНИЕ 2 БАЛЛА.
Вопрос 2. Какое число химических элементов-неметаллов входит в состав гептила?
ПРАВИЛЬНЫЙ ОТВЕТ : 3. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Вопрос 3. При горении гептила в ракетном двигателе протекает химическая реакция:
N2C2H8 + О2 = N2 + CO2 + H2O
В приведённом уравнении нет коэффициентов. Напишите уравнение с коэффициентами.
N2C2H8 + 4 О2 = N2 + 2 CO2 + 4 H2O
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
РЕШЕНИЕ. НАЙДЁМ ОБЪЁМ КОМНАТЫ: 12 * 5 * 3 = 180 м3
НАЙДЁМ СОДЕРЖАНИЕ ГЕПТИЛА В КОМНАТЕ: 180 * 0,03 = 5, 4 грамм
НАЙДЁМ МАССУ АКТИВИРОВАННОГО УГЛЯ: 5,4 / 0,3 = 18 грамм
ЗА ПРАВИЛЬНОЕ РЕШЕНИЕ 2 БАЛЛА. ЕСЛИ РШЕНИЕ ВЫПОЛНЕНО ЧАСТИЧНО, ТО ЗА КАЖДОЕ ВЕРНОЕ ДЕЙСТВИЕ 0,5 БАЛЛОВ. ЗА ЛЮБОЕ ИНОЕ, НО ВЕРНЕ РЕШЕНИЕ 2 БАЛЛА.
Вопрос 5. В качестве окислителя гептила в ракетных двигателях применялась концентрированная азотная кислота. Уравнение горения гептила в НNO3 описывается схемой:
5 N2C2H8 + 16 НNO3 = 13 N2 + 28 H2O + 10 CO2
Какое число формул сложных веществ в этом уравнении реакции?
ПРАВИЛЬНЫЙ ОТВЕТ : 4. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Задание № 3. Формула нитрата аммония: NH4NO3. Это вещество находит широкое применение в качестве азотного удобрения. Впервые получена Глаубером в 1659 году.
Вопрос 2. Смесь нитрата аммония с алюминиевой пудрой (и небольшое количество мазута), под названием аммонал, находила применение в боеголовках ракет, применяемых в годы второй мировой войны. Расставьте коэффициенты в уравнении взрывного разложения аммонала:
NH4NO3 + Al = N2 + H2O + Al2O3 + Q
3 NH4NO3 + 2 Al = 3 N2 + 6 H2O + Al2O3 + Q
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Вопрос 3. Смесь нитрата аммония, цинковой пудры и поваренной соли при определённом соотношении используется в качестве химической зажигалки в походных условиях. Смесь может самовоспламеняться при действии небольшого количества воды, которую в походе всегда можно раздобыть. Хлорид натрия используется в этой смеси в качестве катализатора. Что Вы понимаете под словом катализатор?
ПРАВИЛЬНЫЙ ОТВЕТ: КАТАЛИЗАТОР – ЭТО ВЕЩЕСТВО, КОТОРОЕ В МАЛЫХ КОЛИЧЕСТВАХ СИЛЬНО УСКОРЯЕТ ХИМИЧЕСКУЮ РЕАКЦИЮ, НО САМО ПРИ ЭТОМ НЕ РАСХОДУЕТСЯ.
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА. ЗА ИНОЙ, НО ПО-СУТИ, ВЕРНЫЙ ОТВЕТ 2 БАЛЛА. ЗА НЕПОЛНЫЙ ОТВЕТ НЕ БОЛЕЕ 1 БАЛЛА
Вопрос 4. Нитрат аммония при температуре ниже 270 °C: может разлагаться по схеме:
NH4NO3 = N2O + 2 H2O
«Образующийся оксид азота (II) иногда называют веселящим газом из-за его опьяняющего действия».
Найдите ошибку в предложении взятом в кавычки и исправьте её.
ЗА ВЕРНО НАЙДЕННУЮ ОШИБКУ В ПРЕДЛОЖЕНИИ 2 БАЛЛА.
Вопрос 5. Известно, что при температуре 200 С в 100 грамм воды растворяется 193 грамма нитрата аммония. Сколько грамм нитрата аммония выпадет в осадок из горячего раствора, содержащего 2500 грамм воды и 5800 грамм нитрата аммония, при охлаждении раствора от 800 С до 200С.
РЕШЕНИЕ: в 100 грамм воды растворяется 193 грамма нитрата аммония
в 2500 грамм воды растворяется Х грамм нитрата аммония
ЗА ВЕРНОЕ РЕШЕНИЕ: 2 БАЛЛА.
ЕСЛИ РЕШЕНИЕ ЧАСТИЧНОЕ, ТО ЗА КАЖДОЕ ДЕЙСТВИЕ О,5 БАЛЛОВ, НО ВСЕГО НЕ БОЛЕЕ 1,5 БАЛЛОВ.
ЗА ЮБОЕ ИНОЕ РЕШЕНИЕ, ПРИВОДЯЩЕЕ К ВЕРНОМУ ОТВЕТУ, 2 БАЛЛА
Что означают записи: 3H; 2H2O; 5O2.
Вопросы:
1. Что означают записи: 3H; 2H2O; 5O2?
2. Запишите формулу сахарозы, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода.
3. Используя рисунок 2 (см. с. 5), запишите формулы веществ и рассчитайте их относительные молекулярные массы.
4. Какой форме существования химического элемента кислорода соответствует каждая из следующих записей: 3O; 5O2; 4CO2?
5. Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
6. B каком из веществ, формулы которых SO2 и SO3, массовая доля серы больше? Ответ подтвердите расчетами.
7. Вычислите массовые доли элементов в азотной кислоте HNO3.
8. Дайте полную характеристику глюкозы (C6H12O6, используя пример описания углекислого газа CO2 (см. с. 42).
Ответы:

Вода: физические, химические свойства, химическая формула, плотность
Содержание:
Вода, или оксид (окись) водорода Н2О – важнейшая среда, в которой проходят все химико-биологические реакции. На 65-70 % организмы животных и человека состоят из воды. Ее содержание в растениях еще выше – 90 %. Вода – это основа жизни.
Строение воды
Кислород – электроотрицательный элемент, к которому смещены общие электронные пары. На кислороде возникает частично отрицательный заряд, а на водороде – частично положительный. Вода – электрический диполь. Многие свойства воды обусловлены ее полярностью.
Молекулы воды между собой образовывают водородные связи, которые объясняют высокую плотность и температуру кипения. Чем выше температура реакции, тем меньшее количество связей образуется.
Физические свойства воды
Лед всегда всплывает в водоемах или стаканах с водой. Это связано с тем, что плотность горячей и холодной воды отличается. Лед обладает меньшей плотностью, чем жидкая вода.
Воде свойственна высокая теплоемкость, поэтому она медленно нагревается и остывает. С помощью теплофизических свойств воды регулируется климат. Водные бассейны регулируют температуру на нашей планете. Вода задерживает до 60 % теплового излучения нашей планеты, не позволяя ей охлаждаться.
Теплопроводность воды небольшая. Вода в водоемах нагревается не с помощью молекулярной теплопроводности, а путем перемешивания с помощью волн и течений. Если вода не перемешивается, то она нагревается частями и образуется термическая слоистость (стратификация).
Физсвойства воды отражаются в агрегатных состояниях:
В химии физические свойства воды отражаются в количестве связей между молекулами. В парах находятся отдельные молекулы, в жидкостях между ними образуются водородные связи. Если вода находится в состоянии льда, то каждая молекула соединена с соседними молекулами с помощью четырех водородных связей.
Растворимость веществ в воде
Большинство твердых веществ при нагревании растворяется быстрее. Растворимость газов повышается при понижении температуры и повышении давления.
Растворение многих веществ в воде сопровождается образованием оболочки из молекул воды. Данный комплекс называется гидратом. После кристаллизации в составе таких комплексов сохраняется часть молекул воды, образуя кристаллогидрат:
Растворы
Химические свойства воды
Вода – важнейший компонент такой реакции как гидролиз. Гидролиз – взаимодействие соли с водой, в результате которого происходит ионный обмен между молекулами.
Очистка воды
В питьевой воде не должны содержаться примеси и болезнетворные бактерии. Чтобы вода из озер и рек была пригодна для питья, ей дают отстояться в специальных бассейнах. Затем ее фильтруют через слой песка. Очищенную от нерастворимых веществ воду обрабатывают хлором, озоном или ультрафиолетовыми лучами.
Для очищения воды от растворенных в ней веществ используют перегонку, или дистилляцию. Этим способом получают дистиллированную воду. Ее применяют в лабораториях, аптеках, охладительных системах машин и т. д.
Применение воды
Развитие промышленности привело к тому, что многие водоемы загрязнены отходами производства. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию природных ресурсов.
Вода – важный ресурс для всего живого на планете. Если ее запасы на Земле иссякнут, то растения, животные и человек погибнут. Вода является более ценным природным богатством, чем нефть и газ, железо и уголь и т. д. Это связано с тем, что воду невозможно ничем заменить.
Урок 5. Химическая формула
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
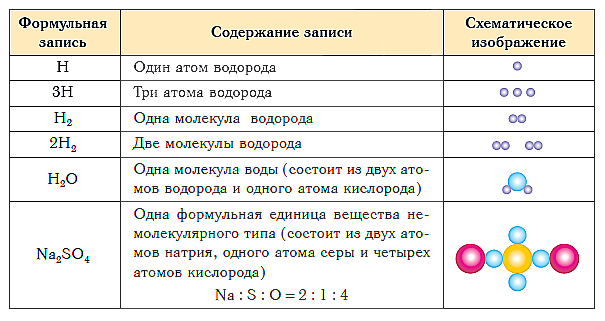
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Химическая формула
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
H 2 SO 4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H 2 SO 4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10 −10 м и масса m = 19.94∙10 −27 кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
Иными словами, «всё познаётся в сравнении». Эталоном является двенадцатая часть атома Углерода. А ОАМ показывает ВО СКОЛЬКО РАЗ отличается масса элемента от эталона. Иначе можно объяснить: образцом сравнения является корзина, в которой содержится 12 яблок. Вся остальная численность, которая может содержаться в других корзинах (это может быть 10, 15, 5) будет сравниваться во сколько раз больше или меньше.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
Например: Ar(Mg) = 24,305
Относительная молекулярная масса (ОММ)
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.
Определим ОММ, например:
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797
32) и путём сложения вычисляем Mr(H2S).
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.
Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?
Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10 −23 г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙10 23 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 10 24 молекул хлора?
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)
Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г /моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 10 23 структурных единиц.
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
Связь количества вещества и объёма выражается в следующем виде:
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?
Как можно увидеть, количество вещества связывает три величины:
Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
Задача 7. Какую массу составляют 18.06 ∙10 23 молекул аммиака (NH3)?
Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?
Закон Авогадро и его следствия
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
Задача 9. Вычислите относительную плотность кислорода по воздуху
Относительная плотность кислорода по воздуху равна