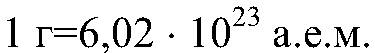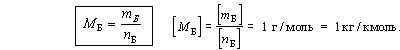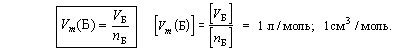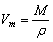Что означает физическая величина молярная масса и чем она отличается
Вопрос № 10 Что означает физическая величина «молярная масса» и чем она отличается от физических величин «молекулярная масса», «масса атома», «относительная молекулярная масса» и «относительная масса»
 Решебник по химии за 8 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №10 к главе «Глава I. Первоначальные химические понятия Задачи к §§ 14-17 (стр. 42)». Решебник по химии за 8 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №10 к главе «Глава I. Первоначальные химические понятия Задачи к §§ 14-17 (стр. 42)». |
Условие задачи: Вопрос № 10 Что означает физическая величина «молярная масса» и чем она отличается от физических величин «молекулярная масса», «масса атома», «относительная молекулярная масса» и «относительная масса»
Вопрос № 10 Что означает физическая величина «молярная масса» и чем она отличается от физических величин «молекулярная масса», «масса атома», «относительная молекулярная масса» и «относительная масса»? Почему численно эти физические величины совпадают?
«Молярная масса» вещества представляет собой отношение его массы к количеству вещества. Это масса одного моля вещества. (Моль-это количество вещества, содержащее 6,02 • 1023 молекул, атомов или других частиц). Обозначают М, выражают в г/моль.
«Молекулярная масса» и «масса атома» это, в свою очередь, масса одной частицы = молекулы или атома. Измеряется в а. е.м. Обозначают: та или тм.
«Относительная молекулярная масса» и «Относительная атомная масса» — это отношение массы молекулы вещества
или атома вещества к 1/12 массы атома углерода. Обозначаются соответственно Mr и Ar, это безразмерные величины.
Численное совпадение этих величин объясняется тем, что
Что означает физическая величина молярная масса и чем она отличается
5.1. Характеристики, свойства и физические величины
В предыдущих главах вы неоднократно сталкивались с характеристиками. Мы говорили о характеристиках химических веществ и реакций, о характеристиках атомов и атомных ядер, о характеристиках элементов и изотопов, а также других объектов или явлений.
Среди множества характеристик мы выделили характеристики, называемые свойствами объектов, выяснили, что свойства могут быть физическими и химическими, и познакомились с некоторыми из них.
Из курса физики вам известна еще одна группа характеристик. Это – физические величины. С ними мы сталкиваемся, как только хотим количественно описать какой-нибудь объект (или явление). Например, сравнивая атомы, мы говорим об их массе и о числе частиц, их составляющих. Сравнивая частицы, мы приводим их массу и электрический заряд. Описывая химическую реакцию, мы говорим о ее скорости, а характеризуя условия протекания реакции, используем физическую величину, называемую температурой. И так далее.
Таким образом, среди великого множества самых разнообразных характеристик объектов или явлений мы выделяем две большие группы: а) свойства – часть чисто качественных характеристик и б) физические величины – качественные и одновременно количественные характеристики этих объектов или явлений.
Следует четко различать сами объекты и явления (реально существуют или происходят в Природе), их характеристики и, в частности, свойства (проявляются объектами и явлениями) и физические величины (качественно и количественно характеризуют объекты или явления). Например: вещество свинец – объект, способность свинца плавиться – его свойство, а температура плавления свинца – физическая величина (в том числе говорящая нам, что свинец способен плавиться). Физические величины не являются свойствами, а свойства, в свою очередь, не могут быть физическими величинами. Перечисляя свойства и характеристики объекта, можно описать его только качественно, а, используя физические величины, можно охарактеризовать объект и качественно, и количественно.
Каждый объект (тело, вещество или частица), как правило, обладает несколькими свойствами и характеристиками и может характеризоваться несколькими разными физическими величинами.

а) ядро атома гелия-4,
б) атом углерода-12,
в) лёд.
Используйте известные вам физические величины для характеристики этих объектов.
2)Проиллюстрируйте ряд объект — свойство — физическая величина тремя примерами.
| Физическая величина (величина) – характеристика материального объекта (или явления), одинаковая в качественном отношении для многих объектов, но в количественном отношении индивидуальная для каждого объекта. |
В качественном отношении физическая величина показывает, что все объекты какой-либо группы обладают определенным свойством. В количественном отношении она показывает, насколько интенсивно конкретный объект проявляет это свойство.
| Род величины – качественная сторона этой величины, показывающая, какую особенность объекта данная величина характеризует. |
| Размер величины – количественная сторона этой величины, показывающая, насколько интенсивно данная особенность проявляется объектом. |
| Однородные величины – величины, одинаковые в качественном отношении (характеризующие одну и ту же особенность объектов). |
Следовательно, длина, ширина, высота, расстояние – однородные величины. Однородные величины можно сравнивать между собой по размеру. Так, мы можем сравнивать радиус атома с расстоянием между молекулами, массу атома с массой слитка металла, длительность урока с периодом обращения Земли вокруг Солнца. Но мы не можем сравнивать температуру воздуха в комнате с теплотой плавления льда или удельную теплоемкость меди с массой слитка этого металла – это пары величин разного рода (характеризуют разные свойства).
Размер величины для каждого объекта существует независимо от того, определяем мы его или нет. Очевидно, что и указка, и Останкинская башня имеют каждая вполне определенную длину, причем разную. Как же определить размер величины? Величину необходимо измерить, то есть сравнить с другой однородной величиной, служащей неким эталоном данной физической величины. В результате измерения мы получаем значение величины. Таким образом, значение физической величины возникает только в результате ее измерения.
Значение величины включает в себя числовое значение величины и единицу измерений.
| Числовое значение величины – отвлеченное число, входящее в значение величины. |
Числовое значение величины показывает, во сколько раз размер измеряемой величины больше размера единицы измерений. Следовательно, числовое значение величины зависит от размера выбранной единицы измерений.
| Единица измерений физической величины – физическая величина фиксированного размера, однородная измеряемой, которой условно присвоено числовое значение, равное единице. |
| Уравнения связи между величинами – уравнения, отражающие законы Природы, в которых под буквенными обозначениями понимаются величины. |
Изучение связей между величинами показало, что, если произвольно выбрать определенное число физических величин в качестве основных, то остальные величины (производные) могут быть выражены через основные величины с помощью уравнений связи. Все величины, вместе взятые, образуют систему физических величин.
| Основные физические величины – величины, входящие в систему величин и условно принятые независимыми от других величин системы. |
| Производные физические величины – величины, входящие в систему величин и определяемые через основные величины этой системы. |
| ИЮПАК – Международный союз теоретической и прикладной химии (IUPAC – International Union of Pure and Applied Chemistry) – неправительственная научная организация, входящая в Международный совет научных союзов. Создана в 1919 году для координации исследований в области химии и химической промышленности, требующих международного согласования, контроля и стандартизации. Членами ИЮПАК являются научные учреждения и промышленные фирмы более чем из 50 стран мира, и, кроме того, международные объединения по отдельным областям химии. В ведении ИЮПАК находится разработка общих принципов и правил химической номенклатуры, терминологии, символики; стандартизация методов измерений в области химии; создание баз данных по различным химическим направлениям, а также другие вопросы, требующие международных договоренностей. |

2.Как значения величины, выраженные в одних единицах измерений, выразить в других единицах? Приведите любые известные вам примеры.
С основными количественными характеристиками атомов вы познакомились в главе 4. Кроме числа протонов в ядре (Z), числа нейтронов в ядре (N) и массового числа (A) это
а) масса атома (нуклида), mо( A Э), [mо( A Э)] = 1 г или 1 кг;
б) атомная масса нуклида, Аr( A Э), [Аr( A Э)] =1 Дн;
в) средняя масса атомов элемента, 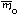
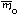
г) атомная масса элемента, Аr(Э), [Аr(Э)] = 1 Дн.
Проанализируем эти величины.
Так как масса атома и атомная масса нуклида – одна и та же величина, но измеренная разными единицами измерений, то
Совершенно аналогично, средняя масса атомов элемента и атомная масса элемента – также одна и та же величина, и в этом случае мы можем записать:
Химические вещества могут состоять из молекул (молекулярные вещества), а могут и не содержать таких обособленных незаряженных частиц (немолекулярные вещества).
Молекулы, как и атомы, естественно, обладают массой. Масса молекулы равна сумме масс составляющих ее атомов. Молекулы разных веществ имеют, как правило, разную массу. Молекулы одного вещества могут несколько отличаться друг от друга по массе, ведь в их состав могут входить атомы разных изотопов. Обычная вода, например, содержит молекулы 1 H2 16 O, 1 H 2 H 16 O, 2 H2 16 O, 1 H2 17 O, 1 H 2 H 17 O, 2 H2 17 O, 1 H2 18 O, 1 H 2 H 18 O и 2 H2 18 O.
В ядерной технике получают и используют вещества, состоящие из совершенно одинаковых молекул, например 2 H2 16 O или 1 H2 18 O, но с такими веществами, а их называют изотопно-чистыми, химики имеют дело крайне редко. Обычно чистое молекулярное вещество содержит молекулы, разные по изотопному составу и, соответственно, по массе.
Как посчитать среднюю массу молекулы такого обычного вещества, например H2O? Можно, конечно, посчитать массу молекулы каждого из изотопно-чистых веществ, экспериментально определить доли этих молекул в обычном веществе и, так же, как мы рассчитывали среднюю массу атома элемента в природной смеси изотопов, рассчитать среднюю массу молекулы. Но можно воспользоваться атомными массами элементов, ведь это уже средние массы, и в них учтены доли изотопов в природной смеси:
| Молекулярная масса вещества – средняя масса молекулы этого вещества, выраженная в дальтонах. |
Молекулярная масса вещества рассчитывается по молекулярной формуле.
Как и для атомов, для молекул (например, молекул воды) справедливы соотношения
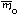
Для характеристики немолекулярных веществ (а иногда и молекулярных) используется формульная масса.
| Формульная масса вещества – средняя масса формульной единицы этого вещества, выраженная в дальтонах. |
Формульная масса рассчитывается по простейшей формуле, но обозначается так же, как и молекулярная масса – Mr, а масса формульной единицы – так же, как и масса молекулы – 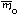
Для простого немолекулярного вещества формульная масса равна атомной массе элемента, например: Mr(К) = Аr(К), Мr(Fe) = Аr(Fe).
Для международной системы единиц (СИ) дальтон – внесистемная единица (то есть его в системе нет), поэтому, измеряя атомную, формульную или молекулярную массу, приходится массу соответствующей структурной единицы (то есть атома, молекулы или формульной единицы) сравнивать не с дальтоном (как единицей измерений), а с 1 /12 частью массы нуклида 12 С. Получающаяся величина (отношение) – величина безразмерная, она называется » относительная атомная (молекулярная, формульная) масса» и численно равна атомной (молекулярной, формульной) массе, выраженной в дальтонах. В химии использовать относительные массы очень неудобно!
Как отмерять взятые для реакции вещества, чтобы они прореагировали без остатка?
Очевидно, что отмерять вещества следует по числу атомов, молекул (для молекулярных веществ) или формульных единиц (для немолекулярных веществ). Обобщенно атомы, молекулы (реальные частицы), формульные единицы (выделенные нами » частицы» ) и другие составные части вещества называют структурными элементами. Число таких структурных элементов в порции вещества является физической величиной, называемой количество вещества. В нашем случае роль структурных элементов выполняют частицы – атомы алюминия и молекулы йода.
Количество вещества – физическая величина, равная числу структурных элементов, составляющих систему.
Значение постоянной Авогадро выбрано таким образом, чтобы числовое значение молярной массы любого вещества было равно числовому значению молекулярной массы, то есть
Числовое значение постоянной Авогадро <NA> называется числом Авогадро.
В Международной системе единиц определение моля формулируется несколько иначе.
| Моль – единица измерений количества вещества, равная количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 12 граммах углерода-12. |
Но так как в 12 г углерода-12 содержится <NA> штук атомов углерода, оба эти определения не противоречат друг другу.
Применяются кратные и дольные единицы, производные от моля: 1 кмоль = 1000 моль, 1 ммоль = 0,001 моль и так далее.
Слово » моль» как обозначение единицы измерений не склоняется (5 моль; 0,25 моль), а в качестве названия единицы измерений (в тексте и устной речи) склоняется как существительное мужского рода (четверть моля, пятью молями, двух молей и тому подобное).
Число частиц в моле вещества (число Авогадро) очень велико, поэтому количество макрообъектов в молях обычно не измеряют, ведь даже звезд в Метагалактике всего лишь порядка одного моля.
Теперь запишем формально не строгое, но понятное определение количества вещества:
| Алюминий – Al – легкий пластичный металл. Как и все металлы – немолекулярное вещество. Алюминий сравнительно дешев и широко используется. Самая близкая любому человеку область его применения – многочисленные бытовые предметы: от кастрюль до фольги. Из измельченного до состояния пудры алюминия изготавливают » серебряную» краску. В некоторых странах, например в Венгрии, из алюминиевых сплавов делают монеты. Крупнейшими потребителями алюминия являются авиационная промышленность, машиностроение и строительство, не говоря уже о том, что большая часть электрических проводов (от линий электропередач до проводов в вашей квартире) делается из алюминия. Но так было не всегда. В течение некоторого времени после открытия (середина XIX века), алюминий был очень дорогим металлом, т. к. способы получения чистого алюминия были в то время слишком сложны. В те годы алюминиевые столовые приборы считались предметом роскоши. |
Из физики вам уже знакомы удельная теплоемкость, удельная теплота плавления, удельная теплота парообразования. Все это – удельные величины.
Удельная величина – отношение величины, характеризующей порцию вещества, к массе этой порции.
Удельная величина показывает значение соответствующей ей обычной величины для порции вещества массой 1 килограмм.
Но 1 кг меди содержит одно число атомов меди, а 1 кг свинца – совсем другое (где больше?). Очень часто, особенно при химических расчетах, использовать удельные величины бывает неудобно (почему?). В этом случае значение величины относят к стандартному числу частиц – к одному молю, то есть используют не удельные, а молярные величины.
Молярная величина – отношение величины, характеризующей порцию вещества, к количеству вещества этой порции.
Молярная величина показывает значение соответствующей обычной величины для 1 моля вещества.
С одной из молярных величин вы уже знакомы – это молярная масса.
Молярная масса вещества Б – отношение массы порции вещества Б к количеству вещества этой порции.
Молярная масса вещества соответствует массе 1 моля этого вещества.
Молярная масса вещества не зависит от внешних условий и агрегатного состояния вещества.
Молярная масса характеризует не только химические вещества, но и элементы, изотопы и любые другие совокупности более или менее одинаковых частиц (ионов, электронов и т. п.).
Другая часто используемая молярная величина – молярный объем.
| Молярный объем вещества Б – отношение объема порции вещества Б к количеству вещества этой порции. |
Молярный объем вещества соответствует объему 1 моля этого вещества.
Молярный объем зависит от температуры и давления и может быть определен для любого агрегатного состояния вещества.
К молярным величинам относится и постоянная Авогадро.
| Постоянная Авогадро (» молярное число частиц» ) – отношение числа частиц в порции вещества к количеству вещества этой порции. |
Три приведенные выше уравнения связи дают нам формулы для вычисления количества вещества, исходя из других данных:
В дальнейшем мы познакомимся и с другими молярными величинами.
В каких из этих веществ при кипении рвутся химические связи, а в каких межмолекулярные? Определите тип строения этих веществ.
7)Расположите молекулярные вещества, найденные вами в таблице (задача 6), в порядке возрастания прочности межмолекулярных связей.
8)Пользуясь данными той же таблицы, определите удельные теплоты кипения водорода, кислорода, воды, оксида бария и железа. Можно ли по полученным значениям сказать что-либо о типе структуры этих веществ?
9)Определите количество вещества хлорида натрия в образце этой соли массой 5,85 г.
10)Определите количества вещества в продажных (килограммовых) пачках поваренной соли и сахара (С12Н22О11). Почему эти количества вещества так сильно отличаются друг от друга?
11)Для проведения реакции необходимо взять 2,5 моля оксида кальция СаО. Сколько нужно отвесить этого вещества на весах?
12)Известно, что в результате реакции термического разложения гидроксида железа Fe(OH)2 образовалось 0,125 моль оксида железа FеО. Определите массу образовавшегося оксида железа.
13)В результате реакции было получено 6,4 г диоксида серы. Какова масса серы, содержащейся в этом диоксиде? Что в данном случае означает слово » сера» в вопросе задачи?
14)Оксид алюминия Al2O3 массой 306 г получили из алюминия массой 162 г. Докажите, что алюминий прореагировал полностью.
15)Из 268,8 г железа было получено 650 г трихлорида железа. Полностью ли прореагировало железо? Если нет, то какова масса непрореагировавшего железа?
16)В образце немолекулярного вещества массой 320 г содержится 4 моль этого вещества. Определите формульную массу вещества.
17)Установлено, что в образце желтого металла массой 1,97 г количество вещества составляет 0,01 моль. Какой это металл?
18)3,5 моля вещества с простейшей формулой СН2 имеют массу 196 г. Определите молекулярную формулу этого вещества.
19)Определите молекулярную формулу одной из аллотропных модификаций серы, если 0,02 моль этого вещества имеет массу 5,12 г.
20)При исследовании 6 г вещества с простейшей формулой HPO3 было установлено, что количество вещества в этой порции составляет 0,025 моль. Определите молекулярную формулу исследуемого вещества.
Уравнение связи Vm = V/n не дает нам возможности вычислить молярный объем конкретного вещества, так как непосредственное измерение количества вещества практически невозможно, а измерение объема особенно для твердых веществ часто бывает довольно сложным и трудоемким.
Преобразуем это уравнение. Вспомним, что
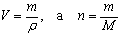
тогда 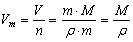
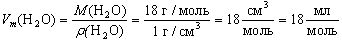
Аналогично определим молярные объемы некоторых других веществ и внесем их в таблицу:
Агрегатное состояние
Молярный объем,см 3 /моль
Примечание
твердое
твердая
твердый
жидкость
Мы с вами убедились, что для твердых и жидких веществ молярные объемы имеют разные значения, а для газов при одинаковых условиях эти значения очень близки. Совершенно одинаковы молярные объемы идеальных газов, то есть газов, в которых кроме упругих соударений между молекулами нет других видов взаимодействия. Подробнее идеальные газы вы будете изучать в курсе физики.
Под одинаковыми условиями понимается одинаковая температура и одинаковое давление. Мы с вами рассчитывали молярные объемы различных газов в условиях, обозначенных в примечании. Именно это сочетание давления и температуры получило название » нормальные условия» (сокращенное обозначение – н. у.).
При нормальных условиях
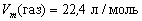 |
Для двух различных газов (1 и 2) количества вещества
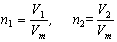
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору