Что означает чсс в медицине
ЧСС — основы
Понимание этих основ поможет вам получить больше от тренировок. Если вы объедините знания о работе организма с вниманием к своим ощущениям во время тренировки, то станете лучше разбираться в том, как работает ваше тело.
ЧСС в состоянии покоя
ЧСС в состоянии покоя (ЧСС – отдых) означает самую низкую ЧСС, когда вы бодрствуете, но отдыхаете.
Это хороший показатель развития вашего аэробного состояния. Когда ЧСС в состоянии покоя уменьшается в результате продолжительного периода тренировок, это означает, что ваше аэробное состояние улучшилось.
Индивидуальный показатель
Когда речь идет о ЧСС в состоянии покоя, важно измерять то, как изменяются ваши личные показатели. Не следует сравнивать себя с кем-то еще. Дело в том, что ЧСС в состоянии покоя двух людей может отличаться на целых 20 уд./мин. При этом тот, чей показатель выше, может оказаться в лучшей аэробной форме, чем другой.
Когда и как измерять ЧСС в состоянии покоя
Измерять ЧСС в состоянии покоя рекомендуется утром дня, следующего за днем отдыха. Проводите замеры утром, сразу после пробуждения, в положении лежа.
1. Наденьте датчик ЧСС. Лягте на спину. Расслабьтесь.
2. Минуту спустя включите тренировку на своем мониторе сердечного ритма. Можно выбрать любой спортивный профиль, например «Другие занятия в помещении».
3. Лежите неподвижно и спокойно дышите в течение 3–5 минут. Не смотрите на монитор.
4. Остановите тренировку на своих часах. В разделе «Общие сведения» найдите среднюю ЧСС — это и будет ваша ЧСС в состоянии покоя.
5. Повторяйте измерения каждые 1–3 недели, стараясь соблюдать исходные условия замеров, насколько это возможно.
Факторы, влияющие на ЧСС в состоянии покоя
На ЧСС в состоянии покоя может влиять множество факторов. Приведем только некоторые из них, чтобы у вас было представление об этой теме.
Стресс
Психический или физический стресс повышает активность симпатического отдела вегетативной нервной системы и соответственно снижает активность парасимпатического отдела. Это может отобразиться как увеличение ЧСС в состоянии покоя.
Психическое состояние
На симпатический и парасимпатический отделы нервной системы влияют различные эмоции. Когда вы очень спокойны, активность парасимпатической нервной системы понижает вашу ЧСС. Когда вы возбуждены, например испытываете агрессию, ЧСС повышается. Таким образом, контролируя эмоции, вы можете косвенно влиять на свою ЧСС в состоянии покоя.
Геном — один из самых важных факторов, влияющих на ЧСС в состоянии покоя. Именно из-за генетических различий у двух людей одного возраста и уровня физической подготовки ЧСС в состоянии покоя может отличаться на 20 и более ударов в минуту.
ЧСС во время тренировки
ЧСС во время тренировки — это частота сердечных сокращений в определенный момент тренировки. Тренируйтесь с разной ЧСС, вместо того чтобы придерживаться одной и той же, и ваша уровень физической подготовки повысится куда быстрее. А для улучшения выносливости (которая является основой физической подготовки) тренироваться нужно с довольно низкой ЧСС.
Аэробное состояние
Аэробное состояние — одно из самых важных составляющих выносливости. Оно выражается в количестве кислорода, транспортируемого кровью и перекачиваемого сердцем к работающим мышцам, а также в эффективности использования этого кислорода мышцами.
Улучшение аэробного состояния означает увеличение способности сердца и всей сердечно-сосудистой системы выполнять свою самую важную задачу: поставлять кислород и энергию вашему телу. Измерение ЧСС во время тренировки помогает улучшать аэробное состояние, ведь вам больше не нужно гадать — вы точно знаете, сколько усилий прилагаете.
Ваше аэробное состояние и производительность
ЧСС во время тренировки может выражаться в ударах в минуту или в процентном отношении от вашей личной максимальной ЧСС. Когда вы тренируетесь для достижения определенных целей, необходимо придерживаться соответствующей ЧСС во время тренировки.
Отслеживайте ЧСС во время тренировки при выполнении подобных, повторяющихся упражнений, и скоро вы увидите, как изменяется ваше аэробное состояние. Например, если ваша ЧСС ниже обычного значения при выполнении подобных упражнений и вы чувствуете себя хорошо, можно предположить, что ваша ежедневная производительность сегодня выше средней, или что ваше аэробное состояние в целом улучшилось.
Максимальная ЧСС
Максимальная ЧСС — это наибольшая возможная ЧСС, которая может быть у человека во время физической нагрузки.
Показатель максимальных возможностей сердца
Когда во время тренировки ваша ЧСС достигает максимального уровня, это значит, что сердце работает на пределе возможностей.
Самая распространенная формула для определения максимальной ЧСС — 220 минус ваш возраст. Она работает для большинства людей. Однако реальная максимальная ЧСС может отличаться от этого значения на десятки ударов в минуту. Вот почему важно определить свою собственную максимальную ЧСС во время тренировки или фитнес-теста (в лаборатории или спортзале).
Вариабельность сердечного ритма (ВСР)
Когда речь идет о равномерности ударов, сердце нельзя сравнить со швейцарскими часами. Вариабельность сердечного ритма определяется разностью интервалов между отдельными ударами сердца и отражает влияние деятельности вегетативной нервной системы на сердце.
Во время физических нагрузок ЧСС увеличивается, а ВСР снижается. И наоборот: когда тело расслабляется, как во время чтения в тишине и спокойствии или во время сна, ЧСС обычно ниже, а ВСР выше.
Тяжелые физические нагрузки и, например, сильный психологический стресс могут снизить ВСР по сравнению с вашим обычным показателем в состоянии покоя. Это признак того, что вы перегружены и нуждаетесь в отдыхе.
Максимальное потребление кислорода (VO2max)
VO2max означает максимальное потребление кислорода. Это максимальный показатель использования организмом кислорода во время серьезных физических нагрузок, задействующих большие группы мышц.
VO2max — хороший показатель аэробного состояния и может предсказать способность демонстрировать хорошие результаты в аэробных видах спорта: беге на длинные дистанции, велосипедном спорте, беговых лыжах и плавании.
Как измерить VO2max?
VO2max можно определить с помощью множества тестов, проводимых как во время физических нагрузок, так и во время отдыха. К примеру, максимальный и субмаксимальный тесты часто проводят на беговой дорожке или велотренажере. Вы можете также пройти фитнес-тест Polar — простой 5-минутный тест, выполняемый в состоянии покоя.
VO2max измеряется в миллилитрах в минуту (мл/мин) либо же это значение делится на вес спортсмена в килограммах (мл/мин/кг).
Во время субмаксимальной динамической нагрузки между потреблением кислорода (VO2) и ЧСС наблюдается линейная зависимость. Когда ЧСС повышается, увеличивается и VO2.
О компании
Присоединяйтесь к нам
Юридическая информация
Станьте инсайдером Polar
Будьте среди первых пользователей, которые узнают об эксклюзивных предложениях, полезных советах для тренировок и последних новостях Polar.
Нажимая «Подписаться», вы соглашаетесь получать эл. письма от Polar и подтверждаете, что прочитали наше Уведомление о конфиденциальности
Change region
If your country/region is not listed on this page, please find your local contact details, retailers and stores and service points on our global site.
Какие шкалы должен использовать кардиолог у пациентов с фибрилляцией предсердий? Что нового?
Частота фибрилляции предсердий (ФП) у взрослых людей в популяции составляет 2-4% [1]. Она увеличивается с возрастом, в том числе под действием различных сопутствующих заболеваний и факторов риска, таких как артериальная гипертония, сахарный диабет, коронарная болезнь сердца, хроническая болезнь почек, ожирение, употребление алкоголя, курение и т.д. В ближайшие годы можно ожидать дальнейшего роста распространенности ФП не только за счет увеличения продолжительности жизни и постарения населения, но и внедрения новых систем скрининга нарушений ритма с помощью мобильных технологий (смартфонов), позволяющих зарегистрировать малосимптомные или бессимптомные нарушения ритма [2]. Например, в исследовании REHEARSE-AF регистрация ЭКГ в одном отведении с помощью смартфона/ планшета два раза в неделю в течение 12 мес у пациентов в возрасте ≥65 лет привела к увеличению частоты диагностики ФП в 3,9 раза по сравнению с обычной тактикой ведения [3]. Использование подобных устройств для скрининга ФП наиболее обосновано у людей пожилого и старческого возраста, а также пациентов с высоким риском инсульта [4].
ФП ассоциируется более чем с 3-кратным увеличением риска смерти [5] и является одной из основных причин инсульта (20-30% и 10% случаев ишемического и криптогенного инсульта, соответственно), который характеризуется тяжелым и рецидивирующим течением и часто приводит к смерти или инвалидизации [1]. ФП сопровождается нарушением функции сердца и развитием сердечной недостаточности, как со сниженной, так и сохраненной фракцией выброса левого желудочка, которая наблюдается у 20-30% таких больных и вызывает дополнительное ухудшение прогноза для жизни [6]. Неблагоприятные последствия ФП включают в себя также снижение качества жизни, особенно у женщин [7], когнитивные расстройства вплоть до деменции [8] и частые госпитализации, ассоциирующиеся с увеличением затрат для системы здравоохранения [9]. По данным мета-анализа 35 исследований в целом более чем у 300000 больных с ФП частота госпитализаций составила в среднем 43,7 на 100 пациентов в год, а одним из основных факторов, ассоциировавшихся с увеличением вероятности поступления в стационар, был пожилой возраст [10].
Ведение больных с ФП
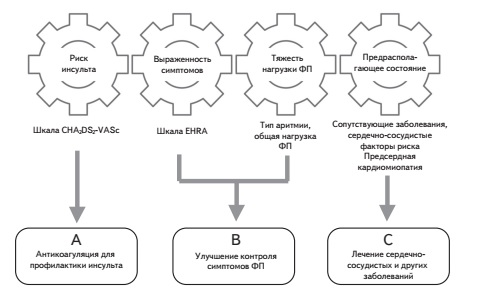
Антикоагулянтная терапия
Для оценки риска инсульта у больных с ФП и, соответственно, необходимости в применении антикоагулянтов используют шкалу CHA2DS2-VASc (табл. 1), которая включает в себя хроническую сердечную недостаточность (ХСН), артериальную гипертонию, возраст ≥75 лет, сахарный диабет, инсульт/транзиторную ишемическую атаку (ТИА)/системную эмболию в анамнезе, сердечно-сосудистое заболевание, в том числе стенозирующий коронарный атеросклероз, подтвержденный при ангиографии, перенесенный инфаркт миокарда, атеросклероз периферических артерий или бляшку в аорте, возраст 65-74 года и женский пол [18]. Необ ходимо отметить, что женский пол скорее модифицирует общий риск развития инсульта, чем является фактором риска сам по себе [19], так как при отсутствии дополнительных факторов риска у женщин вероятность развития инсульта такая же низкая как у мужчин с индексом по шкале CHA2DS2-VASc, равным 0. В то же время при наличии по крайней мере одного дополнительного фактора риска у женщин вероятность инсульта увеличивается в большей степени, чем у мужчин [20].
Склонность к падениям сама по себе не является независимым фактором риска кровотечения на фоне антикоагулянтной терапии, однако травма при падении у пожилого пациента, принимающего пероральные антикоагулянты, может привести к более тяжелому кровотечению, например, внутричерепному. Любопытные данные были получены в одном исследовании, в котором моделировались эффекты падений у пациентов, получающих пероральные антикоагулянты. Авторы показали, что пациенты, принимающие варфарин, должны падать примерно 295 раз в год, чтобы угроза серьезного кровотечений перевесила пользу снижения риска ишемического инсульта [26]. Тем не менее, приведенные данные не отменяют необходимость профилактики падений с помощью простых мер, таких как использование вспомогательных устройств при ходьбе, ношение соответствующей обуви, устранение препятствий для пожилого человека в квартире (ковры, лишняя мебель) и т.д.
Показания к назначению пероральных антикоагулянтов в новых рекомендациях Европейского общества кардиологов не изменились. Их применение необходимо, если значение индекса по шкале CHA2DS2-VASc составляет по крайней мере 2 у мужчин и 3 у женщин. Это означает, что пероральные антикоагулянты следует назначать всем больным с ФП (независимо от пола), достигшим возраста 75 лет, и пациентам в возрасте 6574 года при наличии по крайней мере одного дополнительного фактора риска инсульта, например, артериальной гипертонии или сахарного диабета, в то время как в более молодом возрасте основанием для антикоагуляции служит наличие по крайней мере двух факторов риска как у мужчин, так и у женщин (рис. 2). Если индекс по шкале CHA2DS2-VASc составляет 1 у мужчин или 2 у женщин, то антикоагулянтную терапию считают возможной, хотя четкие показания к ее назначению в таких случаях в рекомендациях не приводятся. ФП обычно развивается у людей пожилого и старческого возраста, страдающих различными заболеваниями, поэтому индекс по шкале CHA2DS2-VASc у большинства больных с этой аритмией превышает указанные значения, обосновывая применение антикоагулянтов. Кроме того, индекс CHA2DS2-VASc имеет тенденцию к увеличению как за счет возраста, так и присоединения новых заболеваний, повышающих риск инсульта. Необходимо еще раз подчеркнуть, что тип ФП (пароксизмальная/персистирующая или постоянная) не имеет значения для решения вопроса об антикоагулянтной терапии и не учитывается при расчете индекса по шкале CHA2DS2-VASc.
Для профилактики инсульта у пациентов с неклапанной ФП применяют антагонисты витамина К, прежде всего варфарин, или прямые оральные антикоагулянты (ПОАК), в том числе ривароксабан, апиксабан, дабигатрин и эдоксабан (последний не зарегистрирован в Российской Федерации). Комбинированная терапия ацетилсалициловой кислотой и клопидогрелом у таких пациентов по эффективности уступала варфарину и сопровождалась сопоставимым риском кровотечений [27], а монотерапия ацетилсалициловой кислотой оказалась неэффективной и ассоциировалась с более высоким риском ишемического инсульта у пожилых людей с ФП [28]. Таким образом, антитромбоцитарные препараты не следует рассматривать как более безопасную альтернативу пероральным антикоагулянтам у пациентов с ФП, нуждающихся в эффективной профилактике инсульта.
В настоящее время ПОАК считают препаратами первой линии в профилактике инсульта у пациентов с неклапанной ФП [11]. В регистрационных клинических исследованиях все препараты этой группы по эффективности по крайне мере не уступали варфарину. Однако при мета-анализе клинических исследований у больных, получавших ПОАК, было выявлено снижение риска инсульта и системных эмболий на 19% по сравнению с таковым при лечении варфарином, снижение риска геморрагического инсульта на 51% и риска смерти от любых причин на 10%. Кроме того, при применении ПОАК было отмечено недостоверное снижение риска больших кровотечений на 14% и статистически значимое снижение риска внутричерепного кровотечения на 52%, в то время как частота желудочно-кишечных кровотечений увеличилась на 25% [29]. Эти данные позволяют рассматривать ПОАК в целом как более эффективную и безопасную альтернативу непрямым антикоагулянтам.
В отличие от ПОАК, варфарин может взаимодействовать с различными лекарственными препаратами, которые могут усилить или, наоборот, ослабить его антикоагулянтное действие. При лечении непрямыми антикоагулянтами необходимо регулярно контролировать международное нормализованное отношение (МНО) и при необходимости корректировать их дозы. В целом антагонисты витамина К считают эффективными и относительно безопасными препаратами, если МНО удается поддерживать в терапевтическом диапазоне более 70% времени, хотя добиться этого удается не всегда. Предложена шкала SAMe-TT2R2 (женский пол, возраст менее 60 лет, наличие по крайней мере двух сопутствующих заболеваний, таких как артериальная гипертония, сахарный диабет, ИБС, атеросклероз периферических артерий, сердечная недостаточность, инсульт в анамнезе, заболевание легких и поражение печени или почек, лечение некоторыми препаратами, курение, неевропеоидная раса), которая позволяет выделить пациентов с ФП, у которых труднее обеспечить адекватный антикоагулянтный эффект варфарина [30]. Величина индекса по этой шкале >2 служит дополнительным доводом в пользу выбора ПОАК. Если больному все же приходится назначить варфарин или другой антагонист витамина К (обычно по экономическим причинам), то необходимо принимать дополнительные меры, чтобы повысить эффективность и безопасность терапии, например, более частое мониторирование МНО, повторные консультации и т.п.
Профиль эффективности ПОАК в профилактике инсульта у пациентов с неклапанной ФП подтвержден также в пострегистрационных исследованиях, результаты которых соответствовали таковым рандомизированных контролируемых исследований 32. P. Kirchhof и соавт. обобщили результаты применения ривароксабана у 11121 пациента с неклапанной ФП (средний возраст 70,5±10,5 лет; 42,9% женщин), включенных в исследования, которые проводились в обычной клинической практике в 47 странах в рамках программы XANTUS (Xarelto for Prevention of Stroke in Patients With Atrial Fibrillation) [34]. Проспективный дизайн исследований повышает клиническую ценность полученных данных. Пациентов с ФП, начавших прием ривароксабана, наблюдали в течение 1 года. Частота больших кровотечений составила в среднем 1,7 на 100-пациентолет, смерти от любых причин – 1,9 на 100 пациентолет, инсульта и системных эмболий – 1,0 на 100 пациенто-лет. Для сравнения, частота первичной конечной точки, включавшей в себя инсульт и системные эмболии, в рандомизированном исследовании ROCKET AF, подтвердившем эффективность ривароксабана в профилактике инсульта у пациентов с неклапанной ФП, составила 1,7 на 100 пациенто-лет [35]. Частота как кровотечений, так и инсульта была низкой во всех странах, принимавших участие в программе XANTUS, а доля пациентов, продолжавших прием ривароксабана в течение года, равнялась 77,4% (от 66,4% в странах Восточной Азии до 84,4% в Западной Европе). Высокая приверженность к приему антикоагулянтной терапии отражает удобство применения ривароксабана, в том числе отсутствие необходимости в титровании дозы и регулярном мониторировании МНО, низкий риск взаимодействия с другими лекарственными средствами, стабильность антикоагулянтного эффекта и возможность назначения один раз в день [36].
Все ПОАК частично выводятся почками – в большей степени дабигатран и в меньшей степени ривароксабан и апиксабан, поэтому при выборе препарата и его дозы следует учитывать функцию почек. Например, дозу ривароксабана у пациентов с клиренсом креатинина 1549 мл/мин следует снизить с 20 до 15 мг один раз в день. Чтобы обеспечить безопасность антикоагулянтной терапии у больных с ФП, необходимо регулярно контролировать функцию почек с помощью клиренса креатитина, рассчитанного по формуле Кокрофта-Гоулта, так как именно этот показатель использовался в регистрационных клинических исследованиях. Оценивать функцию почек следует по крайней мере один раз в год или чаще у пациентов, относящихся к группе риска, например, при наличии исходного снижения функции почек. У пациентов с нарушенной и/или ухудшающейся функцией почек целесообразно рассмотреть применение ПОАК, которые в меньшей степени выводятся почками (ривароксабан или апиксабан). В практическом руководстве Европейской ассоциации аритмологов клиренс креатинина рекомендовано измерять каждые 6 мес у больных в возрасте ≥75 лет (особенно при лечении дабигатраном) и «хрупких» пациентов [37]. Чтобы оценить минимальный интервал определения клиренса креатинина у пациентов с исходно сниженной функцией почек клиренс креатинина следует разделить на 10. Например, у пациентов с его значением 40 мл/мин, клиренс креатинина следует измерять по крайней мере каждые 4 мес. Необходимо учитывать, что функция почек может быстро ухудшиться под влиянием различных интеркуррентных заболеваний, например, инфекций или острой сердечной недостаточности. Соответственно, в таких случаях необходимо также измерить клиренс креатинина.
ФП примерно в трети случаев сочетается с хронической болезнью почек (ХБП) III-V стадии, т.е. снижением расчетной скорости клубочковой фильтрации (СКФ)
Улучшение контроля симптомов
Для оценки симптомов (сердцебиение, одышка, утомляемость, дискомфорт в груди и др.) ФП используют шкалу, предложенную Европейской ассоциацией аритмологов (EHRA) и отражающую влияние проявлений аритмии на обычную повседневную активность пациентов (табл. 3) [46,47]. Необходимо учитывать, что все указанные симптомы неспецифичны и могут быть следствием сопутствующих заболеваний, а подтвердить их связь с ФП иногда удается только ретроспективно. В рекомендациях Европейского общества кардиологов предлагается также оценивать тяжесть нагрузки ФП, которая отражает ее тип, общую длительность сохранения нарушения ритма при мониторировании ЭКГ, например, в течение 24 ч, число эпизодов аритмии, их максимальную длительность и т.п. [11]. Следует отметить, что в рекомендациях отсутствуют четкие критерии интепретации полученных данных. В некоторых исследованиях была выявлена ассоциация между параметрами нагрузки ФП и неблагоприятными клиническими исходами. A. Ganesan и соавт. при мета-анализе 12 исследований примерно у 100000 больных с непароксизмальной неклапанной ФП выявили увеличение риска тромбоэмболий и смерти (относительный риск 1,384; p ТАБЛИЦА 3. Шкала оценки выраженности симптомов ФП (EHRA)
Амиодарон остается самым эффективным антиаритмическим препаратом у больных с ФП, в том числе с сердечной недостаточностью и низкой фракцией выброса левого желудочка. В рекомендациях указано, что с учетом экстракардиальной токсичности амиодарона для длительного контроля синусового ритма у пациентов с ФП желательно по возможности применять другие антиаритмические препараты [11]. Тем не менее, как и в предыдущих версиях рекомендаций, другие антиаритмические средства, такие как пропафенон и соталол, рекомендовано использовать только при отсутствии признаков значительного структурного поражения сердца. Соталол может применяться у пациентов с ишемической болезнью сердца под тщательным контролем интервала QT, сывороточных уровней калия, клиренса креатинина и других факторов риска аритмогенного действия. К последним относят пожилой возраст, женский пол, нарушение функции почек и/или печени, коронарную болезнь сердца, гипокалиемию, случаи внезапной смерти у родственников. Анти арит мическую терапию не следует назначать пациентам с постоянной формой ФП, которые получают урежающие ритм препараты, а также больным с выраженными нарушениями проводимости, если им не установлен водитель ритма.
Лечение сердечно-сосудистых и других сопутствующих заболеваний
Сердечно-сосудистые заболевания и факторы риска, с одной стороны, способствуют развитию и рецидированию ФП, а, с другой стороны, сами могут быть причиной неблагоприятных исходов, в том числе инсульта, инфаркта и смерти. A. Gómez-Outes и соавт. провели мета-анализ 4 клинических исследований, в которых ПОАК сравнивали с варфарином в целом у 71683 больных с неклапанной ФП [55]. Во время периода наблюдения умерли 9% из них, а скорректированная смертность составила 4,72% в год. Доля сердечных причин в структуре общей смертности составила 46%. Основными факторами риска смерти от любых причин были сердечная недостаточность, постоянная/персистирующая ФП, сахарный диабет, мужской пол, пожилой возраст и сниженный клиренс креатинина. Сходные данные были получены в одном из исследований, включенных в мета-анализ, – ROCKET AF, в котором изучался ривароксабан [56]. Приведенные данные указывают на важность модификации сердечнососудистых факторов риска для улучшения прогноза у больных с неклапанной ФП.
Предложены шкалы, позволяющие стратифицировать больных с неклапанной ФП по риску основных сердечно-сосудистых событий, в том числе смертель ного и несмертельного инфаркта миокарда, реваску ляризации коронарных артерий и смерти от сердечно-сосудистых причин. Например, на основании проспективного когортного исследования у 1019 пациентов с ФП разработан индекс 2MACE, который рассчитывается с учетом возраста и наличия метаболического синдрома, застойной сердечной недоста точности и инфаркта миокарда/реваскуляризации коронарных артерий и тромбоэмболий в анамнезе (табл. 4) [57]. Величина индекса 2MACE варьируется от 0 до 7, а его значение ≥3 позволяло с высокой чувствительностью и специфичностью предсказать развитие неблагоприятных исходов у пациентов с неклапанной ФП (отношение рисков 3,92, 95% ДИ 2,41-6,40, p ТАБЛИЦА 4. Шкала 2MACE, предназначенная для оценки риска сердечно-сосудистых событий у пациентов с неклапанной ФП
Заключение
Современная стратегия лечения больных с неклапанной ФП, которая подробно рассматривается в рекомендациях Европейского общества кардиологов 2020 г., предполагает антикоагуляцию с целью профилактики инсульта и системных эмболий, улучшение контроля симптомов ФП путем урежения ЧСС или восстановления и удержания синусового ритма и оптимальное лечение сердечно-сосудистых и других сопутствующих заболеваний, которые в структуре смертности паци ентов с ФП занимают даже более важное место, чем ишемический инсульт. Накапливаются данные, демонстрирующие дополнительные преимущества ПОАК перед непрямыми антикоагулянтами. Например, в мета-анализах рандомизированных клинических исследованиях показано снижение риска развития инфаркта миокарда/ОКС при лечении ривароксабаном по срав нению с контролем. В ретроспективных исследованиях лечение ривароксабаном улучшало почечные исходы у пациентов с неклапанной ФП. Пациентам с ФП следует проводить структурированное обследование, включающее в себя оценку риска инсульта, выраженности симптомов, тяжести нагрузки ФП (тип аритмии, число и длительность эпизодов и т.п.) и предрасполагающего состояния. Важное значение имеет использование различных шкал, в том числе CHA2DS2-VASc (риск инсульта), HAS-BLED (риск кровотечения), EHRA (выраженность симптомов ФП) и 2MACE (риск сердечно-сосудистых исходов), которые помогают выбрать оптимальное лечение. Для более точной оценки риска инсульта и кровотечений у пациентов с ФП предложены новые шкалы на основе не только клинических показателей, но и лабораторных маркеров, однако их потенциальные преимущества перед существующими общепринятыми индексами нуждаются в подтверждении.