Что отражает молекулярная формула
Молекулярная формула
Что такое молекулярная формула
Современные символы химических элементов были введены в науку в 1813 году Я. Берцелиусом. По его предложению элементы обозначаются начальными буквами их латинских названий. Например, кислород (Oxygenium) обозначается буквой О, сера (Sulfur) – буквой S, водород (Hydrogenium) – буквой Н. В тех случаях, когда названия элементов начинаются с одной и той же буквы, к первой букве добавляется еще одна из последующих. Так, углерод (Carboneum) имеет символ С, кальций (Calcium) – Ca, медь (Cuprum) – Cu.
Химические символы – не только сокращенные названия элементов: они выражают и определенные их количества (или массы), т.е. каждый символ обозначает или один атом элемента, или один моль его атомов, или массу элемента, равную (или пропорциональную) молярной массе этого элемента. Например, С означает или один атом углерода, или один моль атомов углерода, или 12 единиц массы (обычно 12 г) углерода.
Молекулярная формула веществ
Формулы веществ также указывают не только состав вещества, но и его количество и массу. Каждая формула изображает или одну молекулу вещества, или один моль вещества, или массу вещества, равную (или пропорциональную) его молярной массе. Например, H2O обозначает или одну молекулу воды, или один моль воды, или 18 единиц массы (обычно (18 г) воды.
Простые вещества также обозначаются формулами, показывающими, из скольких атомов состоит молекула простого вещества: например, формула водорода H2. Если атомный состав молекулы простого вещества точно не известен или вещество состоит из молекул, содержащих различное число атомов, а также, если оно имеет не молекулярное, а атомное или металлическое строение, простое вещество обозначают символом элемента. Например, простое вещество фосфор обозначают формулой P, поскольку в зависимости от условий фосфор может состоять из молекул с различным числом атомов или иметь полимерное строение.
Формулу вещества устанавливают на основании результатов анализа. Например, согласно данным анализа глюкоза содержит 40% (масс.) углерода, 6,72% (масс.) водорода и 53,28% (масс.) кислорода. Следовательно, массы углерода, водорода и кислорода относятся друг к другу как 40:6,72:53,28. Обозначим искомую формулу глюкозы CxHyOz, где x, y и z – числа атомов углерода, водорода и кислорода в молекуле. Массы атомов этих элементов соответственно равны 12,01; 1,01 и 16,00 а.е.м. Поэтому в составе молекулы глюкозы находится 12,01х а.е.м. углерода, 1,01у а.е.м. водорода и 16,00zа.е.м. кислорода. Отношение этих масс равно 12,01х: 1,01у: 16,00z. Но это отношение мы уже нашли, исходя из данных анализа глюкозы. Следовательно:
12,01х: 1,01у: 16,00z = 40:6,72:53,28.
Согласно свойствам пропорции:
x: у: z = 40/12,01:6,72/1,01:53,28/16,00
или х: у: z = 3,33 : 6,65 : 3,33 = 1 : 2 : 1.
Следовательно, в молекуле глюкозы на один атом углерода приходится два атома водорода и один атом кислорода. Этому условию удовлетворяют формулы CH2O, C2H4O2, C3H6O3 и т.д. Первая из этих формул — CH2O — называется простейшей или эмпирической формулой; ей отвечает молекулярная масса 30,02. Для того, чтобы узнать истинную или молекулярную формулу, необходимо знать молекулярную массу данного вещества. Глюкоза при нагревании разрушается, не переходя в газ. Но ее молекулярную массу можно определить и другими методами: она равна 180. Из сопоставления этой молекулярной массы с молекулярной массой, отвечающей простейшей формуле, ясно, что глюкозе отвечает формула C6H12O6.
Таким образом, химическая формула – это изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков, а молекулярную формулу вещества можно получить, зная простейшую формулу вещества и его молекулярную массу.
Примеры решения задач
| Задание | При сжигании 8,4 г углеводорода получили 26,4 г углекислого газа и 10,8 г воды. Относительная плотность паров углеводорода по воздуху равна 42. Найдите молекулярную формулу углеводорода. |
| Решение | Значение молярной массы углеводорода можно определить при помощи его плотности по водороду: |
По массам углекислого газа и воды находим массы углерода и водорода. Однако, для начала рассчитаем их молярные массы. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m (C) = 26,4×12/44 = 7,2 г.
m (H) = 10,8 × 2×1 / 18 = 1,2 г.
Обозначим количество моль элементов, входящих в состав соединения за «х» (углерод) и «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом:
Следовательно, простейшая формула углеводорода имеет вид CH2и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H) = 12+ 2×1 = 12 + 2 = 14 г/моль].
Чтобы найти истинную формулу оксида хлора найдем отношение полученных молярных масс:
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула углеводорода будет иметь вид C6H12. Это гексен.
| Задание | При сгорании 2,3 г органического вещества, состоящего из углерода, водорода и кислорода, образовалось 4,4 г углекислого газа и 2,7 г воды. Плотность паров вещества по кислороду равна 1,44 г. Определите молекулярную формулу вещества. |
| Решение | Значение молярной массы углеводорода можно определить при помощи его плотности по кислороду: |
Msubstance = 32 × 1,44 = 46 г/моль.
По массам углекислого газа и воды находим массы углерода и водорода, а также кислорода (по разнице между массой вещества и атомов углерода и водорода в нем). Однако, для начала рассчитаем их молярные массы. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m (C) = 4,4×12/ 44 = 1,2 г.
m (H) = 2,7 × 2×1 / 18 = 0,3 г.
m(O) = msubstance — m (C) — m (H) = 2,3 – 1,2 – 0,3 = 0,8 г.
Обозначим количество моль элементов, входящих в состав соединения за «х» (углерод), «у» (водород) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z= 1,2/12 : 0,3/1: 0,8/16;
x:y:z= 0,1 : 0,3: 0,05 = 2 : 6 : 1.
Следовательно, простейшая формула органического соединения имеет вид C2H6O и молярную массу 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O) = 2×12+ 6×1 + 16= 24 + 6 + 16 = 46 г/моль].
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит формула органического соединения будет иметь вид C2H6O.
Что отражает молекулярная формула
На первых этапах изучения органической химии очень важно проследить вместе с учащимися, как развивалась наука, накапливался экспериментальный материал, на смену одним теориям приходили другие, и хотя бы немного представить личности ученых, создававших эти теории. Поэтому, введение в органическую химию мы, по мере возможности, построили в исторической последовательности, начиная с накопления данных о составе органических веществ. Конечно, при этом решается основная цель данного занятия – научить школьников решать задачи на определение состава органических соединений по данным элементного анализа, ввести понятия простейшей (брутто) и молекулярной формул, повторить закон Авогадро.
Кстати, на примере биографии Лавуазье 
Спросите учащихся, как убедиться в том, что в состав органических веществ входит углерод. Они должны вспомнить опыты, показанные на предыдущем занятии. При горении древесины обязательно остаются угольки. Если подержать над пламенем газовой горелки, спиртовки или свечи холодное стекло, то оно закоптится. На нем останутся мелкие частицы угля.
При сгорании органических веществ в избытке воздуха или чистого кислорода сажа не образуется, а получается углекислый газ CO2 и вода Н2O.
| Обязательно обсудите проблему неполного сгорания. При обычном горении из углерода образуется не только углекислый газ. Поэтому вещество необходимо сжигать в токе кислорода. Часто еще специально к анализируемому веществу добавляют катализатор, обеспечивающий полноту окисления. Если в состав анализируемого вещества входит еще и азот, то в числе продуктов сгорания будет газ азот, если сера – сернистый газ и.т.п… |
Современные методы элементного анализа органических соединений основаны на принципах, разработанных А.Лавуазье. Вещество сжигают в токе кислорода. Продукты сгорания последовательно пропускают через сосуды с веществами, поглощающими из газовой смеси сначала пары воды, а затем углекислый газ. Очень полезно предложить учащимся обсудить, какие вещества можно использовать для поглощения углекислого газа, а какие – для поглощения воды, и в каком порядке необходимо проводить это поглощение. Сосуды взвешивают до и после проведения опыта. Разность их масс как раз и составляет массу поглощенного вещества.
По уравнению горения CxHy + (x+y/4)O2 = xCO2 + y/2H2O можно рассчитать соотношение x:y и, следовательно, состав. Желательно, чтобы уравнение горения углеводорода в общем виде учащиеся составили сами.
| Пример 1. При сжигании углеводорода образовалось 88 мг оксида углерода (IV) и 72 мг воды. Определите соотношение атомов элементов в молекуле. Решение: Прежде всего, определим количества образовавшихся веществ. Количество углекислого газа составляет: n CO2 = 88 : 44 = 2 ммоль, nH2O = 72: 18 = 4 ммоль. |
Результаты элементного анализа обычно представляют в виде массовых процентов содержания атомов элемента в веществе.
| Пример 2. Рассчитайте, каково процентное содержание атомов элементов в метане. (75% углерода и 25% водорода) Пример 3. Определить состав бутана (бутан используют как горючее в газовых баллонах), если известно, что бутан состоит только из водорода и углерода, а при сжигании порции этого вещества в избытке кислорода было получено 44,8 мл углекислого газа и 45 мг воды. Решение: Пусть в состав молекулы бутана входит x атомов углерода и y атомов водорода. При горении этого вещества образуется х моль CO2 и y/2 моль воды. |
По результатам решения примера 3 формулу бутана можно записать как С2H5.
При решении этой задачи удобно ввести понятия простейшей и молекулярной формул. Формулу, определяемую по данным элементного анализа, называют простейшей. Необходимо подчеркнуть, что простейшая формула не показывает, сколько всего атомов каждого элемента содержится в молекуле. Состав молекулы отражает молекулярная формула. Число атомов в молекулярной формуле кратно числу атомов в простейшей формуле. Другими словами, молекулярную формулу бутана можно записать, как (С2H5.)n. Чтобы узнать n и найти состав молекулы бутана, в условиях Примера 3 не хватает данных.
Найти молекулярную формулу вещества можно, если определить его молярную массу, пользуясь законом итальянского химика Амедео Авогадро. Школьники обычно приходят в восторг, услышав полное имя этого ученого Лоренцо Романо Амедео Карло Авогадро ди Кваренья э ди Черрето (1776-1856).  ] ] |
Можно упомянуть, что такое длинное имя свидетельствует о знатности рода.
Очень часто учащиеся, на вопрос, что же сделал Авогадро, отвечают, что он определил молярный объем газа, вычислил постоянную Авогадро и т.п. На самом деле Авогадро выдвинул гипотезу о том, что равные объемы газообразных веществ при одинаковом давлении и температуре содержат одно и то же число частиц (молекул).
Кстати, полезно упомянуть, что Авогадро сформулировал закон в 1811 г, но его гипотезу не признавали в ученой среде почти 50 лет, отверг ее слишком авторитетный в то время Берцелиус. Только во второй половине девятнадцатого века, уже после смерти Авогадро, появились понятия грамм-молекула (моль), молярный объем (22,4 л при н.у.) и число Авогадро.
Взвешивая газ, определяют его плотность (во сколько один газ тяжелее другого, например воздуха или водорода) рассчитывают плотность газа при нормальных условиях. А зная, что молярный объем газа при н.у. равен 22,4 л/моль, вычисляют его молярную массу.
| Пример 4. Плотность бутана по водороду равна 29. Какова молекулярная формула бутана, если его простейшая формула С2H5 Решение: Зная плотность бутана по водороду, находим его молярную массу, равную 58 г/моль. |
Для определения молярной массы веществ, которые не существуют в парах (к таким соединениям относится, например, сахар), применяют методы, основанные, например, на изучении свойств их растворов. А в последние десятилетия ученые для определения молярных масс используют специальные физические методы (масс-спектрометрию и др.).
| Пример 5 При сожжении в избытке кислорода 0,15 г глюкозы образуются только два вещества: 1,12 л (н.у.) CO2 и 0,9 мл H2O. Определите молекулярную формулы глюкозы, если известно, что ее молярная масса равна 180 г/моль. |
Задачи для решения на семинаре:
1. Определите простейшую формулу вещества, содержащего 14,28% водорода и 85,72 % углерода. Определите его молекулярную формулу, если плотность его паров равна 2,5 г/л (н.у.).
Ответ – СН2
2. Определите простейшую формулу вещества, если при сгорании 7,2 г его получили 22 г углекислого газа и 10,8 г воды. Достаточно ли данных, чтобы определить молекулярную формулу этого вещества?
Ответ – С5Н12
3.Сожгли 4,8 г органического вещества, при этом образовалось 3,36 л (н.у.) углекислого газа и 5,4 мл (н.у.) воды. Плотность паров вещества по водороду равна 16. Определите его молекулярную формулу. Есть ли в задаче лишние данные?
Ответ: CH4O
4. Сгорело 9 г вещества и образовалось 8,96 л (н.у.) углекислого газа, 12,6 г воды и 2,8 г 4. азота. Определите простейшую и молекулярную формулы.
Ответ: С2H7N
А также можно использовать задачи из рекомендуемых пособий и домашнее задание для 10 классов СУНЦ МГУ «Задачи на определение состава органических веществ» 
Расчетным задачам на определение состава необходимо уделять время в течение нескольких последующих семинаров.
Для проверки навыка быстро решать подобные задачи, можно дать самостоятельную работу, подобную следующей:
Состав органических соединений


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Молекулы. Химические формулы. Молекулярные массы
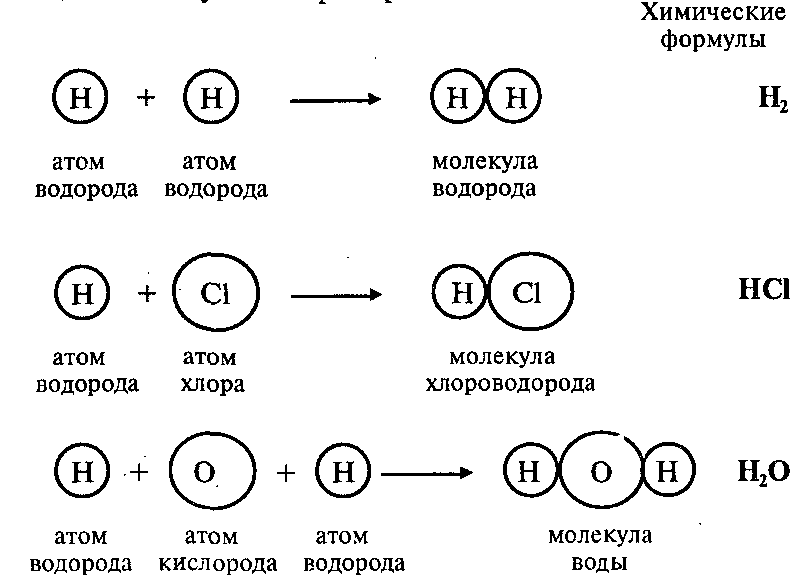
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НCl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2O. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молекула серной кислоты состоит из двух атомов водорода Н, одного атома серы S и четырех атомов кислорода О. Значит, формула молекулы серной кислоты — H2SO4.
Существуют молекулы, в состав которых входит несколько одинаковых групп атомов. В формулах таких молекул эти группы атомов заключают в скобки, а индекс за скобками показывает число этих групп в молекуле. Например, формула Cu(NO3)2 показывает, что эта молекула состоит из одного атома меди и двух групп атомов NО3, т. е. двух атомов азота и шести атомов кислорода.
Таким образом, химические формулы доказывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.): Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так как вещество состоит из одинаковых молекул, то состав молекулы определяет состав всего вещества. Различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
Молекула — это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Например, относительная молекулярная масса воды Н2O равна:
Mr(H2О) = Ar(H) + Аr(Н) + Аr(О) = 2Аr(Н) + Аr(О) =2∙1+16=18;
относительная молекулярная масса сульфата железа (III) Fe2(SO4)3 равна: Mr[Fe2(SO4)3] = 2Ar(Fe) + 3Ar(S) + 12Ar(O) = 2∙56+3∙32+12∙16=400;
Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например, относительная молекулярная масса воды Mr(H2О) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
где ω(Х) — массовая доля элемента Х; Ar(X) — относительная атомная масса элемента Х; n — число атомов элемента Х в молекуле вещества; Мr — относительная молекулярная масса вещества.
Что отражает молекулярная формула
На первых этапах изучения органической химии очень важно проследить вместе с учащимися, как развивалась наука, накапливался экспериментальный материал, на смену одним теориям приходили другие, и хотя бы немного представить личности ученых, создававших эти теории. Поэтому, введение в органическую химию мы, по мере возможности, построили в исторической последовательности, начиная с накопления данных о составе органических веществ. Конечно, при этом решается основная цель данного занятия – научить школьников решать задачи на определение состава органических соединений по данным элементного анализа, ввести понятия простейшей (брутто) и молекулярной формул, повторить закон Авогадро.
Кстати, на примере биографии Лавуазье 
Спросите учащихся, как убедиться в том, что в состав органических веществ входит углерод. Они должны вспомнить опыты, показанные на предыдущем занятии. При горении древесины обязательно остаются угольки. Если подержать над пламенем газовой горелки, спиртовки или свечи холодное стекло, то оно закоптится. На нем останутся мелкие частицы угля.
При сгорании органических веществ в избытке воздуха или чистого кислорода сажа не образуется, а получается углекислый газ CO2 и вода Н2O.
| Обязательно обсудите проблему неполного сгорания. При обычном горении из углерода образуется не только углекислый газ. Поэтому вещество необходимо сжигать в токе кислорода. Часто еще специально к анализируемому веществу добавляют катализатор, обеспечивающий полноту окисления. Если в состав анализируемого вещества входит еще и азот, то в числе продуктов сгорания будет газ азот, если сера – сернистый газ и.т.п… |
Современные методы элементного анализа органических соединений основаны на принципах, разработанных А.Лавуазье. Вещество сжигают в токе кислорода. Продукты сгорания последовательно пропускают через сосуды с веществами, поглощающими из газовой смеси сначала пары воды, а затем углекислый газ. Очень полезно предложить учащимся обсудить, какие вещества можно использовать для поглощения углекислого газа, а какие – для поглощения воды, и в каком порядке необходимо проводить это поглощение. Сосуды взвешивают до и после проведения опыта. Разность их масс как раз и составляет массу поглощенного вещества.
По уравнению горения CxHy + (x+y/4)O2 = xCO2 + y/2H2O можно рассчитать соотношение x:y и, следовательно, состав. Желательно, чтобы уравнение горения углеводорода в общем виде учащиеся составили сами.
| Пример 1. При сжигании углеводорода образовалось 88 мг оксида углерода (IV) и 72 мг воды. Определите соотношение атомов элементов в молекуле. Решение: Прежде всего, определим количества образовавшихся веществ. Количество углекислого газа составляет: n CO2 = 88 : 44 = 2 ммоль, nH2O = 72: 18 = 4 ммоль. |
Результаты элементного анализа обычно представляют в виде массовых процентов содержания атомов элемента в веществе.
| Пример 2. Рассчитайте, каково процентное содержание атомов элементов в метане. (75% углерода и 25% водорода) Пример 3. Определить состав бутана (бутан используют как горючее в газовых баллонах), если известно, что бутан состоит только из водорода и углерода, а при сжигании порции этого вещества в избытке кислорода было получено 44,8 мл углекислого газа и 45 мг воды. Решение: Пусть в состав молекулы бутана входит x атомов углерода и y атомов водорода. При горении этого вещества образуется х моль CO2 и y/2 моль воды. |
По результатам решения примера 3 формулу бутана можно записать как С2H5.
При решении этой задачи удобно ввести понятия простейшей и молекулярной формул. Формулу, определяемую по данным элементного анализа, называют простейшей. Необходимо подчеркнуть, что простейшая формула не показывает, сколько всего атомов каждого элемента содержится в молекуле. Состав молекулы отражает молекулярная формула. Число атомов в молекулярной формуле кратно числу атомов в простейшей формуле. Другими словами, молекулярную формулу бутана можно записать, как (С2H5.)n. Чтобы узнать n и найти состав молекулы бутана, в условиях Примера 3 не хватает данных.
Найти молекулярную формулу вещества можно, если определить его молярную массу, пользуясь законом итальянского химика Амедео Авогадро. Школьники обычно приходят в восторг, услышав полное имя этого ученого Лоренцо Романо Амедео Карло Авогадро ди Кваренья э ди Черрето (1776-1856).  ] ] |
Можно упомянуть, что такое длинное имя свидетельствует о знатности рода.
Очень часто учащиеся, на вопрос, что же сделал Авогадро, отвечают, что он определил молярный объем газа, вычислил постоянную Авогадро и т.п. На самом деле Авогадро выдвинул гипотезу о том, что равные объемы газообразных веществ при одинаковом давлении и температуре содержат одно и то же число частиц (молекул).
Кстати, полезно упомянуть, что Авогадро сформулировал закон в 1811 г, но его гипотезу не признавали в ученой среде почти 50 лет, отверг ее слишком авторитетный в то время Берцелиус. Только во второй половине девятнадцатого века, уже после смерти Авогадро, появились понятия грамм-молекула (моль), молярный объем (22,4 л при н.у.) и число Авогадро.
Взвешивая газ, определяют его плотность (во сколько один газ тяжелее другого, например воздуха или водорода) рассчитывают плотность газа при нормальных условиях. А зная, что молярный объем газа при н.у. равен 22,4 л/моль, вычисляют его молярную массу.
| Пример 4. Плотность бутана по водороду равна 29. Какова молекулярная формула бутана, если его простейшая формула С2H5 Решение: Зная плотность бутана по водороду, находим его молярную массу, равную 58 г/моль. |
Для определения молярной массы веществ, которые не существуют в парах (к таким соединениям относится, например, сахар), применяют методы, основанные, например, на изучении свойств их растворов. А в последние десятилетия ученые для определения молярных масс используют специальные физические методы (масс-спектрометрию и др.).
| Пример 5 При сожжении в избытке кислорода 0,15 г глюкозы образуются только два вещества: 1,12 л (н.у.) CO2 и 0,9 мл H2O. Определите молекулярную формулы глюкозы, если известно, что ее молярная масса равна 180 г/моль. |
Задачи для решения на семинаре:
1. Определите простейшую формулу вещества, содержащего 14,28% водорода и 85,72 % углерода. Определите его молекулярную формулу, если плотность его паров равна 2,5 г/л (н.у.).
Ответ – СН2
2. Определите простейшую формулу вещества, если при сгорании 7,2 г его получили 22 г углекислого газа и 10,8 г воды. Достаточно ли данных, чтобы определить молекулярную формулу этого вещества?
Ответ – С5Н12
3.Сожгли 4,8 г органического вещества, при этом образовалось 3,36 л (н.у.) углекислого газа и 5,4 мл (н.у.) воды. Плотность паров вещества по водороду равна 16. Определите его молекулярную формулу. Есть ли в задаче лишние данные?
Ответ: CH4O
4. Сгорело 9 г вещества и образовалось 8,96 л (н.у.) углекислого газа, 12,6 г воды и 2,8 г 4. азота. Определите простейшую и молекулярную формулы.
Ответ: С2H7N
А также можно использовать задачи из рекомендуемых пособий и домашнее задание для 10 классов СУНЦ МГУ «Задачи на определение состава органических веществ» 
Расчетным задачам на определение состава необходимо уделять время в течение нескольких последующих семинаров.
Для проверки навыка быстро решать подобные задачи, можно дать самостоятельную работу, подобную следующей:
Состав органических соединений


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору