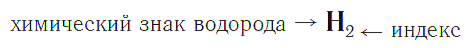Что отражает химическая формула
Урок 5. Химическая формула
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
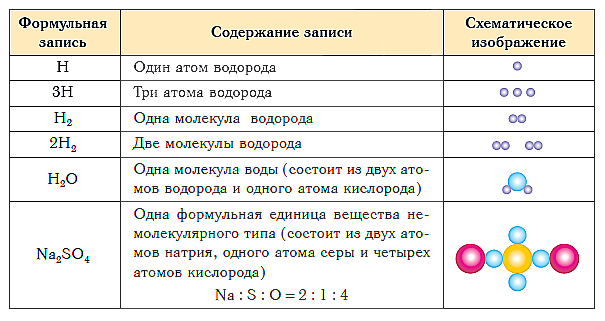
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Что отражает химическая формула
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
| ЗАДАНИЕ. Обозначить, используя символы химических элементов а) три молекулы азота б) семь молекул сульфида железа в) четыре атома серы г) два атома кальция д) семь молекул воды е) четыре молекулы кислорода ж) две молекулы сернистой кислотыОТВЕТ: а) три молекулы азота — 3N2 б) семь молекул сульфида железа — 7FeS в) четыре атома серы — S4 г) два атома кальция — Ca2 д) семь молекул воды — 7H2O е) четыре молекулы кислорода — 4O2 ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4. |
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Химические формулы веществ
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Таблица 1: Информация, которую дает химический знак
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака |
(произношение)
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Таблица 3: Информация, которую дает химический знак
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Исключение составляют:
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
1 моль (6,02·10 23 молекул) СаСО3 содержит 1 моль ионов Са 2+ и 1 моль ионов СО3 2- ;
1 моль (100г) карбоната кальция содержит 40г ионов Са 2+ и 60г ионов СО3 2-
Графические формулы
Для составления графической (структурной) формулы вещества необходимо:
Примеры графических формул:
Химическая формула – определение, виды и примеры
Определение химической формулы
Химическая формула представляет собой обозначение, используемое учеными, чтобы показать количество и тип атомов, присутствующих в молекула, используя атомарные символы и числовые индексы. Химическая формула представляет собой простое письменное представление существующей трехмерной молекулы. Химическая формула описывает вещество, вплоть до точных атомов, из которых оно состоит. Существует три основных типа химической формулы: эмпирическая формула, молекулярная формула и структурная формула.
Каждая из этих химических формул предоставляет немного различную информацию о составе вещества и подсказывает его трехмерную форму и то, как оно будет взаимодействовать с другими молекулами, атомами и ионами. В химической формуле буквы представляют атомный символ каждого атома. Нижний индекс (ниже) представляет номер каждого атома, в то время как верхний индекс (выше) представляет заряд на данном атоме. Коэффициент перед химической формулой представляет столько единиц молекулы. Каждый из различных типов химической формулы читается немного по-разному.
Типы химической формулы
Эмпирическая формула
Эмпирическая химическая формула представляет относительное число атомов каждого элемента в соединении. Некоторые соединения, такие как вода, имеют одинаковую эмпирическую и молекулярную формулу, потому что они малы и имеют одинаковое соотношение атомов в молекулах и число атомов в молекуле. Эмпирическая и молекулярная формула для воды выглядит следующим образом:
Эмпирическая формула определяется весом каждого атома в молекуле. Поэтому для немного большей молекулы, такой как перекись водорода, эмпирическая формула показывает только соотношение атомов. В этом случае:
Тем не менее, эта эмпирическая химическая формула показывает только базовую основу молекулы. В действительности две молекулы HO: собираются вместе, образуя молекулу перекиси водорода.
Молекулярная формула
Молекулярная формула показывает фактическое количество атомов в каждой молекуле. Таким образом, для перекиси водорода молекулярная формула, таким образом:
H2O2
Как видите, это несколько сбивает с толку фактическую структуру перекиси водорода. В то время как эмпирическая химическая формула дает понять, что молекула имеет два атома кислорода, связанных вместе в середине, молекулярная формула не проясняет это вообще. Тем не менее, молекулярная формула часто используется для описания молекул просто потому, что это удобно, и большинство молекул можно найти после того, как их формула идентифицирована.
Структурная формула
Структурная формула молекулы – это химическая формула с более художественным уклоном. В этих химических формулах показаны фактические связи между молекулами. Это помогает читателю понять, как различные атомы связаны, и, следовательно, как молекула функционирует в пространстве. Есть много различных структурных химических формул для рассмотрения.
Самый простой, метод электронных точек, использует двоеточия и точки, чтобы показать связи между атомами. Каждое двоеточие представляет собой пару электронов, распределенных между атомами по обе стороны от толстой кишки. Эта формула более точно отражает фактическое расположение атомов в молекуле. В случае воды формула электронной точки будет выглядеть следующим образом:
Н: О: Н
Другая химическая формула, формула линии связи, также показывает связи между атомами. Вместо того, чтобы показывать каждый общий электрон, используется линия для обозначения электронной пары, общей для атомов. Вода в формуле линии связи выглядит следующим образом:
Ученые придумали гораздо более продвинутую формулу и представления молекул, включая трехмерные модели типа «шарик-палка», модели заполнения пространства и даже модели, которые учитывают электронную плотность моделируемых атомов. Эти передовые модели учитывают не только присутствующие атомы и их количество, но и углы, размеры и расстояния между атомами в молекуле. Модель воды в виде шарика и стержня ниже даже показывает полярность молекулы, поскольку большой атом кислорода имеет тенденцию притягивать большинство электронов.
Молекулярная масса из химической формулы
Одним из важных навыков, полученных из химической формулы, является расчет молекулярной массы. Молекулярная масса молекулы является суммой всех различных атомов внутри. Каждое вещество имеет определенную молекулярную массу, определяемую его конкретной структурой.
Чтобы определить молекулярную массу вещества, рассмотрим химическую формулу. Формула легко отображает каждый присутствующий атом. Обязательно умножьте на количество атомов каждой молекулы. Индексы на каждом атоме будут указывать, сколько их. Некоторые большие молекулы с несколькими похожими группами покажут группам что-то вроде примера ниже:
C (OH) 4
В этом случае существует четыре группы (ОН), а не 4 атома водорода. Убедитесь, что вы учитываете это при расчете молекулярной массы. Молекулярная масса может использоваться для идентификации веществ, правильного взвешивания веществ для экспериментов и выполнения ряда расчетов, связанных с энергией, участвующей в химических реакциях. Ученые часто используют химическую формулу в качестве хранилища большей части этой информации, без необходимости объяснять основную химию в каждой статье.