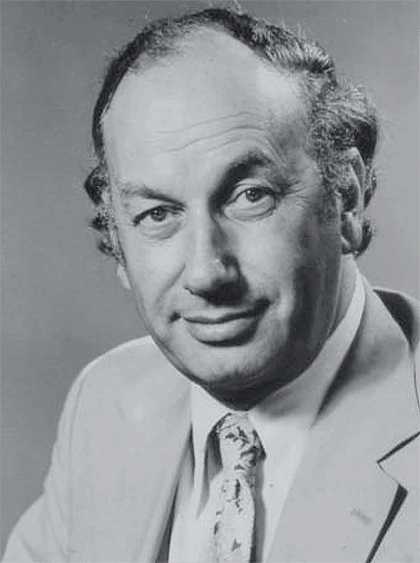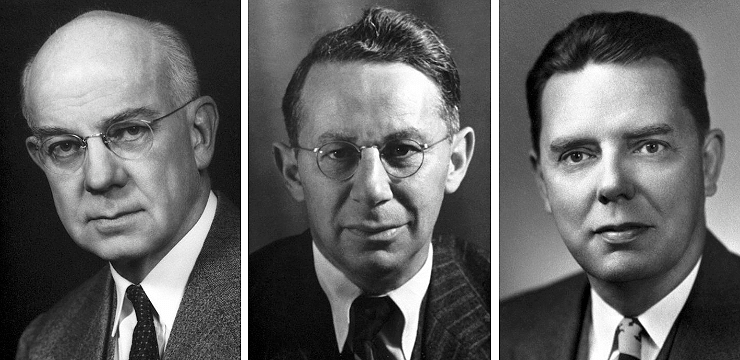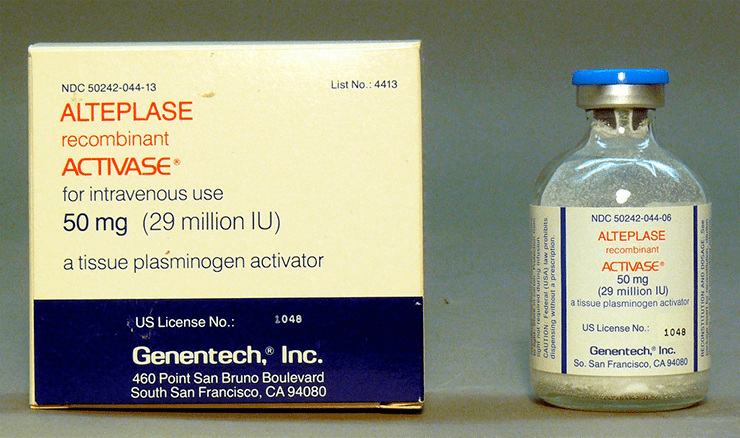Что относят к лекарственным средствам
Что относят к лекарственным средствам
Что такое лекарственные средства и чем они отличаются от других видов продукции?
В настоящее время на рынке существует большое количество разнообразных лекарственных средств, а также продуктов, которые на первый взгляд можно отнести к данной категории. В связи с этим возникают вопросы: что такое лекарственное средство? В чем разница между лекарственным средством и лекарственным препаратом? Как отличить лекарственное средство от медицинского изделия? От косметической продукции? От БАД? В данной статье будут рассмотрены некоторые ключевые отличия этих категорий товаров.
Согласно ФЗ №61 лекарственные средства (ЛС) — это вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты.
Важно то, что ЛС включает в себя и фармацевтические субстанции и лекарственные препараты. Однако только лекарственные препараты подлежат регистрации (подробнее здесь), а фармацевтические субстанции необходимо вносить в ГРЛС (подробнее здесь).
По определению того же ФЗ, лекарственные препараты (ЛП) — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности.
Из этого определения важно понимать, что ЛП на рынке представлены в виде готовых и удобных для приема лекарственных форм (таблетки, капсулы, растворы, мази и т.д.), которые обеспечивают необходимые биофармацевтические свойства препарата. Это является их ключевым отличием от фармацевтических субстанций, которые по сути являются сырьем.
Отличия ЛС от МИ прослеживаются при анализе определения МИ:
Согласно ст. ФЗ 323 Медицинскими изделиями являются любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, [….] функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека.
Например, пластырь, содержащий лекарственное средство, может рассматриваться как лекарственное средство и как медицинское изделие.
В случае, если мы рассматриваем пластырь как ЛП, мы подразумеваем, что назначение обеспечивается доставкой лекарственного вещества в организм человека, т.е. пластырь является лекарственной формой.
Если же говорить о пластыре как о МИ, то его назначение обеспечивается созданием защитного барьера, а лекарственное средство лишь поддерживает основное назначение.
По определению Таможенного регламента таможенного союза 009/2011 (ТР ТС 009/2011) парфюмерно-косметическая продукция — это вещество или смеси веществ, предназначенные для нанесения непосредственно на внешний покров человека […] или на зубы и слизистую оболочку полости рта с единственной или главной целью их очищения, изменения их внешнего вида, придания приятного запаха, и/или коррекции запаха тела, и/или защиты, и/или сохранения в хорошем состоянии, и/или ухода за ними. (подробнее о ПКП здесь).
Кроме того, еще одним отличием ЛС от ПКП является способ применения – ПКП предназначена исключительно для наружного нанесения на определенные части человеческого тела.
Соответственно ПКП не предназначена для целей лечения, профилактики, диагностики и других целей, характерных для назначения ЛС.
Биологически активные добавки к пище (БАД) – природные и (или) идентичные природным биологически активные вещества, а также пробиотические микроорганизмы, предназначенные для употребления одновременно с пищей или введения в состав пищевой продукции. (подробнее о БАД здесь).
БАДы являются специализированной пищевой продукцией, не предназначенной для целей диагностики и лечения каких-либо заболеваний. Как правило, БАДы применяют с целью обогащения рациона отдельными пищевыми и биологически активными веществами или их комплексами.
Стоит отметить, что несмотря на достаточно четкие критерии отнесения продукта к тому или иному виду, все равно существуют некоторые пограничные случаи. Это хорошо иллюстрирует, скажем, пример с пластырем, содержащим лекарственные вещества, который был описан выше.
Статья 4. Основные понятия, используемые в настоящем Федеральном законе
Статья 4. Основные понятия, используемые в настоящем Федеральном законе
Для целей настоящего Федерального закона используются следующие основные понятия:
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ пункт 2 статьи 4 настоящего Федерального закона изложен в новой редакции, вступающей в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 5.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 6.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 6.2, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ пункт 7 статьи 4 настоящего Федерального закона изложен в новой редакции, вступающей в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 7.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 7.2, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Информация об изменениях:
Информация об изменениях:
Информация об изменениях:
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 12.2, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 12.3, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ пункт 15 статьи 4 настоящего Федерального закона изложен в новой редакции, вступающей в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ в пункт 16 статьи 4 настоящего Федерального закона внесены изменения, вступающие в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ в пункт 17 статьи 4 настоящего Федерального закона внесены изменения, вступающие в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 17.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ в пункт 18 статьи 4 настоящего Федерального закона внесены изменения, вступающие в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ в пункт 19 статьи 4 настоящего Федерального закона внесены изменения, вступающие в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 19.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 19.2, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 21.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 26.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 6 декабря 2011 г. N 409-ФЗ в пункт 28 статьи 4 настоящего Федерального закона внесены изменения, вступающие в силу по истечении тридцати дней после дня официального опубликования названного Федерального закона
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ в пункт 30 статьи 4 настоящего Федерального закона внесены изменения, вступающие в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 31.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Информация об изменениях:
Информация об изменениях:
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ пункт 45 статьи 4 настоящего Федерального закона изложен в новой редакции, вступающей в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 50.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ пункт 52 статьи 4 настоящего Федерального закона изложен в новой редакции, вступающей в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 52.1, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 52.2, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
ГАРАНТ:
Положения пункта 53 статьи 4 (в редакции Федерального закона от 29 июля 2017 г. N 242-ФЗ) в части, касающейся формирования и выдачи рецептов на лекарственные препараты, содержащие назначение наркотических средств или психотропных веществ, в форме электронных документов, применяются с 1 января 2019 г.
Информация об изменениях:
Информация об изменениях:
Федеральным законом от 22 декабря 2014 г. N 429-ФЗ статья 4 настоящего Федерального закона дополнена пунктом 55, вступающим в силу с 1 июля 2015 г.
Информация об изменениях:
Что относят к лекарственным средствам
Статья 4. Основные понятия, используемые в настоящем Федеральном законе
Для целей настоящего Федерального закона используются следующие основные понятия:
(п. 2 в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(п. 5.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(в ред. Федерального закона от 13.07.2020 N 206-ФЗ)
(см. текст в предыдущей редакции)
(п. 6.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 6.2 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 7 в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(п. 7.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 7.2 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 10.1 введен Федеральным законом от 27.12.2019 N 475-ФЗ)
(п. 11 в ред. Федерального закона от 27.12.2019 N 475-ФЗ)
(см. текст в предыдущей редакции)
(п. 12 в ред. Федерального закона от 27.12.2019 N 475-ФЗ)
(см. текст в предыдущей редакции)
(п. 12.1 в ред. Федерального закона от 27.12.2019 N 475-ФЗ)
(см. текст в предыдущей редакции)
(п. 12.2 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 12.3 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 12.4 введен Федеральным законом от 27.12.2019 N 475-ФЗ)
(п. 15 в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(п. 17.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(п. 19.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 19.2 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 21.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 26.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
(в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(п. 31.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(в ред. Федерального закона от 03.04.2020 N 105-ФЗ)
(см. текст в предыдущей редакции)
(в ред. Федеральных законов от 25.11.2013 N 317-ФЗ, от 03.04.2020 N 105-ФЗ)
(см. текст в предыдущей редакции)
(в ред. Федерального закона от 03.04.2020 N 105-ФЗ)
(см. текст в предыдущей редакции)
(п. 45 в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(п. 50.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 52 в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
(п. 52.1 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 52.2 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(в ред. Федеральных законов от 29.07.2017 N 242-ФЗ, от 02.08.2019 N 297-ФЗ)
(см. текст в предыдущей редакции)
(в ред. Федерального закона от 02.08.2019 N 297-ФЗ)
(см. текст в предыдущей редакции)
(п. 55 введен Федеральным законом от 22.12.2014 N 429-ФЗ)
(п. 56 введен Федеральным законом от 28.12.2017 N 425-ФЗ)
Три поколения лекарств
Три поколения лекарств
В истории создания лекарств можно проследить последовательную эволюцию: от известных с древних времен экстрактов естественного происхождения до малых молекул и биологических препаратов, — к самому современному на сегодня классу передовой терапии. По мере появления новых видов терапии всё больше болезней получается вылечить или хотя бы помочь пациентам. А в основе этих успехов лежат многие годы фундаментальных исследований. Рисунок в полном размере.
Автор
Редакторы
Этой статьей мы открываем спецпроект, который расскажет о состоянии сегодняшней фармацевтической индустрии, о том, как она складывалась исторически и о наиболее замечательных лекарствах прошлого, настоящего и будущего. Прогресс в естественных науках увлек за собой и фармацевтику, создав базу для рационального «конструирования» лекарств, в том числе на основе биологических молекул. Многие знают про случайное открытие и последующее выделение из плесневого гриба пеницилла первого антибиотика, революционизировавшего лечение инфекционных болезней и способствовавшего спасению миллионов человеческих жизней во всем мире.
Однако далеко не всем известно о достижениях, позволивших синтезировать малые лекарственные молекулы, в промышленных масштабах получать продуцируемые живыми клетками биопрепараты, а также создавать лекарства самой прогрессивной на сегодняшний день передовой (advanced) терапии. Обо всем этом, а также об истории развития фарминдустрии, ее современном состоянии и будущих перспективах, и расскажет наша статья.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Введение
Народ жаждет лекарств.
Клавдий Гален
О лечении болезней и сохранении жизни задумывались еще врачеватели древнего мира, создававшие различные снадобья на основе природных экстрактов. В наше же время, когда полноценная жизнь и успех неразрывно ассоциируются со здоровьем, его поддержание, в том числе с помощью лекарств, становится особенно важным. Широкое внедрение современных медикаментов уже позволило значительно увеличить среднюю продолжительность жизни во всем мире, и прогнозируется, что в дальнейшем продолжительность жизни людей будет только расти. Такие достижения были бы невозможны без развития современной фармацевтической индустрии и постоянного совершенствования методов лекарственной терапии. При этом в истории открытия лекарств было несколько этапов, когда внедрение новых технологий создавало предпосылки для появления принципиально новых классов лекарственных средств. В частности, развитие методов органического синтеза запустило эру лекарств — малых молекул; появление биотехнологических методов привело к широкому внедрению биологических препаратов; а исследования в области клеточных и генных технологий на наших глазах создают наиболее продвинутый на сегодняшний день класс лекарств — передовую терапию (advanced therapy).
Малые молекулы, биопрепараты и передовая терапия — это три группы препаратов, отличающиеся по химической структуре, свойствам и терапевтическим возможностям, которые условно можно назвать поколениями, поскольку исторически они появлялись последовательно и открывали новые горизонты в лечении самых разных заболеваний.
Мы проследим за развитием фармацевтической отрасли от первых аптек до современных высокотехнологичных производств и расскажем о создании каждого из трех поколений лекарств, их преимуществах и недостатках, а также рассмотрим самые последние тренды современной лекарственной индустрии.
Status quo современной фармацевтики
История открытия лекарств начинается с древних времен, но формирование современной лекарственной индустрии не состоялось бы без научных прорывов, произошедших уже в новом времени.
Предпосылки появления лекарственной индустрии: от аптек до первых фармпроизводств
Использование натуральных экстрактов в медицинских целях насчитывает тысячи лет: известно, что еще Гиппократ и Гален упоминали об аптеках как о местах хранения и приготовления лечебных снадобий. Более поздние упоминания относятся к VIII–IX векам — периоду, когда аптеки появились на территории арабского Халифата, где лекари Востока активно изучали возможности использования лекарственных растений. Впоследствии появление аптек при монастырях, а затем и в городах средневековой Европы было связано с алхимией и поиском спасительного «средства от всех болезней». Хранимые в средневековых аптеках снадобья могли иметь странный состав — включать более сотни разных компонентов, и помимо экстрактов растений содержать, например, мясо гадюки, жир комаров или пепел волчьей шерсти. При создании таких «лекарств» аптекари средневековья опирались в большей степени на магию и суеверия, чем на научное знание [1], [2] и потому подобные препараты часто были бесполезны или даже вредны.
Однако примерно в конце XVII века опора на эмпирический опыт и наблюдение стала постепенно заменять теоретические изыскания в медицине, что привело к пониманию необходимости более рационального и научно обоснованного использования лекарств. В новое время такие возможности появились благодаря развитию химических методов, когда мощности аптечных лабораторий позволили выделять активные лекарственные вещества из растений, снижая связанные с примесями токсические эффекты, и открывая возможности более точного назначения и дозирования лекарств. Неудивительно, что некоторые аптечные лаборатории перерождались в фармацевтические производства, впервые появившиеся в Европе XIX века (рис. 1).
Рисунок 2. Реклама аспирина начала 20 века. Целебные свойства салициловой кислоты, получаемой из коры ивы, были известны еще со времен шумеров, а в XIX веке химик немецкой фармацевтической компании Bayer Феликс Хоффман синтезировал из нее одно из самых используемых ныне лекарств во всем мире — знаменитый аспирин.
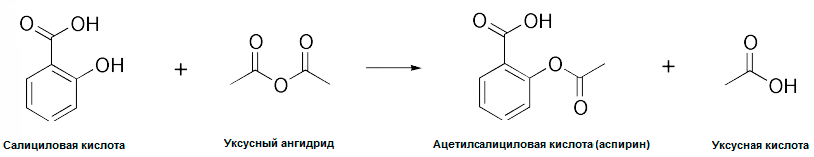
Мощным стимулом для развития фармацевтической индустрии также послужила промышленная революция XVIII–XIX веков. В частности, бурное развитие текстильной промышленности привело к совершенствованию методов очистки органических соединений из минеральных источников и методов органического синтеза, позволивших модифицировать структуру существующих соединений для придания им новых свойств и получения совершенно новых веществ. В то время ниша лекарственной индустрии фактически пустовала, и некоторые предприимчивые промышленники переходили с производства красителей на выпуск медикаментов. Известнейшим примером является немецкая компания Bayer, начинавшаяся как завод по производству красителей фуксина и анилина, а позже выпустившая на рынок, наверное, самое известное ныне лекарство — аспирин (рис. 2 и 3).
Рисунок 3. Синтез ацетилсалициловой кислоты (аспирина) из салициловой методом ацетилирования в присутствии фосфорной (или серной) кислоты в качестве катализатора (на рисунке не показана).
Современное состояние
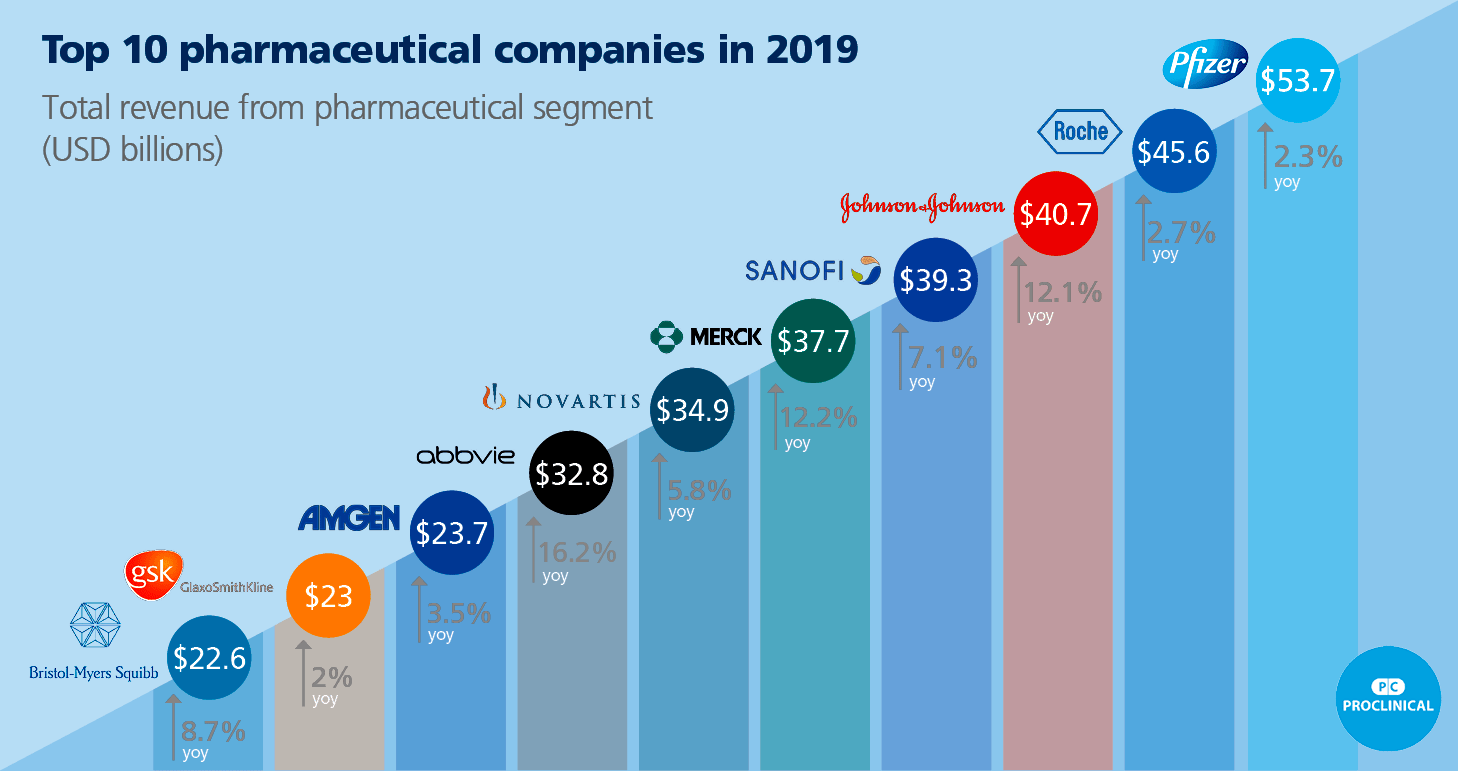
Рисунок 4. Топ-10 крупнейших фармацевтических компаний мира. Цифры в кружочках показывают годовой доход компаний в млрд долл. (на 2018 год), цифры со стрелочками под ними — годовой прирост.
Первое поколение: малые молекулы
В нашей статье мы не будем останавливаться на истории открытия антибактериальных препаратов, хотя она и весьма поучительна. Заинтересованному читателю рекомендуем ознакомиться со статьями «Антибиотики и антибиотикорезистентность: от древности до наших дней» [4] и «Победитель бактерий» [3], в которых этот вопрос освещается более подробно.
Противовирусные средства
История успеха современной медицины в борьбе с вирусом гепатита С прекрасно описана в статье «Гепатит С: решенная проблема?» [6]. Здесь же мы остановимся в основном на вехах, значимых не только для разработки противовирусных лекарств, но и для создания малых молекул в целом.
Анти-HCV терапия: проблемы и решения
Вирус гепатита С (hepatitis C virus, HCV) — серьезная проблема мирового здравоохранения: он является основной причиной цирроза печени, и, по оценкам, им заражены более 170 миллионов человек во всем мире (около 3% населения Земли) [5], [8]. Изучение этого вируса началось с секвенирования генома одного из его штаммов в 1989 году, однако до разработки эффективной анти-HCV терапии было еще далеко.
«Чтение геномов» стало возможным благодаря бурному развитию молекулярной биологии XX века, апофеозом которого стала расшифровка полной информации человеческой ДНК в рамках проекта «Геном человека» [9], [10]. Это продвинуло и фармацевтику, ведь лекарственные мишени — это зачастую белки, закодированные в генах. Клонирование этих генов позволяет, например, экспрессировать их в культурах изолированных клеток и проверять на них действенность молекул-кандидатов в новые лекарства [11]. Сегодня подобные технологии являются частью подхода, названного драг-дизайном, или рациональным конструированием лекарств.
До эры драг-дизайна большинство лекарств было открыто, по сути, случайно, а точнее — благодаря эмпирическому опыту и наблюдению. Биологический механизм действия лекарства при этом зачастую оставался неясным. За подробностями приглашаем обратиться к статье «Драг-дизайн: как в современном мире создаются новые лекарства» [12].
Поначалу создание противовирусных лекарств было затруднено отсутствием адекватных моделей для изучения вируса in vitro: нужны были клеточные культуры, имитирующие взаимодействие вирус—хозяин, ведь только так можно проверить действенность потенциального лекарства. Первые подобные клеточные системы появились в 1950-х годах, однако пригодная для вируса гепатита С линия клеток гепатоцеллюлярной карциномы человека Huh-7 появилась лишь в 2001 году.
Однако одними клетками не обойтись: для эффективного изучения HCV и разработки противовирусной терапии необходимы и исследования на животных. Так вышло, что долгое время единственными доступными животными для изучения вируса были шимпанзе, однако они не очень подходят по финансовым и этическим соображениям. Первыми небольшими животными, на которых стало возможно изучение HCV in vivo, стали мыши с трансплантированными гепатоцитами человека (они также появились в 2001 году).
Последующее развитие генетических технологий позволило получить трансгенных мышей, подверженных заражению HCV, что позволило гораздо лучше изучить иммунные ответы и патологию заболевания. В настоящее время доклинические испытания противовирусной терапии включают тестирование на клетках и фармакокинетическое профилирование на животных [5].
Совокупность достижений
Разработка эффективных противовирусных препаратов стала плодом внедрения научных достижений в фарминдустрию, что придало новый импульс и шарм высоких технологий немного хаотичному до того процессу создания лекарств. В анти-HCV терапии это привело к смене парадигмы: стандарт медицинской помощи образца 2001–2011 годов (интерферон + рибавирин с невысокой эффективностью, зато массой побочных эффектов) сменился лечением препаратами, действующими непосредственно на вирус. Это стало возможным, в том числе, благодаря изучению цикла репликации НСV и роли в этом процессе вирусных ферментов. Ингибирование фермента NS5B одобренным в 2013 году софосбувиром позволило успешно лечить НСV практически в 100% случаев всего за 12 недель при незначительных побочных эффектах [14]. Это стало настоящей революцией, поскольку успешное лечение стало возможным практически для всех пациентов.
Малые молекулы против ВИЧ
Разумеется, мы не можем обойти вниманием вирус иммунодефицита человека (ВИЧ), открытие которого в 1980-х годах стало серьезным общественным вызовом, а угрожающее шествие вызываемого этим вирусом СПИДа привело к шквалу работ по созданию противовирусных препаратов, способных остановить эту смертельную болезнь. И именно здесь медицина столкнулась с принципиально новыми препятствиями.
В микробиологии давно известно явление лекарственной резистентности, однако для молодой противовирусной науки потеря эффективности первого препарата антиретровирусной терапии (АРВТ) зидовудина оказалось настоящим сюрпризом: ведь при скрининге он показал полное подавление цикла репродукции вируса.
Выявление случаев лекарственной устойчивости стимулировало дальнейшие исследования в области АРВТ, что в конечном итоге помогло выработать стратегии для создания и других противовирусных лекарств. Сегодня хорошо известно, что ввиду частых мутаций вирусов длительная терапия приводит к отбору наиболее устойчивых мутантов, становящихся доминирующими, что и приводит к лекарственной устойчивости. Как выяснилось, такая устойчивость при вирусных инфекциях появляется даже чаще, чем при бактериальных, что особенно важно при лечении таких хронических вирусных инфекций, как ВИЧ и HCV [5].
К сожалению, невозможно охватить всё и сразу в одной статье, и потому мы не сможем здесь дальше рассказывать о лечении СПИДа. Однако это досадное недоразумение отчасти возместят материалы «Связанные одной лентой» [14] и «СПИД: как ВИЧ разрушает нашу иммунную систему» [15].
Препараты для лечения сердечно-сосудистых заболеваний
Несмотря на то, что сердечно-сосудистые заболевания до сих пор остаются в топе основных причин смертности, с 1950-х годов в их лечении удалось добиться значительного прогресса благодаря появлению новых классов лекарств. Мы рассмотрим историю нескольких классов кардиопротекторов, появившихся в то время.
Ингибиторы карбоангидразы
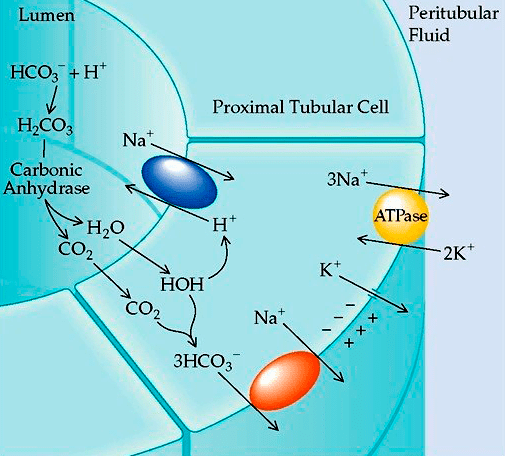
Рисунок 5. Роль карбоангидразы в поддержании кислотно-щелочного равновесия. В результате расщепления карбоангидразой угольной кислоты образуются протон (H + ) и гидрокарбонат-анион (HCO3 − ), при этом в норме первый обменивается на реабсорбирующийся в кровь ион натрия, который вместе с гидрокарбонат-анионом поддерживает буферную емкость крови, не давая ей закисляться. При нарушении этого процесса происходит повышенный выход ионов натрия вместе с мочой, вследствие чего буферная емкость крови нарушается и возникает ацидоз.
Как только сульфаниламиды стали использовать в качестве антибактериальных препаратов, выяснилось, что они могут вызывать ацидоз — закисление крови и других тканей организма, вызванное повышенным содержанием ионов водорода. Оказалось, что этот побочный эффект связан с ингибированием фермента карбоангидразы (рис. 5).
Позже обнаружилось, что при нарушении работы карбоангидразы, помимо ацидоза, происходит повышенный диурез (образование мочи), сопровождающий выведение ионов натрия из организма. Обнаружение диуретических свойств ингибиторов карбоангидразы привело к идее их использования в качестве мочегонных препаратов, первым из которых стал ацетозаламид (утвержден в 1952 году). Также оказалось, что диуретики можно использовать и для снижения артериального давления, поскольку повышенный диурез, выводя жидкость из организма, уменьшает и объем циркулирующей крови, снижая тем самым кровяное давление и нагрузку на сердце. Кроме того, снижение содержания ионов натрия способствует уменьшению сопротивления стенок сосудов, что также понижает артериальное давление. В 1957 году вышел первый антигипертензивный препарат, действие которого было основано на этих эффектах — диурил (хлортиазид), — а в последующие годы было синтезировано и много других классов малых молекул, используемых для понижения давления [16].
Бета-блокаторы, антагонисты кальция и статины
В 1960–1970-х годах разработали так называемые бета-блокаторы — вещества, способные связываться с β-адренорецепторами [17], [18] в клетках сердца и препятствовать связыванию с этими рецепторами нейромедиаторов адреналина и норадреналина, снижая частоту сокращений сердца и уменьшая тем самым нагрузку на него (видео 1) [19].
Видео 1. Бета-блокатор пропранолол, попадая сначала в кишечник в виде таблетки, растворяется и проникает в кровь, доходя до сердца. Пропранолол занимает активные сайты адренорецепторов в кардиомиоцитах, не давая связаться с ними нейромедиаторам норадреналину (норэпинефрину) и адреналину и снижая кардиостимуляцию.
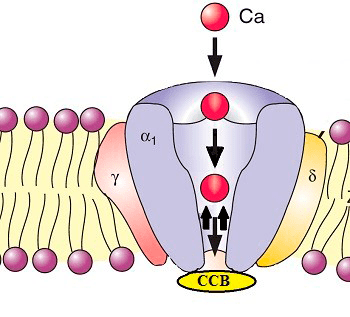
Рисунок 6. Блокаторы кальциевых каналов блокируют прохождение кальция в клетку. (Сокращение: CCB — calcium channel blockers.) Ионы кальция стимулируют многие клеточные процессы. При некоторых кардиозаболеваниях количество кальция (в клетках сердечной мышцы и гладкомышечных клетках кровеносных сосудов) чрезмерно повышается, приводя к излишней стимуляции и патологическим изменениям. CCB блокируют трансмембранные кальциевые каналы, ограничивая количество переносимых в клетки ионов. Это, с одной стороны, снижает частоту сердечных сокращений, снимая нагрузку на сердце, а с другой — заставляет кровеносные сосуды расслабляться и расширяться, улучшая кровоснабжение сердечной мышцы и снижая кровяное давление.
Другой класс созданных в 1960-х кардиопротекторов — блокаторы кальциевых каналов (или антагонисты кальция) — блокируют прохождение ионов кальция в клетку, предотвращая излишнюю стимуляцию сердечной мышцы (рис. 6).
О связи холестерина с сердечно-сосудистыми заболеваниями (ССЗ) догадывались еще в начале XX века, и у таких догадок были веские основания. Это и описанные еще в XIX веке знаменитым немецким патологоанатомом Рудольфом Вирховым желтоватые жировые отложения (содержащие холестерин) на стенках сосудов умерших от инфаркта, и опыты на кроликах русских физиологов Н.Н. Аничкова и С.С. Халатова, показавшие, что богатая холестерином пища может приводить к атеросклеротическому поражению сосудов.
Эти открытия обратили на себя внимание научного сообщества и вызвали интерес к поиску лекарств, способных снижать уровень холестерина. Более поздние исследования установили, что риск смертности связан главным образом с уровнем так называемого «плохого» холестерина — липопротеинов низкой плотности (ЛПНП), разносящих холестерин по сосудистой системе вместе с плазмой крови [20], [21]. Как было показано, холестерин ЛПНП составляет около 70% общего холестерина, и интересно, что менее распространенный холестерин липопротеинов высокой плотности (ЛПВП), напротив, обратно коррелирует со смертностью от ССЗ [22].
Началось всё с обнаружения японским микробиологом Акирой Эндо компактина — вещества плесневых грибов, способного к мощному ингибированию HMG-CoA редуктазы. Поиск эффективных и безопасных для человека ингибиторов этого фермента привел к выпуску первого статина — ловастатина — в 1987 году. Этот препарат получали путем ферментативного брожения плесневых грибов; впоследствии было выпущено множество полу- или полностью синтетических статинов [22].
Статины эффективны в снижении холестерина ЛПНП, и потому широко используются для профилактики сердечно-сосудистых заболеваний у людей, входящих в группу риска.
Ингибиторы ангиотензинпревращающего фермента (АПФ)
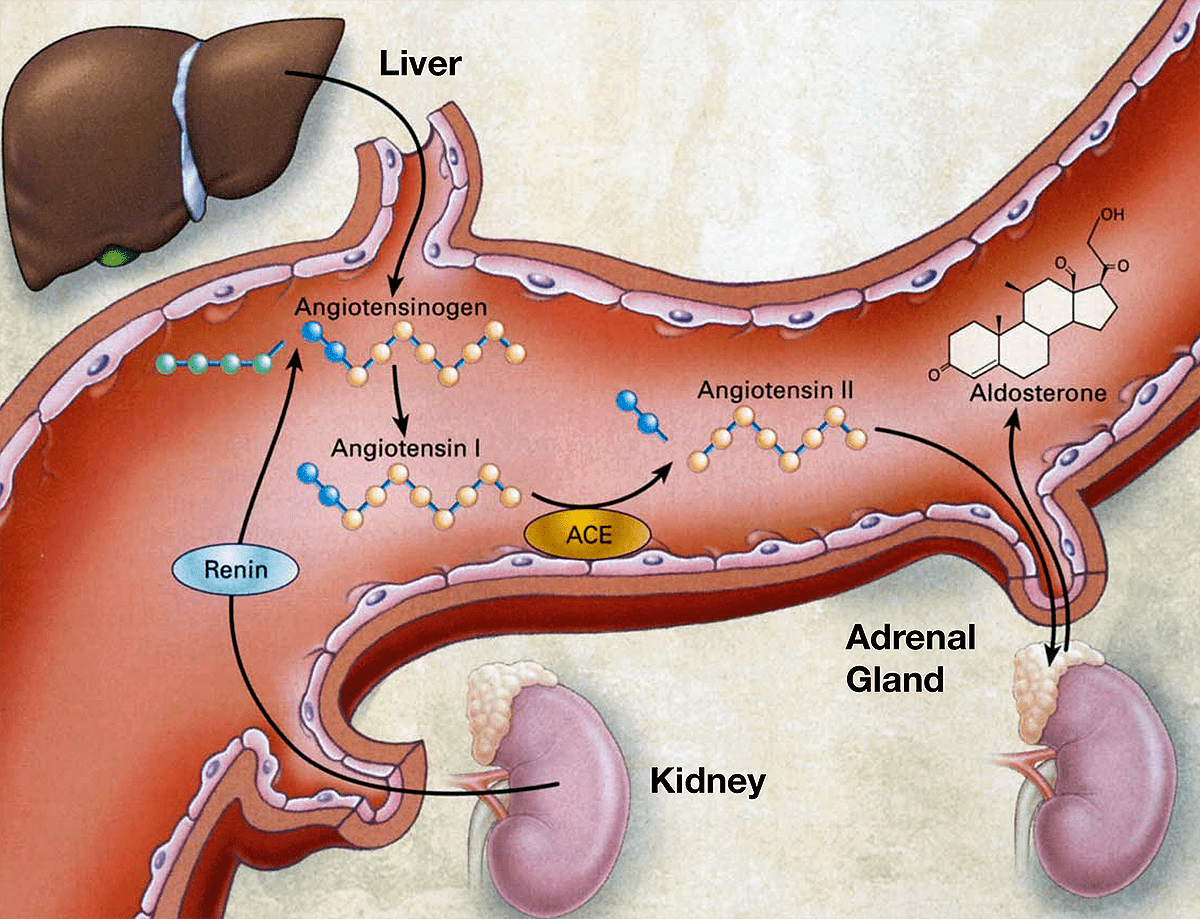
Ингибиторы АПФ снижают кровяное давление путем инактивации АПФ — одного из ключевых звеньев ренин-ангиотензиновой системы, регулирующей кровяное давление (рис. 7). История открытия этих веществ весьма примечательна. В середине 1960-х бразильский фармаколог Серхио Феррейра прибыл в Лондон для работы в лаборатории сэра Джона Вейна в Королевском хирургическом колледже Лондонского университета, позже прославившегося исследованиями механизма действия аспирина (рис. 8).
Рисунок 7. Ренин-ангиотензиновая система участвует в регуляции кровяного давления. Активная форма гормона ангиотензина — ангиотензин-II, повышающий кровяное давление за счет сужения кровеносных сосудов и повышения объема циркулирующей крови, — получается из гормона-предшественника под влиянием ангиотензинпревращающего фермента (АПФ, ACE). Именно на ингибирование АПФ направлено действие множества лекарств, снижающих кровяное давление. Помимо синтеза ангиотензина-II, гипертензивное действие АПФ вызвано разрушением брадикинина — пептида, расширяющего сосуды и снижающего кровяное давление.
Рисунок 8. Британский фармаколог Джон Вейн, получивший в 1982 году Нобелевскую премию за изучение механизма действия аспирина. Эти исследования помогли причислить аспирин к нестероидным противовоспалительным препаратам, о которых мы расскажем ниже.
В то время Вейн был глубоко погружен в исследования ключевых звеньев ренин-ангиотензиновой системы, и, как ему удалось выяснить, ключевой фермент этой системы — АПФ — находится в основном в тканях легких, а ангиотензин I (АТ-I) конвертируется в ангиотензин II (АТ-II) главным образом при прохождении крови через легочные артерии.
Бразилец Феррейра на тот момент исследовал возможность снижать кровяное давление с помощью компонентов змеиного яда. Он привез с собой в Лондон очищенный экстракт яда бразильской гадюки жарарака, который, как он выяснил, содержал стабилизатор брадикинина (пептида, расширяющего сосуды). Этому загадочному и потенциально перспективному веществу исследователь дал название брадикинин-потенциирующего фактора (bradykinin potentiating factor, BPF).
Работа Ферейры весьма заинтересовала фармаколога Вейна, и ядовитый экстракт был проверен на ингибирование АПФ — оказалось, что он снижает конверсию АТ-I в АТ-II в легких собак. Необходимо было выделить молекулу-ингибитор, и Джон Вейн, в то время научный консультант фармацевтической компании ER Squibb and Sons (ныне часть Bristol-Myers Squibb), убедил исследователей компании заняться этим вопросом. Оказалось, что самым мощным и стабильным соединением яда с антигипертензивным эффектом оказался пептид тепротид, обладавший свойствами ингибитора АПФ. Однако тепротид оказался токсичным, слишком кратко действовал, а вводить его можно было только путем инъекций. В 1970-х руководство компании свернуло проект, однако исследователи Дэвид Кушман и Мигель Ондетти продолжили заниматься этой темой в свободное от основной работы время.
13 марта 1974 года они обсуждали статью, описывающую свойства ингибиторов пищеварительного фермента карбоксипептидазы А (Carboxypeptidase A, CPB A). Этот фермент был изучен гораздо лучше, чем АПФ, но очень похож на него по структуре. Исследователи предположили, что главное отличие между ними в том, что у АПФ в активном сайте «больше места», предназначенного для размещения двух (а не одного, как у CPB A) отщепляемых аминокислотных остатков. Исходя из этой гипотезы, Кушман и Ондетти приступили к синтетической модификации ингибитора CPB A, чтобы адаптировать его под сайт АПФ. И вот, через полтора года, синтезировав и протестировав 60 различных веществ, они, наконец, получили первый препарат класса ингибиторов АПФ — каптоприл. Примечательно, что до начала такого рационального поиска они успели протестировать более 2000 веществ из коллекции Squib на возможность ингибирования АПФ, и не одно из этих соединений не показало удовлетворительной активности [23], [24].
По сути дела, это был один из первых успешных примеров рационального драг-дизайна, приведшего к рождению нового класса антигипертензивных лекарств, появление которых стало одним из крупных прорывов в профилактике сердечно-сосудистых заболеваний. Каптоприл запатентовали в 1976 году, а одобрили для медицинского использования в 1980-м. В течение нескольких лет после этого были разработаны и выпущены ингибиторы АПФ второго поколения: эналаприл и лизиноприл, обеспечивающие более длительное действие.
Противовоспалительные препараты
Многие заболевания сопровождаются воспалением, являющимся в здоровом организме нормальной ответной реакцией на повреждение тканей или попадание в организм чужеродных агентов. Тем не менее часто воспаление бывает весьма болезненным, и создание противовоспалительных препаратов, снимающих такие симптомы и облегчающих течение заболеваний, помогло улучшить самочувствие огромного количества людей. Рассмотрим создание двух альтернативных групп противовоспалительных средств: кортикостероидов и нестероидных противовоспалительных препаратов.
Аналоги стероидных гормонов — кортикостероиды
В 1930-х годах Эдвард Кендалл и Тадеуш Рейхштейн выделили гормоны коры надпочечников и описали их структуру, а в 1948–1949 годах при содействии заведующего ревматологическим отделением знаменитой клиники Мэйо доктора Филипа Хенча выделенное из коры надпочечников «вещество E» (впоследствии названное кортизоном) успешно протестировали на пациентах с ревматоидным артритом [25]. Выяснилось, что этот гормон обладает противовоспалительным действием, что позволило в 1950 году зарегистрировать его синтетический аналог как лекарство. Впоследствии синтезировали и внедрили множество синтетических аналогов природных гормонов — кортикостероидов, — и ныне они используются практически повсеместно, причем не только в виде отдельных лекарств, но и в составе различных комбинированных препаратов. «За открытия гормонов коры надпочечников, их структуры и биологических эффектов» Эдвард Кендалл, Тадеуш Рейхштейн и Филип Хенч в 1950 году получили Нобелевскую премию (рис. 9).
Рисунок 9. Лауреаты Нобелевской премии по физиологии или медицине 1950 года «За открытия гормонов коры надпочечников, их структуры и биологических эффектов» (слева направо): Эдвард Кендалл, Тадеуш Рейхштейн и Филип Хенч.
Нестероидные противовоспалительные препараты
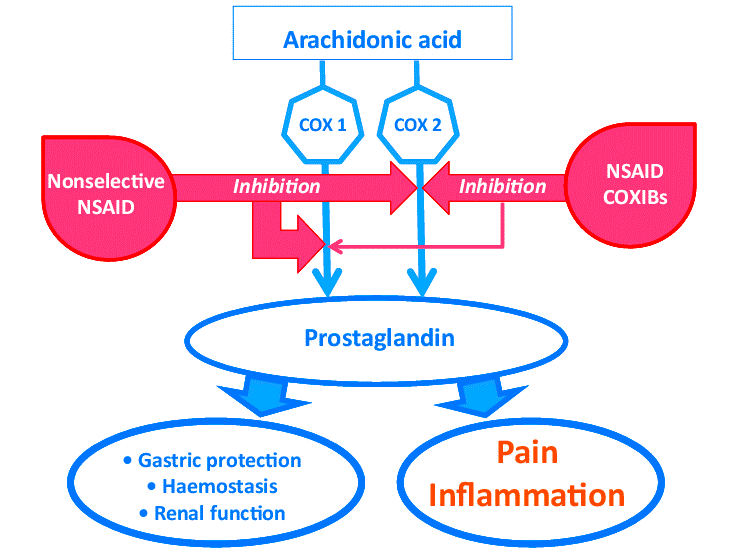
Альтернативой кортикостероидам является другой обширный класс органических соединений — нестероидные противовоспалительные препараты (НПВП). Своего рода пробным камнем для этих лекарств стал аспирин — препарат, ингибирующий циклооксигеназу с последующим снижением образования медиаторов воспаления — простагландинов. Аналогичным образом действуют и другие НПВП (рис. 10).
Рисунок 10. Механизм действия НПВП — ингибирование циклооксигеназы (ЦОГ). Такое ингибирование снижает образование простагландинов из арахидоновой кислоты под действием ЦОГ1 и ЦОГ2. Простагландины — медиаторы боли и воспаления; также играют роль в защите слизистой желудочно-кишечного тракта, работе почек и системы свертывания крови. Именно поэтому блокирование их синтеза может приводить к побочным эффектам (особенно со стороны ЖКТ). При этом считается, что ЦОГ1 и ЦОГ2 опосредуют образование разных типов простагландинов, имеющих разные эффекты, причем за боль и воспаление отвечает в большей степени ЦОГ2. Это легло в основу так называемой «ЦОГ2-гипотезы», позволившей создать коксибы — строго селективные НПВП, ингибирующие только ЦОГ2 (на рисунке справа). Согласно этой гипотезе препараты, ингибирующие только этот фермент, не будут иметь побочных эффектов со стороны ЖКТ. «ЦОГ2-гипотеза» позже подтвердилась, однако оказалось, что коксибы имеют опасные побочные явления со стороны сердечно-сосудистой системы [26], что даже привело к отзыву с рынка двух таких лекарств: рофекоксиба в 2004 г. и вальдекоксиба в 2005 г.
Первыми неаспириновыми НПВП стали индометацин (1964 г.) и ибупрофен (1969), а затем появилось множество препаратов этого класса, и сегодня это одни из наиболее часто используемых во всем мире лекарств.
Малые молекулы против рака
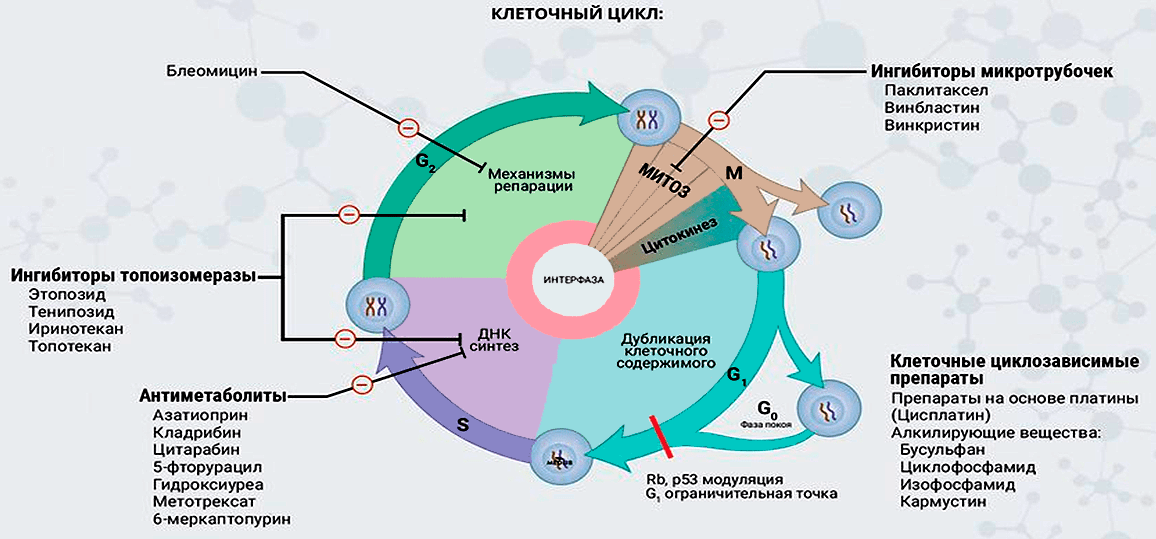
Первые успехи в создании малых молекул, способных подавлять рост опухолей, можно отнести к 1940-м годам, когда американские фармакологи Луис С. Гудман и Альфред Гилман в ходе химиотерапии опухолей впервые испытали алкилирующие агенты: аналоги токсичного иприта, применявшегося в ходе Первой мировой войны в качестве отравляющего газа. Эти испытания оказались небезуспешными, и в последующие годы был разработан целый ряд химиотерапевтических препаратов, способных уничтожать опухолевые клетки и тем самым останавливать или замедлять течение онкологических болезней. Механизм действия химиотерапевтических препаратов в большинстве случаев связан с определенным воздействием на клеточный цикл, в результате которого деление опухолевых клеток оказывается нарушенным, а сами клетки погибают (рис. 11).
Рисунок 11. Воздействие различных химиотерапевтических препаратов на разные стадии клеточного цикла
К сожалению, химиотерапевтические агенты уничтожают как раковые, так и нормальные клетки — особенно быстро делящиеся. Этим вызвано множество тяжелых побочных эффектов. Понимание ограниченности химиотерапевтических препаратов заставляло врачей и исследователей искать вещества, способные избирательно воздействовать на опухолевые клетки, не затрагивая нормальные. В 1990-х годах такие возможности появились благодаря развитию фундаментальной науки: методы молекулярной биологии помогли находить гены и белки, ответственные за образование отдельных видов опухолей, а развитие диагностики позволило выявлять такие случаи клинически.
В свою очередь, прогресс в химии позволил создавать обширные библиотеки синтетических веществ, а развитие структурной биологии дало возможность изучения онкологических мишеней и подбора молекул, бьющих точно в цель. Технический прогресс позволил проводить роботизированное тестирование до нескольких миллионов синтетических молекул за раз и отбирать наилучшим образом связывающиеся с мишенями и оказывающие наиболее интенсивный эффект молекулы-кандидаты [12]. Все это подготовило почву для таргетной терапии [27] и появления лекарств, прицельно бьющих по молекулярным онкологическим мишеням.
Такое тестирование называется высокопроизводительным скринингом и является мощным инструментом медицинской химии и вышеупомянутого драг-дизайна.
Первой таргетной малой молекулой стал ингибитор тирозинкиназ иматиниб («Гливек») — препарат, совершивший настоящую революцию в онкологии, позволив успешно лечить больных с хроническим миелолейкозом — диагнозом, бывшим до этого фактически смертельным приговором. При этой болезни мутантные тирозинкиназы BCR-ABL перманентно активируют молекулярные сигнальные пути, запускающие деление клеток, в результате выходящее из-под контроля и ведущее к злокачественному перерождению. Ингибирование «Гливеком» BCR-ABL помогает блокировать аномально активированные сигнальные каскады и притормозить патологическое деление, останавливая тем самым и развитие заболевания. «Гливек» был первым протеинкиназным ингибитором, специфически воздействующим на сигнальный путь, запускающий деление клеток, однако впоследствии было выпущено множество других препаратов этого класса.
Преимущества и недостатки малых молекул
К преимуществам малых молекул можно отнести их способность проникать в клетку, обусловливающую возможность воздействия не только на мишени, находящиеся на поверхности или вне клетки, но и на молекулы, задействованные в каскадах внутриклеточных биохимических реакций. Как показала практика, ингибирование передачи сигнала внутри клетки может быть крайне эффективным, а учитывая растущее понимание природы различных патологий и роли в их развитии внутриклеточных сигнальных путей, в ближайшем будущем можно ожидать появления новых малых молекул, нацеленных на молекулярных виновников таких болезней.
К другим плюсам можно отнести лекарственную форму, которая у большинства малых молекул предназначается для перорального приема. Считается, что при сходной эффективности пероральная терапия предпочтительней инъекционной, поскольку более комфортна и менее обременительна для пациентов, а значит, повышает приверженность лечению. Всемирная организация здравоохранения признала отсутствие приверженности одной из основных проблем при лечении хронических заболеваний и пришла к выводу, что ее улучшение может иметь иногда даже более благоприятное влияние на здоровье пациентов, чем повышение эффективности отдельных методов лечения.
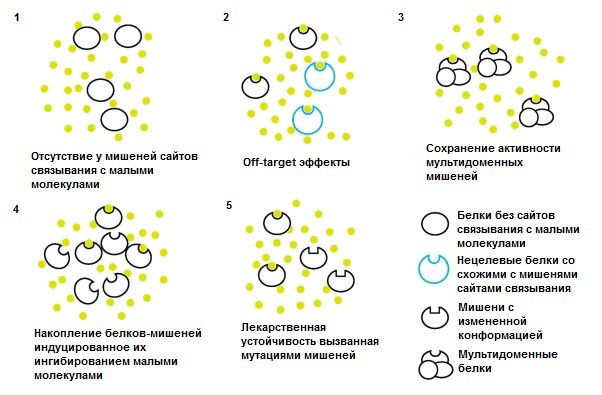
Безусловно, малые молекулы имеют и некоторые недостатки, иногда приводящие к снижению эффективности и ограничению возможности их применения. Одним из таких недостатков может быть их фармакокинетика, ведь малые молекулы метаболизируются ферментами печени и затем выводятся через почки. Это нагружает выделительную систему и может ограничивать применение малых молекул у пациентов с серьезными нарушениями функции этих органов [28]. Некоторые другие ограничения малых молекул обобщены на рисунке 12.
Рисунок 12. Ограничения малых молекул в качестве лекарств. 1. Мишени малых молекул — в основном ферменты и рецепторы, имеющие активные центры для связывания лекарств. При этом приблизительно у 75% белков человеческого протеома такие сайты вообще отсутствуют (например, у факторов транскрипции, скаффолд-белков и неферментативных белков), и потому они не могут «попасть под прицел» малых молекул. 2. Терапевтическая эффективность требует довольно высоких концентраций лекарств, что может вызывать побочные (off-target) эффекты из-за конкурентного связывания малых молекул с нецелевыми мишенями, имеющими сходные сайты связывания. 3. Малые молекулы обычно специфически связываются только с одним доменом мишени, в то время как у некоторых белков их несколько, и их «добавочная» активность может снижать эффективность действия лекарств. 4. Ингибирование малыми молекулами может вызывать компенсаторную избыточную экспрессию белков-мишеней и их накопление, что опять же приводит к снижению эффективности действия лекарств. 5. Мутации генов, кодирующих белки-мишени, могут вызывать конформационные изменения в сайтах связывания, и нарушение связывания лекарств (а это уже лекарственная устойчивость).
Второе поколение: биопрепараты
Биопрепараты — это лекарства, активная субстанция которых продуцируется живыми системами и затем выделяется из них, для чего используют различные биотехнологические методы. При этом биопрепараты гораздо сложнее малых молекул — не только по молекулярному строению, но и для характеристики. Поэтому их аналитический контроль требует привлечения различных физико-химических и биологических методов на всех стадиях производства. В целом это достаточно разнообразная группа лекарств — как правило, крупных молекул со сложной структурой (рис. 13).
Рисунок 13. Сравнение размера и молекулярных масс различных лекарств: аспирина, гормонов инсулина и эритропоэтина и моноклонального антитела
Среди них можно выделить пептидные гормоны, моноклональные антитела, факторы свертывания крови и ферменты. Эти препараты не могли бы появиться без многочисленных достижений молекулярной биологии XX века, таких как расшифровка генома человека и других видов [10], появление генной инженерии [29], развитие структурной биологии [30], открывшей возможность визуализации взаимодействий биомолекул и изучения механизмов действия различных лекарств. Все эти технологические прорывы революционизировали лекарственную индустрию в XX веке и способствовали увеличению доли биопрепаратов на рынке до сегодняшних 25%.
Гормоны
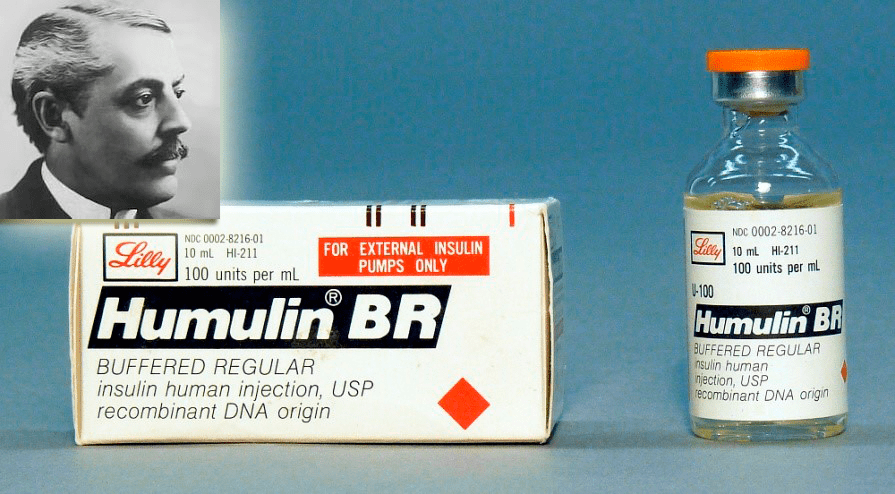
В 1970-х годах была разработана технология генной инженерии [31], позволившая помещать нужные генетические последовательности в клетки-продуценты, а затем культивировать последние с получением целевых белков — продуктов внедренных генов. Это дало возможность создавать генно-инженерные лекарства, и первой компанией, выпустившей на рынок подобный продукт, была Eli Lilly, в 1982 году запустившая продажи хумулина — человеческого инсулина, синтезированного в клетках E. сoli (рис. 14).
Рисунок 14. Хумулин — человеческий инсулин производства Eli Lilly. Слева вверху — полковник Элай Лилли, основавший Eli Lilly — одну из крупнейших фармацевтических фирм, названную в честь ее основателя. Eli Lilly первой наладила производство и выпуск инсулина животного происхождения (1923 г.), а затем в 1982 году — и первого человеческого (генно-инженерного инсулина).
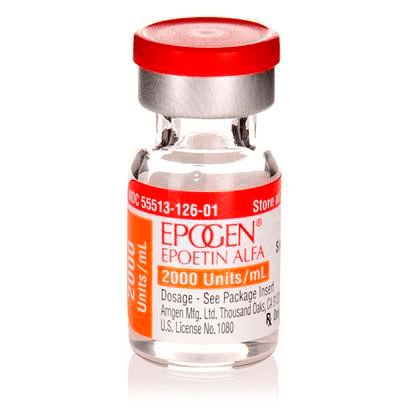
Рисунок 15. Человеческий рекомбинантный эритропоэтин производства Amgen. Создание этого препарата стало настоящим прорывом в лечении анемии, связанной с хронической почечной недостаточностью, позволив облегчить ее симптомы, снизив потребность пациентов в переливании крови и улучшив качество их жизни.
Три года спустя две группы исследователей, возглавляемых Фу-Куен Линем в Чикаго и Кеннетом Джейкобсом в Бостоне, независимо друг от друга смогли внедрить ген человеческого эритропоэтина в клетки яичника китайского хомячка (chinese hamster ovary, CHO) и синтезировать в них белок [32]. Это послужило основой для производства препарата человеческого эритропоэтина (утвержден FDA в 1989 году), ставшего одним из первых рекомбинантных препаратов, продуцируемых линиями клеток млекопитающих (рис. 15). Использование таких клеток в качестве систем экспрессии открыло возможности биотехнологического производства сложных белков, требующих неосуществимых в бактериальных клетках посттрансляционных модификаций.
Ферменты
Ферменты участвуют во множестве биохимических процессов в организме человека, и потому идея вводить их как лекарства для нормализации тех или иных патологических состояний более чем оправданна. Яркий пример реализации такой идеи — алтеплаза: лекарство, используемое в лечении сердечно-сосудистых заболеваний и представляющее собой фермент, участвующий в расщеплении тромбов (рис. 16). Этот препарат стал первым одобренным к использованию лекарством, полученным путем производства в клетках млекопитающих (FDA — в 1987 г.) [33], [34].
Рисунок 16. Алтеплаза. Препарат, разработанный первой биотехнологической фармкомпанией Genentech и представляющий собой фермент tPA (tissue plasminogen activator — тканевый активатор плазминогена), участвующий в лизисе тромбов.
Однако наиболее выдающихся успехов в лечении рекомбинантными ферментами удалось добиться при коррекции так называемых болезней накопления — состояний, обусловленных генетической нехваткой определенных лизосомальных ферментов. При таких болезнях биомолекулы, в норме расщепляемые ферментами лизосом, накапливаются в клетках, вызывая нарушения их работы и в конечном итоге — гибель. Лизосомные болезни накопления хоть и редки, но зачастую смертельны, и потому разработка в 1980-х годах лечения путем восполнения недостающего фермента (фермент-заместительной терапии) имела большое значение.
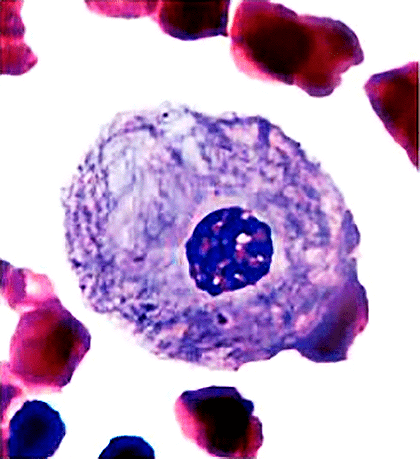
Рисунок 17. Клетка человека с болезнью Гоше. У людей с этой наследственной болезнью есть дефект в гене, кодирующем глюкоцереброзидазу — фермент, расщепляющий глюкозереброзид (нерастворимый липид, входящий в состав клеточных мембран). При болезни Гоше глюкоцереброзидаза не может функционировать правильно, и глюкоцереброзид накапливается в лизосомах макрофагов, где он в норме расщепляется. Макрофаги увеличиваются в размерах и на гистологических препаратах по видимой структуре становятся похожими на «мятую бумагу» (на рисунке).
В то время доктор Роско Брэди и его коллеги из Национального института здравоохранения США работали над тем, чтобы остановить или обратить вспять прогрессирование самой распространенной лизосомной болезни накопления — болезни Гоше, связанной с недостаточностью фермента глюкоцереброзидазы (рис. 17). Они вводили пациентам с болезнью недостающий фермент, выделенный из плаценты, и это приводило у последних к объективным улучшениям: повышению гемоглобина, количества тромбоцитов, увеличению плотности костной ткани и др. [35] (Здесь и ниже речь идет о лечении болезни Гоше I типа.)
Полученные результаты обнадеживали, однако внедрение подобного лечения казалось сомнительным, ведь промышленное производство лекарства из такого нетривиального материала, как человеческая плацента, было делом крайне непростым. Достаточно сказать, что для проведения клинических испытаний исследователям потребовалось собрать 22 000 плацент, которых хватило лишь на один годичный курс лечения одного пациента.
Тем не менее первый препарат для лечения болезни Гоше — аглюцераза, полученный из плаценты человека, — FDA одобрило к применению в 1991 году. Но этот препарат был экономически нерентабелен ввиду как ограниченности исходного сырья, так и стоимости его обработки. Ведь человеческая плацента может содержать различные патогены: от вирусов до иммуногенных форм плацентарных белков, и это требует дополнительных стадий деконтаминации, что само по себе увеличивает стоимость производства. А поскольку дополнительная очистка еще и снижает конечный выход ценного продукта, и без того немалые затраты возрастают еще больше [36].
Неудивительно, что вскоре дорогая и сложная в производстве аглюцераза была заменена более технологичным аналогом — рекомбинантной глюкоцереброзидазой (имиглюцеразой), одобренной для использования в 1994 г. Имиглюцеразу производят с использованием клеток CHO (яичников китайского хомячка; см. врезку). Она оказалась не менее клинически эффективна, чем ее плацентарная предшественница, однако может производиться в неограниченных количествах и свободна от патогенов [35].
Cytiva — производитель питательных сред и добавок HyClone для производства рекомбинантных белков в клетках СНО
Являясь одним из ведущих поставщиков продукции для выращивания клеток, Cytiva не перестает инвестировать в разработку новых видов продукции в целях предоставления новых, инновационных решений и услуг своим заказчикам, работающим в сфере биофармацевтической промышленности. Cytiva использует свой более чем 45-летний опыт в производстве высокоэффективной продукции для выращивания клеточных культур, чтобы дать возможность заказчикам сократить затраты и повысить производительность.
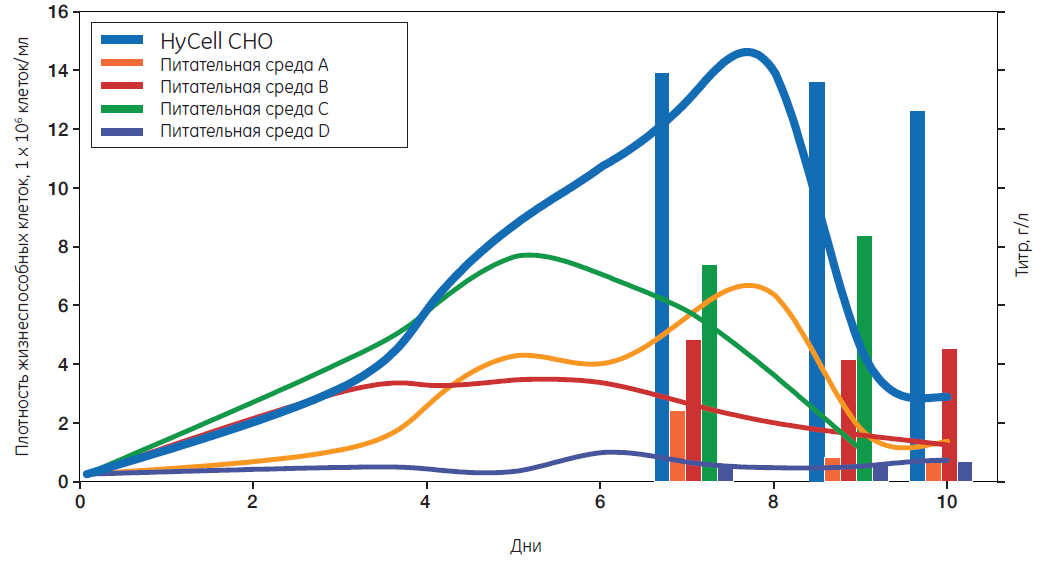
Питательная среда HyCell CHO компании Cytiva задает высокий стандарт производительности культивирования. HyCell CHO — универсальная питательная среда с известным химическим составом, не содержащая компонентов животного происхождения. Среда разработана с использованием проприетарного метода исследования метаболического пути в целях достижения устойчивой производительности и максимизации выхода в процессе получения рекомбинантных белков. Универсальность среды обеспечивает получение рекомбинантных белков, быстрое приспособление клеток, а также исключительные показатели роста, плотности клеток и производительности при выращивании широкого спектра клеточных клонов CHO. По требованию заказчика среда может поставляться в специальной упаковке, отвечающей его потребностям и используемым им биотехнологиям.
По результатам представленного исследования использование питательной среды HyCell CHO компании Cytiva привело к таким показателям выработки продукта, которые в пять и более раз превышают характеристики конкурентных сред.
Материал предоставлен партнёром — компанией Cytiva
В дальнейшем были разработаны и другие препараты фермент-заместительной терапии для лечения лизосомальных болезней накопления: болезни Фабри, болезни Помпе и др.
Факторы свертывания
Весьма полезным приложением заместительной терапии стало применение рекомбинантных факторов свертывания для лечения гемофилии. Это редкое генетическое заболевание, при котором из-за врожденной недостаточности факторов свертывания нормальная коагуляция крови [37] оказывается нарушенной, что проявляется кровотечениями и кровоизлияниями. По типу наследственно недостающего фактора свертывания различают две разновидности болезни:
Гены, кодирующие эти факторы, находятся в X-хромосоме, а потому гемофилия обычно поражает только мужчин (является так называемым Х-сцепленным заболеванием), в то время как женщины-носительницы, как правило, не болеют, но передают гены гемофилии по наследству. В настоящее время зафиксировано менее сотни случаев заболевания гемофилией женщин во всем мире, в то время как приблизительно у одного из пяти тысяч мужчин выявляются симптомы гемофилии А, а у одного из двадцати тысяч — симптомы гемофилии В.
До появления заместительной терапии у таких больных наблюдались различные степени проявления заболевания, начиная от кровоизлияний в суставах и мягких тканях и заканчивая опасными для жизни эпизодами кровотечений. Устранение таких событий и является целью фактор-заместительной терапии, поскольку они приводят к значительному снижению качества жизни и сокращению ее продолжительности.
В 1950–60-х годах основным способом лечения гемофилии были инъекции цельной плазмы крови, которая содержала лишь незначительное количество требуемых факторов, и потому необходимы были длительные инфузии больших объемов плазмы, проводимые, как правило, в стационаре. Однако уже во второй половине 1960-х разработали технологию криопреципитации, заключающуюся в осаждении белков крови при определенном режиме оттаивания свежезамороженной плазмы, что дало возможность концентрировать факторы свертывания в значительно меньшем объеме. А к концу 1960-х появились уже и способы очистки и отделения от плазмы факторов VIII и IX, что позволило более точно дозировать эти белки и лечиться уже на дому.
К сожалению, за подобное улучшение терапии пришлось заплатить непомерную цену: тысячи образцов донорской плазмы объединялись для создания одной партии концентрата, и препараты факторов крови оказались контаминированы смертельно опасными вирусами. Это привело к тому, что в 1980-х около 60–70% пациентов с тяжелой гемофилией успели инфицироваться ВИЧ, и почти 100% заразились гепатитом С. Эта ужасная трагедия запустила исследования по деконтаминации препаратов плазмы, инактивация болезнетворных агентов в которых производилась в то время сухим жаром, обработкой детергентами и пастеризацией. Однако из-за постоянной обеспокоенности возможным заражением неизвестными инфекциями возрос интерес к разработке более безопасного производства заместительных факторов, и очень скоро в авангарде создания таких препаратов встала уже известная технология экспрессии рекомбинантных белков.
И если в 1980-х были клонированы гены факторов VIII и IX, то уже в 1990-х были одобрены к применению первые препараты рекомбинантных аналогов этих факторов свертывания [38]. Внедрение этой технологии позволило создавать более эффективные препараты фактор-заместительной терапии. Одним из заметных направлений для этого стало создание рекомбинантных белков с более длительным периодом полувыведения, что достигается различными модификациями молекул факторов свертывания, например пегилированием или «сшиванием» с FC-фрагментами антител. Было показано, что продукты с более длительным периодом полувыведения снижают частоту внутривенных инъекций, способствуя лучшей приверженности, улучшают результаты лечения и потенциально позволяют пациентам вести более активный образ жизни [39].
Моноклональные антитела
В 1970-х создали фундаментальную технологию, легшую в основу принципиально новых препаратов — моноклональных антител. Речь идет о технологии гибридóм, за разработку которой ее создатели Жорж Кёлер и Сезар Мильштейн были удостоены Нобелевской премии в 1984 году [40], [41].
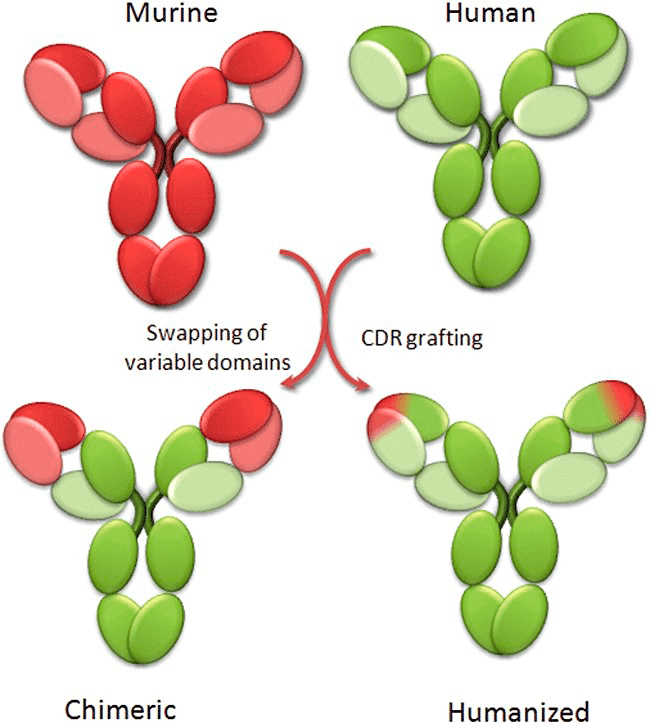
Рисунок 18. Принцип гуманизации антител
Первый препарат, созданный при помощи гибридомной технологии, — Orthoclone OKT3 (муромонаб-CD3) — вышел на рынок в 1986 году и предназначался для снижения иммунного отторжения при трансплантации органов. Это было мышиное антитело и, хотя его появление знаменовало начало принципиально нового направления в создании лекарств, широкое внедрение подобных средств было под большим вопросом ввиду сильной токсичности чужеродных для человеческого организма антител. Однако благодаря генной инженерии стала возможной оптимизация: изменение кодирующих последовательностей в сторону «очеловечивания» (гуманизации) и внедрение такого измененного генетического материала в клетки продуцентов для последующей экспрессии химерных белков. Такие белки состоят из «каркаса» человеческих антител (составляющего ≈70%) и вариабельных фрагментов мышиных антител (≈30%), отвечающих за связывание с эпитопами антигена (рис. 18).
Первое химерное терапевтическое моноклональное антитело, появившееся на рынке, — абциксимаб (препарат ReoPro, утвержденный FDA в 1994 году) — предназначалось для предотвращения агрегации тромбоцитов во время оперативных вмешательств. Создание химерных антител было шагом к меньшей токсичности, однако их достаточно крупные мышиные фрагменты все же вызывали иммунную реакцию. Поэтому следующим улучшением стало создание гуманизированных антител — с процентным соотношением человеческой и мышиной частей уже 95:5, а затем и полностью человеческих (на 100%) антител.
О гуманизации антител, а также в целом о технологии их создания подробно рассказывает статья спецпроекта про терапевтические антитела: «Биотехнология антител» [42].
Из первых гуманизированных антител можно отметить вышедший в 1998 году «Герцептин» (трастузумаб) — препарат, прицельно воздействующий на сверхсинтезированный рецептор HER2 с целью лечить агрессивную и смертоносную форму рака молочной железы [27]. Повышенная экспрессия гена этого рецептора приводит к увеличению количества соответствующих рецепторов на клетках, их димеризации и активации сигнальных каскадов, посылающих в ядро клетки сигналы к делению. В таких условиях деление клеток «теряет тормоза», приводя к росту опухоли. Одобрение в 1998 году «Герцептина» открыло новую страницу в лечении HER2-положительного рака молочной железы, позволив значительно улучшить выживаемость пациентов как на ранних, так и на поздних стадиях заболевания.
Антитела и иммуноонкология
Совсем недавно прорывным направлением стало использование антител в качестве ингибиторов контрольных точек иммунного ответа, позволившее поставить мощные силы иммунитета на борьбу с опухолевыми клетками. Эта область иммунотерапии опухолей дала надежду на жизнь многим больным, считавшимся безнадежными [44], а ученые Джеймс П. Эллисон и Тасуку Хондзё, сделавшие решающий вклад в разработку этой технологии, в 2018 году были удостоены Нобелевской премии: «Иммунитет без тормозов: Нобелевская премия за антитела против рака» [45].
Контрольные точки иммунного ответа — это рецепторы на клетках иммунной системы, а также на некоторых нормальных клетках организма, взаимодействие с которыми помогает иммунным клеткам «узнавать своих», и, избирательно уничтожая чужеродные агенты, не затрагивать при этом клетки и ткани собственного организма (рис. 19).
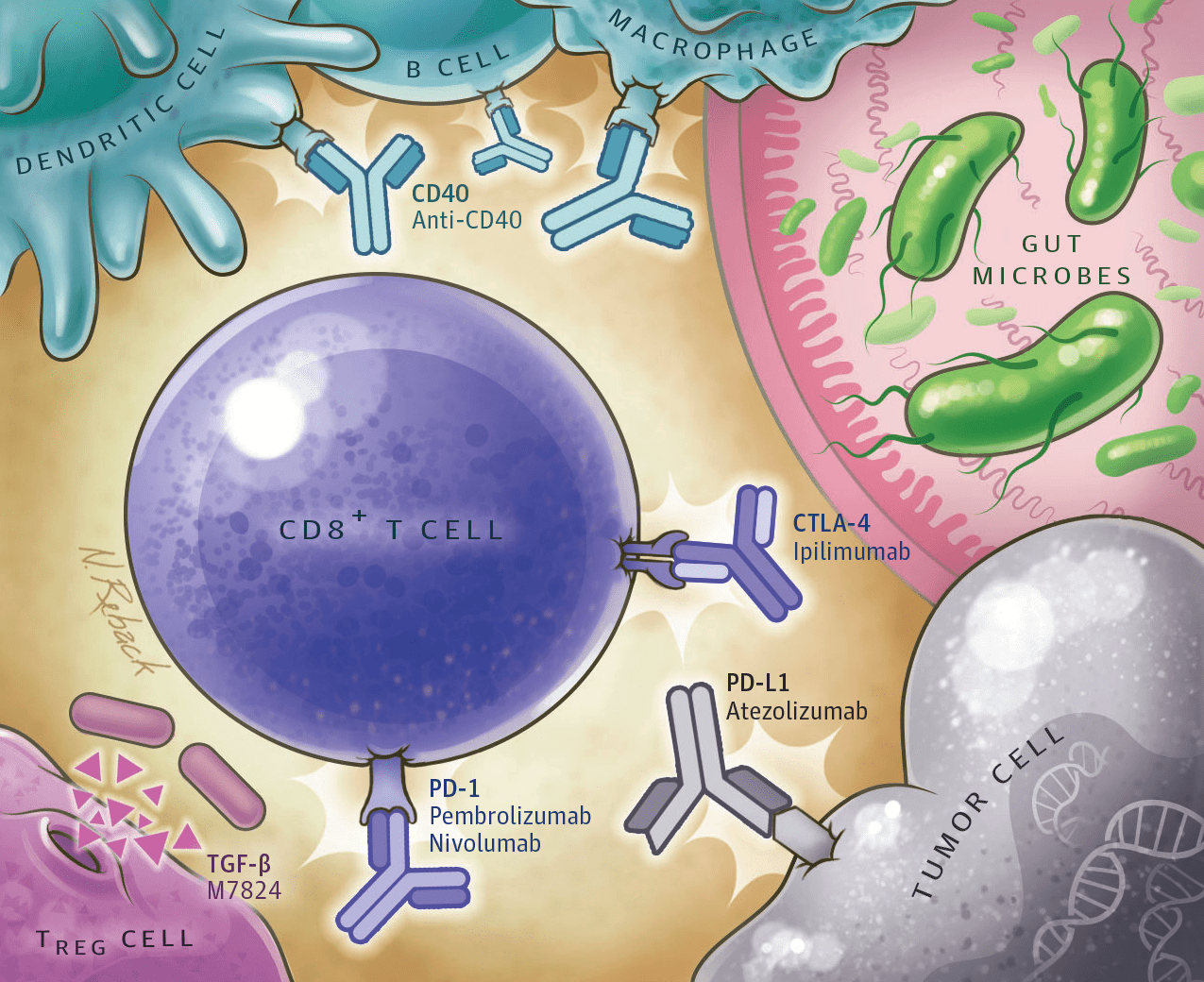
Рисунок 19. Ингибиторы контрольных точек иммунного ответа связываются с рецепторами на поверхности клеток. С 2011 года было одобрено к использованию несколько препаратов моноклональных антител, способных связываться с контрольными точками иммунного ответа. На рисунке изображено связывание пембролизумаба, ниволумаба и ипилимумаба с рецепторами PD-1 и CTLA-4 на иммунной T-клетке, а также связывание атезолизумаба с рецептором PD-L1 на опухолевой клетке. Как можно видеть, антитела — ингибиторы иммунологических чекпойнтов, — блокируя рецепторы на иммунных и опухолевых клетках, предотвращают их связывание между собой, что предупреждает уклонение опухолевых клеток от иммунного надзора и приводит тем самым к их уничтожению.
Все бы ничего, но оказалось, что опухоли научились подавлять противоопухолевый иммунитет и даже ставить клетки иммунной системы себе на службу [46]. Ингибиторы иммунологических чекпойнтов — моноклональные антитела, специфически связывающиеся с контрольными точками, — блокируют ошибочное «узнавание» иммунными клетками опухолевых как своих. Это позволяет иммунной системе «очнуться» и вновь начать идентифицировать раковые клетки как чужаков, нацеливая на них всю свою недюжинную мощь и уничтожая таких «диверсантов».
Еще в 2013 году журнал Science назвал иммунотерапию рака прорывом года, потому что ее внедрение революционизировало онкотерапию, позволив продлевать жизнь пациентов на поздних стадиях рака, не реагирующих ни на какое другое лечение.
Возможности биологических препаратов
Использование биопрепаратов значительно расширило возможности терапии различных заболеваний, и произошло это во многом благодаря иному механизму нацеливания на мишень. Мишенями лекарств часто являются различные белки, но при этом возможность связывания с ними малых молекул лимитирована наличием сайтов связывания — «карманов» на поверхности белковых молекул (рис. 12 и видео 1).
Так вот, эти карманы присутствуют не на всех мишенях — поверхность многих белков слишком «ровная», чтобы стать сайтом связывания низкомолекулярного лекарства. В свою очередь, многие белковые молекулы были эволюционно созданы для связывания с другими белками, например, для передачи сигнала (взаимодействие рецептора с сигнальным белком) или нейтрализации чужеродного агента (связывание антитела с антигеном).
Такой контакт между белками обусловлен высокоспецифичными белок-белковыми взаимодействиями [47], и создание лекарств, связывающихся со своей мишенью таким образом, позволило значительно расширить диапазон возможной регуляции клеточных процессов. Это привело к созданию прорывных методов терапии ряда заболеваний, лечение которых до этого было недостаточно эффективным или симптоматическим. Именно с биопрепаратов (моноклональных антител) началась таргетная терапия [27], позволившая более специфично нацеливаться на молекулярные мишени, достигая тем самым более надежного и индивидуального эффекта при болезнях разнообразного патогенеза. В частности, использование антител для точечного воздействия на белки, участвующие в воспалении, позволило лучше контролировать наследственные аутоиммунные заболевания [48–50], а применение таргетных антител в онкологии — успешно лечить некоторые виды рака, для которых традиционная химиотерапия была малоэффективна [27].
При этом ввиду высокой специфичности таргетная терапия имеет еще и меньше побочных эффектов, связанных с off-target-взаимодействиями, что, правда, отнюдь не делает ее совсем безопасной. Побочные эффекты антител зачастую связаны с иммуногенностью и могут быть весьма существенными, но при этом они гетерогенны, во многом индивидуальны и могут сильно различаться даже в разных партиях одного препарата [7].
Помимо иммуногенности, к существенным недостаткам биопрепаратов можно отнести инъекционный способ введения и отсутствие возможности перорального приема, затрудняющее их использование, что может снизить приверженность пациентов к лечению. Кроме того, в силу большого размера биопрепараты проникают в ткани хуже, чем малые молекулы. Так, во многих случаях мишени в мозге пока недоступны для биопрепаратов из-за гематоэнцефалического барьера.
Третье поколение: advanced therapies
Передовая терапия — это самые последние и инновационные методы лечения, основанные на достижениях клеточных и генных технологий. Эти препараты отличаются от малых молекул и биопрепаратов тем, что представляют собой живые клетки или генетические конструкции, что дает возможность модулировать процессы в организме на следующем уровне сложности и с небывалой ранее точностью. Такой нетривиальный принцип действия открывает возможности излечивать болезни, перед которыми традиционная фармацевтика оказалась бессильна. Впрочем, обо всем по порядку.
Генная терапия
Принцип генной терапии состоит во введении генетического материала в клетки с целью лечения определенного заболевания. Для этого чаще всего используют вирусы, некоторые из которых в природе способны внедрять свои гены в геном зараженных животных, что впервые было обнаружено еще в начале XX века.
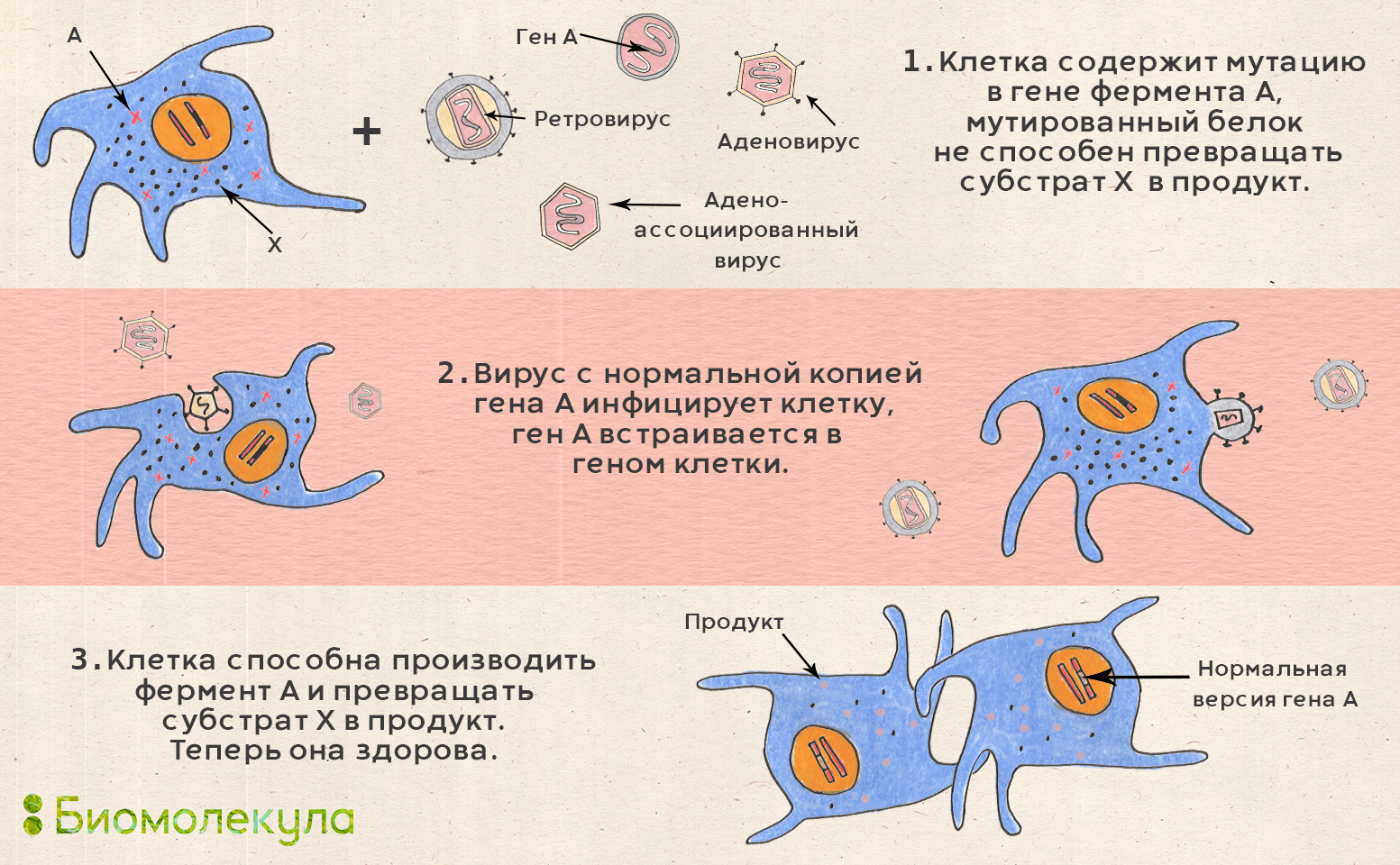
В генной терапии такая инвазия используется для исправления дефектов в генах, которые могут быть врожденными (генеративные мутации при наследственных заболеваниях) или приобретенными (соматические мутации в опухолевых клетках). Специально модифицированный вирус (называемый вектором) вводится в организм больного человека, где он, проникая в клетки, внедряет «здоровый» генетический материал, приводя к экспрессии нормальных белков, тем самым уменьшая или сводя на нет последствия болезни (рис. 20).
Рисунок 20. Схема действия геннотерапевтических препаратов. Вектор на основе аденоассоциированных вирусов (AAV) используется тогда, когда нужно ввести копию гена прямо в организм человека (стратегия in vivo). AAV практически не встраивается в геном, что снижает риск генотоксичности, но при делении клеток его уровень постепенно снижается. Векторы на основе лентивирусов встраиваются в геном, поэтому их используют для ex vivo подхода: у пациента выделяют его клетки, встраивают нужный ген и размножают модифицированные клетки, после чего вводят их обратно пациенту.
Рисунок 21. Ашанти Де Сильва — первый человек, излечившийся благодаря генной терапии. Ашанти унаследовала дефект в гене фермента аденозиндезаминазы (АДА) — одну из тех мутаций, которые приводят к тяжелому комбинированному иммунодефициту (severe combined immunodeficiency, SCID): заболеванию, при котором иммунитет практически отсутствует. Люди, болеющие SCID, часто погибают от незначительных инфекций, к которым организм здорового человека полностью устойчив. Для лечения Ашанти ген, кодирующий полноценный АДА, внедряли с вирусом в предварительно отобранные у пациентки лимфоциты, где он мог экспрессироваться, приводя к биосинтезу нормального фермента. Затем лимфоциты культивировали и около миллиона таких генетически измененных клеток вводили в кровоток Ашанти. Это привело к победе над заболеванием, в противном случае ставшем бы для девочки смертельным.
Первый широко известный случай применения генной терапии относится к 1990-м годам, когда четырехлетней Ашанти Де Сильва, страдающей наследственным заболеванием — тяжелым комбинированным иммунодефицитом, — вводили предварительно генетически модифицированные лимфоциты, что в конечном счете помогло победить болезнь (рис. 21).
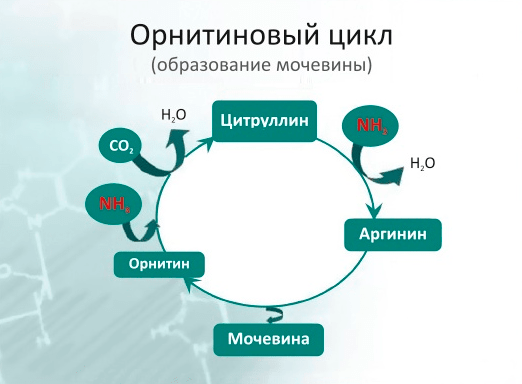
Успешное лечение Ашанти вызвало большой энтузиазм в отношении генной терапии, однако совсем скоро несколько трагических случаев обернулись разочарованиями и привели к страху и недоверию к такому лечению. Широкую огласку получила печально известная история Джесси Гелсингера — молодого пациента, которого лечили от редкого наследственного заболевания: дефицита орнитинтранскарбамилазы (ornithine transcarbamoylase, OTC). При этом заболевании оказывается нарушенным орнитиновый цикл, из-за чего содержащие аммиак продукты распада, в норме преобразующиеся в мочевину, начинают накапливаться в организме (рис. 22).
Рисунок 22. Орнитиновый цикл (или цикл образования мочевины). Фермент орнитинтранскарбамилаза (на рисунке не показана) подключается на стадии преобразования орнитина в цитруллин. При наследственном дефиците этого фермента орнитиновый цикл нарушается, и содержащие аммиак продукты распада не перерабатываются в мочевину, накапливаясь в организме.
Мы все очень хорошо понимали, что произошло и что это за трагедия. Это привело к тому, что вся область генной терапии была потеряна, по крайней мере, на десятилетие. Даже сам термин “генная терапия” стал своего рода черной меткой. Никто не хотел упоминать его в своих грантах. Никто не хотел говорить: “Я — генный терапевт” или “Я работаю над генной терапией”.
Дженифер Дудна
(одна из разработчиков технологии редактирования генов CRISPR-Cas9) высказывается об этом инциденте.
Такие провалы отбросили порочащую тень на всю область генной терапии, однако, несмотря ни на что, частные и государственные организации продолжали инвестировать в исследования, направленные на излечения болезней путем изменения или замены дефектных генов. Это постепенно привело к «восстановлению в правах» генной терапии и одобрению новых препаратов этого класса. Ранние неудачи были связаны, главным образом, с использованием не самых безопасных вирусов, и потому усилия исследователей сосредоточились на создании более эффективных и безопасных векторов для доставки генетического материала (рис. 20).
В 2012 году геннотерапевтический препарат Glybera, использующийся для лечения дефицита липопротеинлипазы, первым получил одобрение регулирующих органов для продаж в Европе. К сожалению, это лекарство — безусловный прорыв генной терапии — в то же время стало коммерческим провалом: самый дорогой препарат в мире стоимостью более 1 млн евро на пациента был снят с рынка ввиду нерентабельности. Производитель успел продать всего лишь одну дозу этого сверхдорогого лекарства. Тем не менее область генной терапии продолжила развитие, и за последние несколько лет регулирующими органами США и Европы утвержден целый ряд новых геннотерапевтических препаратов, причем ожидается, что этот тренд будет только усиливаться. По прогнозам FDA, уже к 2025 году будет утверждаться до 20 новых препаратов генной и клеточной терапий ежегодно [51].
Лечение амавроза Лебера (in vivo)
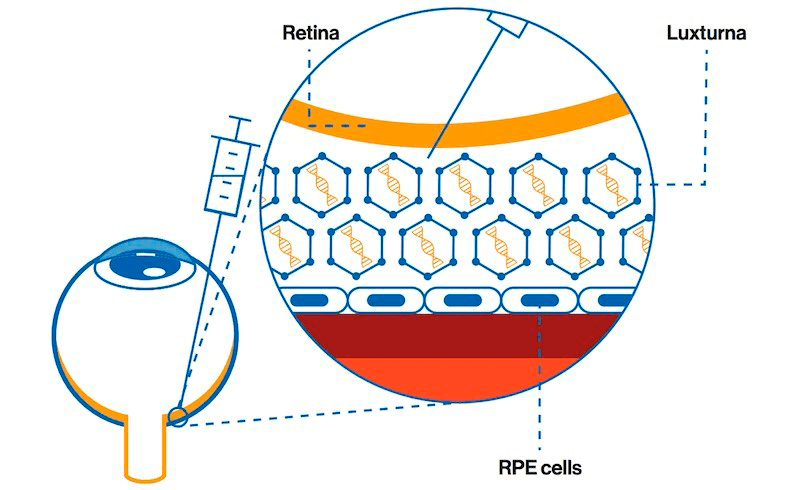
В декабре 2017 года FDA одобрила Luxturna — геннотерапевтический препарат для лечения редкого наследственного заболевания глаз, известного как амавроз Лебера. При такой болезни в сетчатке глаза пациентов отмирают светочувствительные клетки, что приводит к тяжелому нарушению зрения или слепоте. Разработанная Spark Therapeutics терапия in vivo заключается в инъекции в глаз раствора, содержащего AAV с нормальной копией гена RPE65, наследственная недостаточность белкового продукта которого и приводит к отмиранию клеток сетчатки и последующей прогрессирующей слепоте (рис. 23).
Рисунок 23. AAV-вектор, несущий нормальную копию гена RPE65 (шестиугольники), вводят прямо под сетчатку (обозначена желтым цветом) в непосредственной близости от клеток пигментного эпителия (синие овалы). Вектор обеспечивает проникновение здорового гена в эти клетки, что восстанавливает их нормальное функционирование.
Клинические исследования показали, что всего одна доза такого препарата приводит к улучшению зрения пациентов. Это является безусловным достижением, ведь иного лечения амавроза Лебера сегодня не существует. При этом ввиду анатомических особенностей глазного яблока именно генная терапия in vivo наиболее перспективна.
«Глаз — это закрытая система; векторы, однажды введенные в глазное яблоко, имеют очень небольшую возможность просочиться наружу, и в результате, оставаясь в глазу, они могут разгрузить свой ДНК-груз в максимальное количество клеток-мишеней, — говорит Бернар Жилли, генеральный директор парижской компании Gensight Biologics, специализирующейся на разработке генной терапии при нейродегенеративных заболеваниях сетчатки. — Кроме того, нейроны не регенерируют, и как только нейрон начинает экспрессию целевого гена, он может делать это в течение очень длительного периода времени».
А поскольку внутри глаза иммунная система не может обнаруживать и реагировать на используемую для доставки вирусную ДНК, то и иммуногенность, приводящая к нежелательным побочным явлениям, у такой терапии значительно ниже.
В 2018 году Luxturna одобрили в Европе, а сейчас уже и несколько других препаратов для генетической терапии различных наследственных заболеваний глаз находятся на разных стадиях разработки.
Лечение β-талассемии (ex vivo)
Бета-талассемия — это наследственное заболевание, вызванное дефектным геном β-цепи гемоглобина, что приводит к снижению образования этого важного белка, необходимого для доставки кислорода по всему организму. Снижение транспорта кислорода приводит к слабости, усталости, плохому росту и аномалиям развития костной ткани (у детей), а также другим серьезным осложнениям. Больные с тяжелым течением болезни нуждаются в частых переливаниях крови и зависят от подобных процедур в течение всей своей жизни. Недавно у таких пациентов появилась надежда: американская биотехнологическая компания bluebird bio получила одобрение на использование в Европе генной терапии Zynteglo, ставшей настоящим прорывом в лечении β-талассемии.
Zynteglo — это терапия ex vivo, включающая извлечение из пациентов стволовых клеток костного мозга, их последующую генетическую модификацию для экспрессии здорового гемоглобина и повторное введение пациентам. Проведение такой процедуры позволяет освободить больных от необходимости переливаний крови в течение многих лет после лечения — потрясающая новость для этих людей. В скором времени ожидается, что Zynteglo будет одобрена и для использования в США.
CRISPR-Cas9 — будущее генной терапии?
CRISPR-Cas9 — это изначально сформированный эволюцией «бактериальный иммунитет» — система защиты микроорганизмов, предохраняющая их от последствий заражения бактериофагами. Принцип этой защиты базируется на накоплении в бактериальном геноме характерных для бактериофагов ДНК-последовательностей, расположенных в виде вставок (спейсеров), разделенных повторяющимися нуклеотидными последовательностями. Эти вставки затем считываются с бактериального генома в виде комплементарной РНК, связанной с эндонуклеазой Cas9. Когда бактериофаг попадает в бактериальную клетку, комплекс Cas9 и РНК, считанной с CRISPR (собственно CRISPR-Cas9), связывается с его ДНК в областях, комплементарных спейсерам. «Узнавая» такие регионы, Cas9 вырезает их, приводя к гибели вируса.
Видео 2. О технологии редактирования генома с помощью CRISPR-Cas9 рассказывает биохимик Дженифер Дудна — одна из ведущих исследователей, участвовавших в разработке этой технологии
Исследователи научились использовать этот созданный природой хитроумный механизм для исключительно точного редактирования генома — вплоть до возможности вырезания всего одного нуклеотида. Очевидно, что такой метод имеет бóльшую разрешающую способность, чем ныне используемые методы генной терапии, и его внедрение в медицинскую практику несет в себе огромный терапевтический потенциал в лечении самых разных заболеваний: наследственных, онкологических, вирусных (в частности СПИДа) и др. Вместе с тем, в нынешнем виде эти методы недостаточно точны и надежны, чтобы их можно было безопасно использовать у людей.
Клеточная терапия
Клеточную терапию также иногда называют клеточной трансплантологией, что, в общем, довольно точно отражает суть этого подхода, заключающегося в лечении методом внедрения (или трансплантации) определенных клеток в организм человека [11]. В целом под определение клеточной терапии подпадает даже рутинное переливание крови, а значит и историю этого направления можно отсчитывать еще с XVII века, когда французский врач Жан-Батист Дени впервые осуществил переливание крови от овцы к человеку.
Позже было проведено первое переливание крови от человека к человеку, однако до открытия в первой декаде XX века Карлом Ландштейнером [55] различий в группах крови [56] такие процедуры были весьма рискованны. Успешные переливания спасали жизни, но при переливании несовместимой крови возникали сильные иммунные реакции, которые могли приводить даже к смерти людей. Открытия Ландштейнера помогли сделать переливания крови более безопасными, а трансплантация клеток со временем стала инструментом, использующимся в терапии далеко не только при кровопотерях.
В 1940–1950-х годах американские исследователи Эгон Лоренц и Чарльз Конгдон в опытах на мышах показали, что трансплантация клеток от здоровых животных способна защитить облученных мышей от летальных доз радиации. Такая защита была обусловлена восстановлением за счет пересадки клеток самого уязвимого для радиации органа — костного мозга, хотя идея о том, что восстановление происходило именно за счет клеток, была на тот момент столь смелой, что многие предпочитали объяснять произошедшее стимуляцией деления перенесенными при трансплантации гормонами. Позже было показано, что новые популяции клеток восстановленного костного мозга мышей содержали те же хромосомные маркеры, что и перенесенные донорские клетки, а значит и происходили именно от них. Стало понятно, что клеточная трансплантология имеет огромный регенеративный потенциал, и это понимание привело к всплеску исследований в этой области в 1950-х годах [57]. Такие исследования заложили основу для создания самой распространенной ныне клеточной терапии: трансплантации кроветворных стволовых клеток костного мозга — процедуры, помогающей регенерировать клетки крови онкобольных после перенесенной химиотерапии и лечить некоторые редкие заболевания и лейкемии [11].
Современный этап
Со времени первых смелых экспериментов клеточная терапия непрерывно развивалась, изменившись почти до неузнаваемости и превратившись в технологию, на базе которой создаются самые продвинутые методы лекарственной терапии. Особо перспективным направлением стала технология CAR-T — инновационный метод, объединивший одновременно клеточную, генную и иммунотерапию (рис. 24). Эту технологию начали разрабатывать в конце 1980-х годов, когда доктор Стивен Розенберг (рис. 25) и его коллеги из Национального института рака в США выделяли иммунные клетки прямо из опухолей онкологических больных и после культивирования повторно вводили их тем же пациентам. Такие клетки называют опухолевыми инфильтрующими лимфоцитами (tumor infiltrating lymphocytes, TILs); они способны к специфичному уничтожению раковых клеток.
CAR-T расшифровывают как Chimeric Antigen Receptor T-cell — T-клетки с химерными рецепторами антигена [58], [59].
Опухолевые бласты — это злокачественные клетки крови, присутствующие у больных при некоторых лейкемиях и лимфомах. Терапия CAR-T клетками пока используется для лечения именно таких типов онкозаболеваний, и, хотя ведутся исследования с целью создания CAR-T-терапии и для других злокачественных заболеваний, на этом поле пока еще не были достигнуты значительные успехи.
Рисунок 25. Стивен Розенберг — хирург и исследователь рака, стоявший у истоков создания клеточной CAR-T-терапии
В то время опыты Розенберга были не всегда удачными, да и технология трудоемкой, однако при лечении меланомы, на которой сосредоточились усилия исследователей, удавалось достичь стойкой ремиссии в 10–25% случаев [60].
Стивен Розенберг — неутомимый трудоголик, неустанно экспериментирующий и до сих пор ищущий более эффективную иммунотерапию, — не мог не заметить успехов Эшхара и позвал его в свою лабораторию в качестве приглашенного специалиста. Сотрудничество ученых привело к выдающимся результатам, которые, правда, не были столь быстрыми.
Путь CAR-T: от фундаментальных исследований к первым фармпрепаратам
Несмотря на то, что CAR-T-терапия стартовала еще в конце 1980-х, для фармацевтических компаний она долго была в тени более традиционных лекарств, оставаясь в основном академической дисциплиной, в которой прогресс был медленным, а деньги, выделявшиеся на исследования, — недостаточными. Игроки Большой фармы не спешили инвестировать в потенциально нерентабельную терапию, однако в начале второй декады текущего столетия все изменилось.
Рисунок 26. Доктор Карл Х. Джун — американский иммунолог и онколог — начал заниматься генной модификацией лимфоцитов еще в середине 1990-х годов, когда, работая с компанией Cell Genesys, генетически модифицировал эти иммунные клетки для специфического нацеливания на уничтожение ВИЧ. В 1996 году у жены Карла обнаружили рак яичников, и эта трагедия во многом определила его дальнейшую судьбу, — он направил все силы, чтобы ее спасти, однако в этой битве талантливому исследователю суждено было проиграть. В 2001 году миссис Джун умерла, а Карл в дальнейшем посвятил себя исследованиям в области создания клеточной терапии рака.
В 2010 году об успешном лечении рака сообщила группа Розенберга, описавшая пациента с лимфомой, опухоли которого значительно уменьшились благодаря CAR-T-терапии [61]. Спустя еще год другая исследовательская группа, возглавляемая Карлом Джуном (рис. 26) из онкологического центра Абрамсона в Университете Пенсильвании, сообщила о наступлении стойкой ремиссии уже у двух получавших CAR-T-терапию пациентов с хроническим лимфолейкозом.
Публикация этих результатов не осталась незамеченной представителями фарминдустрии, и уже в 2012 году новостные ленты запестрели сообщениями о сотрудничестве между Novartis и исследовательской группой доктора Джуна, которое, как с гордостью было объявлено, может революционизировать лечение некоторых видов рака. Этот альянс вызвал большой коммерческий ажиотаж, и после стольких лет финансового забвения в область исследований инновационной клеточной терапии, наконец, хлынули инвестиции фармкомпаний. Помимо Novartis к разработкам вскоре присоединились Pfizer, Merck, Celgene, Amgen и другие крупные игроки. А уже через несколько лет FDA одобрило первую CAR-T-терапию:
Перспективы и вызовы
Препараты передовой терапии выглядят светлым будущим в создании лекарств, ведь уже сегодня они излечивают прежде не поддающиеся лечению болезни, а их многообещающий потенциал раскрыт пока что лишь в небольшой мере. Инновационная терапия позволяет «исправлять геном» и лечить врожденные болезни, нацеливать иммунную систему на борьбу с раком, использовать и усиливать регенеративный потенциал организма для восстановления клеток и органов. И все же, несмотря на такие невиданные возможности, у передовой терапии пока не все так радужно, и ее поистине захватывающие перспективы сдерживаются серьезными ограничениями, которые мы постараемся кратко осветить (рис. 27).
Рисунок 27. Риски инвестирования в разработку передовой терапии
Одна из фундаментальных проблем передовой терапии в том, что технология создания этих препаратов, как зачастую и сам конечный продукт пока еще остаются достаточно «сырыми». Например, создание аутологичных CAR-T (и других генных терапий ex vivo) требует прохождения этапов:
Все эти этапы проводят для каждого конкретного пациента: клетки транспортируют из больницы на производство, а затем обратно, и всё это в условиях лимита времени и под строгим контролем качества [62]. Неудивительно, что такая сложная технология делает передовые препараты крайне дорогими и далеко не массовыми [59].
Тем не менее огромный потенциал передовой терапии побуждает индустрию искать решения возникающих проблем, и по прогнозам некоторых экспертов продолжение работы в этом направлении позволит усовершенствовать технологию, а также расширить ее применение для более широких показаний уже в ближайшие несколько лет. Это приведет к новым успехам и позволит снизить стоимость, сделав препараты передовой терапии более доступными для широкого круга лиц.
Видео 3. Компания Cytiva предлагает комплексные решения в области производства препаратов клеточной терапии, которые позволяют автоматизировать рабочие процессы и сделать их с самого начала масштабируемыми. На видео представлены приборы и среды, позволяющие работать с клетками в соответствии с GMP (Good Manufacturing Practice — надлежащей производственной практикой) на всех этапах производства.
Материал предоставлен партнёром — компанией Cytiva
Прогноз на будущее
В развитии фармацевтического рынка сегодня преобладает тенденция увеличения доли инновационных лекарств, среди которых доминируют противораковые препараты (рис. 28а). Известно, что в 2018 году в разработке на разных стадиях клинических исследований находились 289 новых препаратов передовой терапии, из которых 111 были препаратами от рака (рис. 28б). О наиболее ярких из этих лекарств мы расскажем в следующих статьях спецпроекта.
Рисунок 28а. Прогнозируемый объем терапевтических лекарственных областей на фармрынке к 2024 году
Рисунок 28б. Количество препаратов клеточной и генной терапий, находящихся в разработке на разных стадиях клинических исследований (по данным 2018 года)
Тройная комбинация малых молекул для лечения муковисцидоза ($4,3 млрд)
Биофармацевтическая компания Vertex Pharmaceuticals, еще с начала 2000 годов занимавшаяся разработкой терапии от муковисцидоза, на данный момент ведет исследование тройной комбинации: тезакафтор + ивакафтор + VX-659 (или VX-445). Муковисцидоз — системное наследственное моногенное заболевание, вызываемое одной из мутаций в гене, кодирующем хлоридный канал CFTR. Эти мутации приводят к нарушению работы хлоридного канала и вызывают изменение качественного и количественного состава слизи, выделяемой различными органами, в результате чего происходит их поражение, причем в большей степени страдает бронхолегочная система.
О механизме, приводящем к такому поражению и общем патогенезе муковисцидоза, а также о современных методах лечения этого заболевания подробно расскажет статья «Биомолекулы»: «Муковисцидоз — первые надежды» [64].
Поскольку муковисцидоз на самом деле вызывается несколькими отличающимися мутациями гена CFTR, для охвата большего количества пациентов с разнообразными мутациями разрабатывались и разные малые молекулы, причем, как выяснилось, некоторые из них работают лучше в комбинациях, что привело к успешным попыткам создания комбинированной терапии для лечения этой болезни. Следующим шагом станет планируемый выход на рынок новой тройной комбинации от Vertex, при этом два вещества из этой тройки (тезакафтор и ивакафтор) уже используются, а вот третьим станет одна из двух новых малых молекул — VX-659 или VX-445, — каждая из которых в сочетании с ивакафтором при скрининге на клетках улучшала работу хлоридного канала.
Смертность при муковисцидозе довольно высока, причем еще относительно недавно это заболевание лечили лишь симптоматически. Появление первых малых молекул для лечения муковисцидоза стало настоящим прорывом, несмотря даже на то, что эти лекарства были эффективны далеко не для всех. Очевидно, что создание более эффективных препаратов для лечения муковисцидоза имеет огромное значение, поскольку подарит надежду на жизнь многим людям, страдающим от этого страшного недуга [64].
Ингибитор янус-киназ — упадацитиниб ($2,5 млрд)
Другим потенциальным блокбастером является разрабатываемый биофармацевтической компанией Abbvie упадацитиниб — малая молекула, ингибирующая особые внутриклеточные тирозинкиназы (янус-киназы), участвующие в передаче сигнала к биосинтезу через так называемый JAK-STAT сигнальный путь (рис. 29).
Рисунок 29. JAK–STAT сигнальный путь. Связывание цитокинов (показаны желтым) с рецепторами на поверхности клетки активирует янус-киназы (JAK), что в свою очередь вызывает фосфорилирование рецепторов и передачу сигнала через белки STAT в ядро клетки, где происходит активация транскрипции и последующий биосинтез белков, играющих иммунологические роли.
Активация пути JAK–STAT происходит за счет связывания цитокинов со специфичными к ним рецепторами на поверхности клетки. Поскольку цитокины регулируют иммунные реакции, блокирование передачи сигналов цитокинов за счет обрыва сигнального пути JAK–STAT может модулировать иммунный ответ. Малые молекулы, ингибирующие JAK (ингибиторы янус-киназ), предотвращают фосфорилирование рецептора и дальнейшую передачу сигнала к биосинтезу через белки STAT в ядро клетки (рис. 29).
Аутоиммунные заболевания — большая группа разнородных болезней, которыми по статистике болеют около 5% населения Земли [65]. Эти заболевания зачастую имеют тяжелые последствия: ухудшают качество жизни и могут приводить к инвалидности и смерти. На «Биомолекуле» выходил спецпроект, посвященный этому классу болезней.
Voxelotor ($1,8 млрд)
Рисунок 30. Эритроцит, имеющий характерную для больного серповидно-клеточной анемией форму (слева), рядом с нормальными эритроцитами. У больных серповидно-клеточной анемией в одном из триплетов гена гемоглобина аденин заменяется на тимин, что приводит к замене аминокислоты глутамина на валин в одной из полипептидных цепей. В результате такой точечной мутации аномальный гемоглобин в эритроцитах больных серповидно-клеточной анемией полимеризуется в длинные жесткие стержни, деформируя клетки. Такие эритроциты склонны к агрегации и не способны к нормальному циркулированию по сосудам кровеносной системы. В результате нарушается доставка кислорода к органам и тканям организма, что в свою очередь приводит к поражению многих органов и систем организма.
Биофармацевтическая компания Global Blood Therapeutics (GBT) разрабатывает препарат Voxelotor для лечения серповидно-клеточной анемии — редкого, но достаточно известного заболевания, более широко распространенного в странах центральной Африки. Эта болезнь — канонический пример генетического заболевания, вызываемого точечной мутацией — заменой всего одного нуклеотида в гене, кодирующем одну из полипептидных цепей гемоглобина (рис. 30).
У больных серповидно-клеточной анемией нарушена доставка кислорода к жизненно важным органам и тканям, что приводит к патологическим изменениям и так называемым кризам — непредсказуемым эпизодам сильной боли, вызванным блокированием капилляров агрегатами деформированных эритроцитов.
Разрабатываемый GBT Voxelotor — малая молекула, связывающаяся с гемоглобином, ингибирующая его полимеризацию и увеличивающая сродство к кислороду, что предотвращает деформацию эритроцитов и восстанавливает нормальную доставку кислорода к органам и тканям. Поскольку серповидно-клеточная анемия — серьезная угроза здоровью, необходимы новые варианты лечения, что было признано и регуляторами: FDA включило Voxelotor в программу ускоренного одобрения лекарств, а EMA — в программу поддержки приоритетных лекарственных средств (PRIME).
Zolgensma ($1,6 млрд)
Совсем недавно, в мае 2019 года, FDA одобрило первую генную терапию Zolgensma (рис. 31), предназначенную для лечения спинальной мышечной атрофии (SMA) — редкого наследственного заболевания, занимающего, тем не менее, второе место по распространенности среди коренного европейского населения после муковисцидоза, а еще являющегося основной генетической причиной детской смертности. SMA вызывается мутацией в гене, кодирующем белок выживаемости двигательных нейронов (SMN). Дефект белка приводит к их отмиранию, постепенному ослаблению, а затем и атрофии скелетных мышц. На «Биомолекуле» выходила статья, посвященная SMA и новым методам терапии этого заболевания [13].
Рисунок 31. Zolgensma — первая и пока единственная генная терапия для лечения SMA, одобренная в этом году для пациентов в возрасте до двух лет. Препарат разработала биотехнологическая компания AveXis, приобретенная в прошлом году Novartis и ныне входящая в группу компаний швейцарского фармгиганта.
Zolgensma доставляет исправный ген SMN1 в составе вектора аденоассоциированного вируса, достигающего двигательных нейронов по всему телу, что приводит к экспрессии нормально белка SMN, выживанию двигательных нейронов и улучшению состояния пациентов. В клинических исследованиях показано значительное улучшение дыхательной и двигательной функций, благодаря чему получающие такую терапию становились более дееспособными, что снижало длительность и необходимость пребывания в стационаре, а значит, и улучшало качество жизни наблюдаемых детей и опекающих их взрослых.
Заключение
Лекарственная индустрия прошла длинный и непростой путь от известного еще в древнем мире использования естественных экстрактов до создания самых последних приложений инновационной терапии. Все это стало следствием развития естественных наук, понимания биологических механизмов, лежащих в основе заболеваний, и развития современных технологий клеточной и генной инженерии, позволивших создавать лечение, которое еще совсем недавно казалось почти фантастикой.
Уже сегодня клеточная и генная терапии помогают продлевать жизни людей и дают шанс на полное излечение при ранее безнадежных диагнозах. И хотя сейчас они еще остаются во многом «сырой» технологией, сложной и финансово затратной, к работе над ее улучшением подключены огромные ресурсы, и работа эта небезуспешна. А значит, мы можем надеяться, что передовые технологии, сулящие ныне совершенно фантастические перспективы, в один прекрасный день будут реализованы в полной мере и станут воплощенной мечтой человечества о медицине будущего, в которой предотвращение и лечение даже самых страшных болезней является не более чем обыденной реальностью.
В следующих статьях спецпроекта мы расскажем о том, как сегодня происходит рациональная разработка лекарств: как ученые ищут новые мишени, доказывают их связь с болезнью и определяют наилучшие методы воздействия на них. Также мы расскажем о самых интересных разработках новых лекарств за последнее время и о наиболее замечательных результатах клинических исследований.