Что относится к ковалентной полярной связи
Ковалентная связь: полярная и неполярная, свойства и примеры

Электроны, находящиеся на перекрывающихся электронных орбиталях, поступают в общее пользование. При этом создаётся ситуация, при которой внешние электронные уровни атомов оказываются заполненными, то есть образуется 8-ми или 2-х электронная внешняя оболочка.
Состояние, при котором электронная оболочка заполнена полностью, характеризуется наименьшей энергией, а соответственно, и максимальной устойчивостью.
Механизмов образования два:
В первом случае один из атомов предоставляет свою пару электронов, а второй — свободную электронную орбиталь.
Во втором — в общую пару приходит по одному электрону от каждого участника взаимодействия.
В зависимости от того, к какому типу относятся — атомному или молекулярному, соединения с подобным видом связи могут значительно различаться по физико-химическим характеристикам.
Ковалентная неполярная химическая связь
Вещества атомные существуют в виде прочных кристаллов, имеющих высокие температуры кипения и плавления, не растворимы в воде и прочих растворителях, многие не проводят электрический ток. Как пример можно привести алмаз, который обладает исключительной прочностью. Это объясняется тем, что алмаз представляет собой кристалл, состоящий из атомов углерода, соединённых ковалентными связями. В алмазе нет отдельных молекул. Также атомным строением обладают такие вещества, как графит, кремний (Si), диоксид кремния (SiO 2), карбид кремния (SiC) и другие.
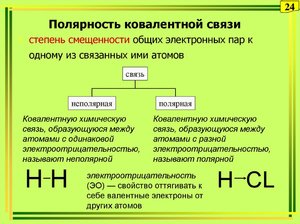
Ковалентная связь может быть образована как между двумя атомами одного элемента (неполярная), так и между атомами различных химических элементов (полярная).
Указать формулу соединения с ковалентной полярной связью не представляет труда, если сравнить значения электроотрицательностей, входящих в состав молекул атомов. Отсутствие разницы в электроотрицательности определит неполярность. Если же разница есть, то молекула будет полярна.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Ковалентная неполярная химическая связь
Характерна для простых веществ неметаллов. Электроны принадлежат атомам в равной степени, и смещения электронной плотности не происходит.
Примером могут служить следующие молекулы:
H2, O2, О3, N2, F2, Cl2.
Исключением являются инертные газы. Их внешний энергетический уровень заполнен полностью, и образование молекул им энергетически не выгодно, в связи с чем они существуют в виде отдельных атомов.
Также примером веществ с неполярной ковалентной связью будет, например, РН3. Несмотря на то, что вещество состоит из различных элементов, значения электроотрицательностей элементов фактически не различаются, а значит, смещения электронной пары происходить не будет.
Видео: Виды химической связи: ионная, ковалентная полярная и неполярная, донорно-акцепторная
Ковалентная полярная химическая связь
Рассматривая ковалентную полярную связь, примеров можно привести множество: HCl, H2O, H2S, NH3, CH4, CO2, SO3, CCl4, SiO2, СО.
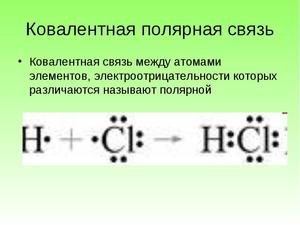
Ковалентная полярная связь образуется между атомами неметаллов с различной электроотрицательностью. При этом ядро элемента с большей электроотрицательностью притягивает общие электроны ближе к себе.
Схема образования ковалентной полярной связи
В зависимости от механизма образования общими могут становиться электроны одного из атомов или обоих.
На картинке наглядно представлено взаимодействие в молекуле соляной кислоты.
Пара электронов принадлежит и одному атому, и второму, у обоих, таким образом, внешние уровни заполнены. Но более электроотрицательный хлор притягивает пару электронов чуть ближе к себе (при этом она остаётся общей). Разница в электроотрицательности недостаточно большая, чтобы пара электронов перешла к одному из атомов полностью. В результате возникает частичный отрицательный заряд у хлора и частичный положительный у водорода. Молекула HCl является полярной молекулой.
Физико-химические свойства связи
Связь можно охарактеризовать следующими свойствами: направленность, полярность, поляризуемость и насыщаемость.
Ковалентная связь — полярная и неполярная, механизмы образования
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов.
Электроотрицательность неметаллов довольно велика, так что при химическом взаимодействии двух атомов неметаллов полный перенос электронов от одного к другому (как в случае ионной связи) невозможен. В этом случае для выполнения правила октета необходимо объединение электронов.
В качестве примера обсудим взаимодействие атомов водорода и хлора:
H 1s 1 — один электрон
Cl 1s 2 2s 2 2p 6 3s 2 3p 5 — семь электронов на внешнем уровне
Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку. И каждый из атомов выделяет „в общее пользование” по одному электрону. Тем самым правило октета оказывается выполненным. Лучше всего изображать это с помощью формул Льюиса:
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора — восемь электронов (свои плюс обобществленный электрон атома водорода). Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора. Образовавшаяся при связывании двух атомов частица называется молекулой.
Неполярная ковалентная связь
Ковалентная связь может образоваться и между двумя одинаковыми атомами. Например:
Эта схема объясняет, почему водород и хлор существуют в виде двухатомных молекул. Благодаря спариванию и обобществлению двух электронов удается выполнить правило октета для обоих атомов.
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода О2 или азота N2. Атомы азота имеют по пять валентных электронов, следовательно, для завершения оболочки требуется еще по три электрона. Это достигается обобществлением трех пар электронов, как показано ниже:
Ковалентные соединения — обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому. В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора. Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
В таблице ниже перечислены основные типы связей и примеры веществ:
Обменный и донорно-акцепторный механизм образования ковалентной связи
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Ковалентная связь, полярная и неполярная, особенности, формулы и схемы
Можно сделать вывод, что химию знать просто необходимо, разбираться в ней и знать, как устроен наш мир или какие-то отдельные его части — интересно, и, более того, полезно.
Сейчас нам предстоит разобраться с таким термином, как ковалентная связь, которая, кстати говоря, может быть как полярной, так и неполярной. Кстати говоря, само слово «ковалентная», образуется от латинского «co» — совместно и «vales» — имеющий силу.
Появления термина
Начнём с того, что сам термин «ковалентная» впервые ввёл в 1919 году Ирвинг Ленгмюр — лауреат Нобелевской премии. Понятие «ковалентной» предполагает химическую связь, при которой оба атома обладают электронами, что называется совместным обладанием. Таким образом, она, к примеру, отличается от металлической, в которой электроны свободны, или же от ионной, где и вовсе один отдаёт электроны другому. Нужно заметить, что образуется она между неметаллами.
Исходя из вышесказанного, можно сделать небольшой вывод о том, что из себя представляет этот процесс. Она возникает между атомами за счёт образования общих электронных пар, причём пары эти возникают на внешних и предвнешних подуровнях электронов.
Примеры, вещества с полярной:
Виды ковалентной связи
Также различаются два вида — это полярная, и, соответственно, неполярная связи. Особенности каждой из них мы разберём отдельно.
Ковалентная полярная — образование
Что из себя представляет термин «полярная»?

В итоге при полярной электронная плотность смещается к более электроотрицательному, на нём же возникает частичный отрицательный заряд. В свою очередь, у того ядра, чья электроотрицательность ниже, возникает, соответственно, частичный положительный заряд.
Делаем вывод: полярная возникает между различными неметаллами, которые отличаются по значению электроотрицательности, а электроны располагаются ближе к ядру с большей электроотрицательностью.
Электроотрицательность — способность одних атомов притягивать к себе электроны других, тем самым образуя химическую реакцию.
Примеры ковалентной полярной, вещества с ковалентной полярной связью:
Формула вещества с ковалентной полярной связью
Ковалентная неполярная, разница между полярной и неполярной
И наконец, неполярная, скоро мы узнаем что же она из себя представляет.
Основное отличие неполярной от полярной — это симметрия. Если в случае с полярной электроны располагались ближе к одному атому, то при неполярной связи, электроны располагаются симметрично, то есть в равной степени по отношению к обоим.
Примечательно, что неполярная возникает между атомами неметалла одного химического элемента.
К примеру, вещества с неполярной ковалентной связью:
Также совокупность электронов зачастую называют просто электронным облаком, исходя из этого делаем вывод, что электронное облако связи, которое образует общая пара электронов, распределяется в пространстве симметрично, или же равномерно по отношению к ядрам обоих.
Примеры ковалентной неполярной связи и схема образования ковалентной неполярной связи
Свойства связи
Но Также полезно знать, как же различать ковалентную полярную и неполярную.
Ковалентная неполярная — это всегда атомы одного и того же вещества. H2. CL2.
В остальных случаях можно считать полярной.
На этом статья подошла к концу, теперь мы знаем, что из себя представляет этот химический процесс, умеем определять его и его разновидности, знаем формулы образования веществ, и в целом чуточку больше о нашем сложном мире, успехов в химии и образовании новых формул.
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Содержание:
Химические связи – это приоритетная проблема в современной химии. От полученных знаний зависит выяснение причин разнообразия соединений, также строения и возникновения веществ. Выявленные типы: ионный, ковалентный, металлический, водородный.
Химические вещества состоят из не связанных между собой атомов химических элементов. Такое строение имеют только благородные газы: гелий, неон, аргон, криптон, ксенон и радон. Чаще всего химические вещества состоят не из отдельных атомов, а из их соединений, которые образуют различные группировки. Такие объединения атомов могут состоят из нескольких единиц, сотен, тысяч или даже больше атомов. Сила, которая держит эти атомы в составе таких группировок, называется химическая связь.
Причиной образования химической связи
Например: взаимодействуют атомы А и В. Энергия такого атома выше, чем соединения АВ, потому что при взаимодействии более электроотрицательный атом оттягивает на себя электроотрицательность и происходит смещение электронной плотности, а значит и понижение энергии всей молекулы. Поэтому в молекуле АВ энергия ниже, чем у отдельных атомов А и В.
E(АВ) 
Энергетический минимум идентичен устойчивому состоянию системы – в этой ситуации из пары обособленных водородных частиц получается молекула H2. Во время реакции производится 436 кДж/моль.
Как определить тип связи
Характеристики химических связей между частицами веществ зависят от электроотрицательности – возможности сохранять валентные электроны. Этот показатель зависит от заряженности ядра и радиуса атома. Для количественной оценки применяют шкалу Полинга (Табл. 1).
Определение вида взаимосвязи по разнице электроотрицательност (ЭО):В многообразии источников попадаются разные таблицы. Использовать можно каждую шкалу, потому что важнее разница электроотрицательностей, которая в среднем сходна в изобретённых системах, а не значение.
Ковалентная химическая связь
Между атомами элементов неметаллов возникает ковалентных характер связи. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия, потому что атомы разных элементов имеют различную способность притягивать к себе общую электронную пару. Это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. На другом атоме формируется частичный положительный заряд.
Ковалентный тип – это химическая связь, в результате которой возникают общие пары электронов. Два пути появления:
Пример обменного способа – объединение атомов в молекулу водорода. Сближаясь, электронные оболочки перекрываются, а электронная плотность между ядрами повышается. Идёт притяжение, и энергия системы понижается. При близком сближении ядра отталкиваются – появляется расстояние (Рис. 2).
Характеристики ковалентной связи:
Ковалентная связь включает две разновидности по полярности: полярная и неполярная. Определяют по электроотрицательности атомов – одинаковая она или нет.
Характеристика:
1. Неполярная ковалентная – связь между одинаковыми мелкими частицами (неметаллами) с размеренным распространением электронной плотности и равной электроотрицательностью. Примеры: Cl2, H2, I2, O2, N2 (Рис. 3).
2. Полярная ковалентная – это соединение неравных частиц (неметаллов) с разницей в электроотрицательности и смещением общей пары электронов. Примеры: NH3, HCl, CO2, H2O (Рис. 4).
Полярность – характеристика, определяющая физические или химические свойства вещества. Она влияет на механизм реакций, реакционную способность ближайших связей. Полярность молекулы, температуры плавления и кипения, а также растворимость – показатели, зависящие от полярности связей.
Ионная связь
Ионный тип – тип, при котором разница электроотрицательности атомов больше 1,7–2 по шкале Полинга. Если точнее, то притяжение появляется между ионами с разными зарядами. В возникновении ионного типа участвуют металлы, неметаллы. Примеры: NaCl, LiF, K2O, другие (Рис. 5).
Главные характеристики: ненаправленность и ненасыщаемость. Ионная связь во многом сходна с ковалентной, поэтому считается предельным случаем. Энергия связи (прочность) доходит до 800 кДж/моль.
Металлическая связь
Характеристики металлов: блеск, ковкость, пластичность и сравнительно высокая температура плавления, тепло- и электропроводность. Общность этих качеств объясняется сходством организации атомов:
Металлический тип – это связь сравнительно свободных отрицательно заряженных частиц между ионами металлов с образованием кристаллической решётки. Примеры – Fe, Na, Ca, Sc и Au3Cu, другие (Рис. 6).
Общность металлического и ковалентного вида связей – обобществление валентных электронов в основе. Различия заключаются в меньшей прочности и отсутствии направленности. Прочность (энергия) у металлической связи в 3–4 раза ниже этого же показателя у ковалентного типа. Образование металлической связи между атомами металлов возможна из-за наличия кинетической энергии внутри каждого атома металла, при увеличении центробежной силы электроны последнего электронного слоя вылетают за пределы атома и связывают атомы металлов между собой. Каждый атом, который потерял электрон превращается в положительно заряженную частицу – протон. И происходит взаимное притяжение протона и электрона, который только что покинул атом. Электроны могут притягиваться обратно и таким образом происходит снова образование атома. Существованием свободных электронов объяснятся свойство металлов к электропроводности (электрический ток – направленное движение электронов). Поэтому металлическую кристаллическую решетку химически невозможно разрушить, её можно только механически распилить.
Водородная связь
Водородные соединения с электроотрицательными атомами фтора, хлора, азота, кислорода образуются благодаря водородным связям. В молекуле общая пара электронов движется к более электроотрицательному атому. Классический пример – жидкий фторид водорода (Рис. 7).
Энергия водородной связи составляет до 40 кДж/моль, поэтому этот тип в 10–20 раз слабее ковалентного. Водородные связи возникают между или внутри молекул. От этого зависят физико-химические свойства вещества.
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь.
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.


