Что открывает нингидриновая реакция ее химизм
НИНГИДРИНОВАЯ РЕАКЦИЯ
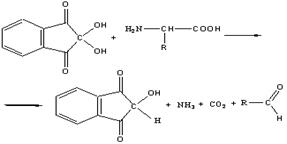
цветная р-ция на a-аминокислоты, к-рую осуществляют нагреванием последних в щелочном р-ре избытка нингидрина (гидрата 1,2,3-ин-дантриона, ф-ла I):
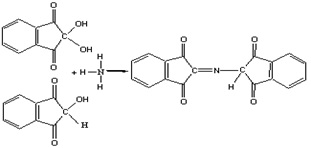
Образующееся соед. II имеет фиолетово-синюю окраску (l макс 570 нм). Пролин и гидроксипролин, у к-рых нет a-аминогруппы, в р-ции с нингидрином образуют производное желтого цвета (l. макс 440 нм). Н. р. неспецифична, т. к. окрашенный продукт с нингидрином дают также NH 3 и др. соед., содержащие аминогруппу (в т. ч. белки и пептиды). Однако р-ции с этими соед. осуществляются без выделения СО 2 (Н. р. с выделением СО 2 специфична только для a-аминокислот).
Р-цию используют для колориметрич. количеств. определения a-аминокислот, в т. ч. в автоматич. аминокислотных анализаторах.
Лит.: Ленинджер А., Основы биохимии, пер. с англ., т. 1, М., 1985, с. 126-27 П. Д. Решетов.
Смотреть что такое «НИНГИДРИНОВАЯ РЕАКЦИЯ» в других словарях:
НИНГИДРИНОВАЯ РЕАКЦИЯ — Абдергаль дена и Шмидта (Abderhalden, Schmidt) основана на том, что все а аминокислоты дают при кипячении их водного раствора с нин /СОх гидрином [Свн4 С(ОН)а] синее окрашивание^ К 10 см3 испытуемого раствора прибавляют 0,2 еж31% ного… … Большая медицинская энциклопедия
нингидриновая реакция — (син. нингидринная реакция) метод обнаружения и количественного определения свободных аминокислот и иминокислот, основанный на химической реакции образования ими в щелочной среде окрашенного комплекса с нингидрином; используется в лабораторной… … Большой медицинский словарь
Нингидриновая реакция — цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (… … Большая советская энциклопедия
реакция нингидриновая — Гистохимический тест на наличие белка [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN ninhydrin reaction … Справочник технического переводчика
Реакция Нингидриновая (Ninhydrin Reaction) — гистохимический тест на наличие белка, в котором нингидрин (гидрат трикетогидриндена) доводится до кипения вместе с тестируемым раствором и дает синюю окраску, если в растворе присутствуют аминокислоты и белки. Источник: Медицинский словарь … Медицинские термины
РЕАКЦИЯ НИНГИДРИНОВАЯ — (ninhydrin reaction) гистохимический тест на наличие белка, в котором нингидрин (гидрат трикетогидриндена) доводится до кипения вместе с тестируемым раствором и дает синюю окраску, если в растворе присутствуют аминокислоты и белки … Толковый словарь по медицине
нингидринная реакция — см. Нингидриновая реакция … Большой медицинский словарь
Пролин — α пирролидинкарбоновая кислота; гетероциклическая аминокислота (См. Аминокислоты) (точнее иминокислота (См. Иминокислоты)); существует в оптически активных D и L и рацемической DL формах. Вторичная аминогруппа П. обусловливает его… … Большая советская энциклопедия
Нингидри́нная реа́кция — см. Нингидриновая реакция … Медицинская энциклопедия
Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
НИНГИДРИНОВАЯ РЕАКЦИЯ



Реакция нингидрина с аминокислотами используется для обнаружения и количественного определения аминокислот.
Нингидрин, являющийся сильным окислителем, вызывает окислительное дезаминирование аминокислот, приводящее к образованию СО2, соответствующего альдегида и восстановленной формы нингидрина (1).
Восстановленная форма нингидрина реагирует с избытком нингидрина и NН3. При этом образуется продукт сине-фиолетового цвета (2). Протекающие реакции можно записать следующим образом:
продукт конденсации фиолетового цвета (2)
Ход работы: К 1 мл белка добавляют 2 мл водного 1% р-ра нингидрина и кипятят. Образуется осадок сине-фиолетового цвета.
Нингидриновая реакция на определение аминокислот и белка
Содержание
Спектрофотометрическое исследование продуктов нингидриновой реакции [ править | править код ]
Разработка точных, доступных методов анализа а-аминокислот является одной из актуальных задач современной фармации, в данной статье описан простой и доступный способ определения аминокислот и протеина в различных продуктах, включая биологически-активные добавки и спортивное питание.
В настоящее время существует ряд методов количественного определения а-аминокислот в лекарственном растительном сырье, в лекарственных препаратах и биологических жидкостях [1—31]. Однако, несмотря на высокую точность, их применение ограничено длительностью приготовления рабочих растворов (потенциометрическое титрование в неводной среде), дороговизной оборудования (ГЖХ, ВЭЖХ) [4, 6,27,28, 30].
Для анализа а-аминокислот также широко используют методы, основанные на реакции с нингидрином [1,3, 8,9, 11-20,23, 29].
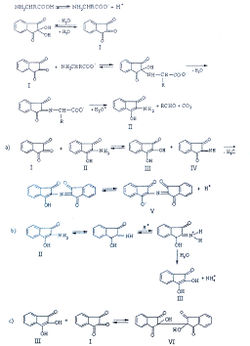
Khan А. с соавторами изучили механизм нингидриновой реакции [29]:
Для детектирования продукта нингидриновой реакции используют спектрофотометры, флуориметры.
Широкое распространение в анализе аминокислот получили аминокислотные анализаторы [1,9,11,13—15, 17]. Данный метод основан на разделении аминокислот с помощью ионообменной хроматографии с последующим фотоколориметрическим определением продуктов реакции аминокислот с нингидрином. Применение аминокислотных анализаторов позволяет разделить исследуемый образец на отдельные компоненты и определить их количество быстро и с высокой точностью. Главным недостатком данного метода анализа является высокая стоимость оборудования, что делает его недоступным для большинства лабораторий.
Более доступными и простыми являются фотоколориметрические и спектрофотометрические методы анализа о-аминокислот, основанные на их взаимодействии с нингидрином. Так, В.А. Храмовым модифицирован метод определения диаминокислот по Чинарду [12]. Метод основан на образовании красно-коричневых продуктов взаимодействия диаминокислот с нингидрином с последующим фотоколориметрическим определением при длине волны 490 нм. Метод является специфичным: нейтральные аминокислоты, а также амины и диамины при pH 1 с нингидрином окрашенных продуктов не образуют. Несмотря на доступность и простоту данный метод не является универсальным для всех а-аминокислот и позволяет определить лишь диаминокислоты, из которых наибольшее практическое значение имеет незаменимая аминокислота лизин. Кроме того, этим методом можно определить пролин.
Разработана точная методика количественного определения кислоты аспарагиновой в лекарственном препарате «Аспаркам», основанная на ее взаимодействии с 1 % этаноловым раствором нингидрина и последующим определением оптической плотности продукта реакции при длине волны 568 нм. Метод отличается хорошей воспроизводимостью, относительная ошибка среднего результата составила ±2,25 % [19]. Кроме того, предложен спектрофотометрический метод анализа суммы аминокислот различных видов пыльцы, основанный на взаимодействии с 2 % этаноловым раствором нингидрина [11].
С этих позиций представляет интерес изучение спектральных характеристик продуктов нингидриновой реакции 20-ти наиболее важных в биологическом отношении а-аминокислот, оптимизация условий ее проведения с целью разработки точного и доступного метода количественного определения а-аминокислот в растительном сырье, субстанциях и суммарных лекарственных препаратах.
Исследование спектральных характеристик продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне [ править | править код ]
В соответствии с ГФ XI наиболее часто в хроматографических методах анализа а-аминокислот используют 0,2 % раствор нингидрина в ацетоне [3, 8]. На этом основании мы изучили спектры продуктов реакции для 20-ти а-аминокислот с ОД % раствором нингидрина в ацетоне с целью создания нового метода количественного анализа аминокислот в различных объектах.
Нингидриновую реакцию проводили по методике, указанной в ФСП на кислоту глутаминовую в разделе «подлинность»: к 1 мл 2 % раствора а-аминокислоты прибавляют 1 мл свежеприготовленного 0,2 % раствора нингидрина в ацетоне и нагревают до появления сине-фиолетовой окраски [10]. Цистеин и тирозин, вследствие их низкой растворимости в воде, использовали в виде менее концентрированных 0,04 % растворов. После полного охлаждения продукты нингидриновой реакции каждой из 20-ти а-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0.
Исследование спектров поглощения в видимой области показало наличие двух максимумов в диапазонах длин волн 399-405 и 560-570 нм. Данная закономерность наблюдается для 19-ти из 20-ти а-аминокислот (рис. 1-4). Исключение составляет пролин, продукт реакции которого с нингидрином имеет один максимум поглощения в видимой области — при длине волны 416 нм, что объясняется отсутствием первичной аминогруппы в структуре данной аминокислоты.
Реакция с нингидрином на аминокислоты и белки
Реакция нингидрина с аминокислотами
Реакция нингидрина с аминокислотами используется для обнаружения и количественного определения аминокислот.
Нингидрин, являющийся сильным окислителем, вызывает окислительное дезаминирование аминокислот, приводящее к образованию СО2, соответствующего альдегида и восстановленной формы нингидрина (1).
Восстановленная форма нингидрина реагирует с избытком нингидрина и NН3. При этом образуется продукт сине-фиолетового цвета (2). Протекающие реакции можно записать следующим образом:
продукт конденсации фиолетового цвета (2)
Ход работы: К 1 мл белка добавляют 2 мл водного 1% р-ра нингидрина и кипятят. Образуется осадок сине-фиолетового цвета.
ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина.
Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a-нафтола:
В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a-нафтола.
Спектрофотометрическое определение a-аминокислот в разных условиях проведения реакции с нингидрином
Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Это реакция на цистеин и цистин.
При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия.
При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
При взаимодействии a-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a-аминокислот методом формального титрования (метод Сёренсена).
В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
a-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли.
Со свежеприготовленным гидроксидом меди(II) все a-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы.
Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет.
В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски.
После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца.
Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают.
Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца.
В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
Качественной реакцией на серосодержащие a-аминокислоты является реакция Фоля.
Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь.
Наблюдается появление серо-черного осадка.
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных.
Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К.
Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М.
Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова.
М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев, секция «Юный химик» РХО им.
Д.И.Менделеева (г. Тобольск)
Качественные реакции на аминокислоты, пептиды, белки
Аминокислоты можно обнаружить с помощью цветных реакций: нингидриновой, ксантопротеиновой, Фоля, Милона, биуретовой пробы и др.
Эти реакции неспецифичны, т.к. основаны на обнаружении отдельных фрагментов в структуре аминокислот, которые могут встречаться и в других соединениях.
Нингидриновая реакция, цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм.
Т. к. поглощение при этой длине волны линейно зависит от числа свободных аминогрупп, нингидриновая реакция послужила основой для их количественного определения методами колориметрии или спектрофотометрии. Эта реакция используется также для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета.
Чувствительность — до 0,01%. Современный автоматический аминокислотный анализ проводят, сочетая ионообменное разделение аминокислот и количественное определение их с помощью нингидриновой реакции.
При разделении смесей аминокислот методом бумажной хроматографии позволяет определять каждую аминокислоту в количестве не менее 2—5 мкг.
По интенсивности окраски можно судить о количестве аминокислот.
Эта реакция положительна не только со свободными аминокислотами, но и пептидами, белками и др.
Ксантопротеиновая реакция позволяет обнаружить ароматические аминокислоты (фенилаланин, тирозин, гистидин, триптофан), основана на реакции электрофильного замещения в ароматическом ядре (нитрование).
При действии концентрированной азотной кислоты, например, на тирозин образуется продукт, окрашенный в желтый цвет.
Реакция Фоля. Это реакция на цистеин и цистин.
При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия.
Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Реакция Циммермана. Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида.
Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
Реакция на триптофан. Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
Реакция Сакагучи. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с α-нафтолом в присутствии окислителя.
Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина.
Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра α-нафтола:
В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Биуретовая реакция – используется как цветная реакция на белки. В щелочной среде в присутствии солей меди(II) они дают фиолетовое окрашивание.
Опыт 5. Реакция глицина с нингидрином.
Свое название эта реакция получила от производного мочевины — биурета, который образуется при нагревании мочевины с отщеплением аммиака:
Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи.
Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий.
кетонная форма полипептида
енольная форма полипептида
При взаимодействии полипептида с Cu (OH)2 образуется комплекс, строение которого можно показать так:
В пробирку поместите 4 капли 0,2н раствора глицина и 2 капли 0,1% раствора нингидрина. Содержимое пробирки осторожно нагрейте до появления сине-красной окраски.
Какие аминокислоты могут быть обнаружены реакцией с нингидрином?
2. Для каких целей может быть использована данная реакция в качественном анализе?
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. При формировании пространственной структуры белковых молекул неполярные радикалы a-аминокислот располагаются внутри макромолекулы, а полярные и ионогенные радикалы-на поверхности. Отнесите следующие аминокислоты к неполярным (гидрофобным) и полярным (гидрофильным); объясните свой выбор: Тре, Цис, Фен, Три, Про, Глн, Сер, Мет, Лей.
Напишите структурные формулы и выберите среди следующих аминокислот положительно и отрицательно заряженные.
Напишите схемы их ионизации в воде:
Асп, Арг, Гис, Глу, Лиз, Асн, Глн, Гли, Тир.
3. В составе природных белков встречаются только L-аминокислоты. Напишите в виде проекций Фишера возможные конфигурационные стереоизомеры для валина, цистеина, изолейцина. Укажите D- и L-стереоизомеры.
4. Для разделения рацемической смеси D- и L-a-аланина его N-ацилированный продукт обрабатывают ферментом ацилазой и извлекают один из энантиомеров водным раствором HCl.
Какой энантиомер образуется под воздействием фермента в растворе в свободном, не ацилированном виде? Напишите реакцию его образования и взаимодействия с HCl.
Метионин (рКа 5,75) и гистидин (рКа 7,58) используют для лечения и предупреждения заболеваний печени. Пользуясь значениями рКа, определите, в какой ионной форме будут находиться перечисленные аминокислоты в крови (рН 7,3-7,5).
Незаменимые аминокислоты триптофан (рКа 5,88) и лизин (рКа 9,74) должны поступать в организм человека с пищей. Пользуясь значениями рКа определите, в какой ионной форме они присутствуют в желудке (рН
1) и в крови (рН 7,3-7,5).
7. Для белкового питания больным внутривенно вводят препарат «Полиамин», состоящий из 13 аминокислот, в том числе аргинина (рКа 10,76) и лейцина (рКа 5,98). Пользуясь значениями рКа, определите, в какой ионной форме будут находиться перечисленные аминокислоты в крови (рН 7,3-7,5).
Тиольная группа цистеина является одной из наиболее реакционноспособной в белках и особенно сильно подвергается модификации. Для выяснения ее роли в проявлении активности ферментов проводят модификацию тиольной группы путем алкилирования йодуксусной кислотой (I-CH2COOH) и йодацетамидом (I-CH2CONH2). Напишите уравнения реакции, назовите реакционные центры, которые участвуют в этом процессе, тип и механизм реакции.
Модификация остатков аминокислот помогает определить их локализацию, либо участие в выполнении биологической функции. В частности ацилирование с помощью радиоактивно моченого уксусного ангидрида было предложено в качестве метода определения локализации остатков лизина, расположенных на поверхности белковой глобулы. Напишите схему реакции ацилирования.
10. Сложные эфиры a-аминокислот обладают летучестью и используются для разделения a-аминокислот методом газожидкостной хроматографии.
Напишите схему образования сложного эфира треонина, укажите тип и механизм реакции, опишите ее механизм.
11. При участии ферментов декарбоксилаз в организме аминокислоты декарбоксилируются с образованием биогенных аминов. Напишите схемы реакций декарбоксилирования гистидина и триптофана.
Назовите продукты реакций, опишите их биологическую роль.
12. В количественном анализе аминокислот применяется метод Ван-Слайка и метод Серенсена. Напишите схемы реакций лежащих в основе этих методов.
13. Образование фенилтиогидантоиновых производных аминокислот используется для установления структуры пептидов.
Напишите схемы реакций получения таких производных для валина и аспарагиновой кислоты. Укажите реагент.
14. Качественная реакция на ароматические аминокислоты – ксантопротеиновая реакиця – основана на образовании нитросоединений под действием азотной кислоты. Напишите схему реакции нитрования тирозина. Укажите механизм реакции.
15. На начальных стадиях биосинтеза кофермента А (HS-KoA) аспарагиновая кислота декарбоксилируется до b-аланина, который образует амид с пантоевой (2,4-дигидрокси-3,3-диметилбутановой) кислотой – пантотеновую кислоту.
Напишите схемы реакций.
16. Трансаминирование – основной путь биосинтеза a-аминокислот, которое осуществляется с участием ферментов трансаминаз (аминотрансфераз) и кофермента пиридоксальфосфата. В этом процессе пиридоксальфосфат играет роль посредника при передаче аминогруппы от a-аминокислоты к оксокислоте. Напишите все схемы реакций, протекающих с участием пиридоксальфосфата в процессе трансаминирования цистеина с участием a-оксоглутаровой кислоты.
По наличию или отсутствию аланинтрансаминазы в сыворотке крови больного инфарктом миокарда можно судить о результатах лечения. К сыворотке крови добавляют a-аланин и a-оксоглутаровую кислоту. Какие продукты образуются, если аланинтрансаминаза присутствует?
У детей страдающих фенилкетонурией в крови (и моче) повышено содержание фенилаланина и продуктов его превращения, которые образуются при последовательном трансаминировании фенилаланина с образованием оксокислоты (А), восстановлении (А) с образованием гидроксикислоты (В), декарбоксилировании (В) с образованием продукта реакции (С). Небольшая часть (С) окисляется до соответствующей кислоты, которая экскретируется с мочой в виде комплекса с глутамином.
Напишите схемы последовательного превращения фенилаланина при фенилкетонурии. Назовите промежуточные продукты.
19. Допишите следующие реакции метаболизма аминокислот:




Катаболизм валина в организме человека включает следующие стади (в указанном порядке):
1) Трансаминирование, приводящее к образованию a-оксокислоты (А).
2) Окислительное декарбоксилирование (А) в присутствии HS-КоА, приводящее к образованию тиоэфира (Б).
3) Дегидрирование (Б) с образованием ненасыщенного производного (В).
4) Гидратация (В) против правила Марковникова с образованием (Г).
5) Гидролиз тиоэфира (Г) с образованием свободной кислоты (Д).
6) НАД+ зависимое окисление первичноспиртового гидроксида вещества (Д) с образованием альдегидокислоты (Е) и т.д.
Напишите эти реакции и назовите промежуточные продукты.
ЗАНЯТИЕ 15.
ПЕПТИДЫ И БЕЛКИ.
ЦЕЛЬ:Сформировать знания:
– принципов структурного построения пептидов и белков;
– первичной структуры пептидов и белков, методов ее определения;
– пространственной организации полипептидной цепи;
– кислотно-основных свойств и гидролиза пептидов;
– синтеза пептидов in vitro.
– писать структуру ди- и трипептидов, используя знания формул a-аминокислот;
– определять изоэлектрическую точку пептидов;
– изображать разные ионные формы пептидов в зависимости от рН среды;
– выполнять характерные и качественные реакции на пептиды и белки.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ
Биологические функции пептидов и белков.
2. Принцип структурного построения пептидов и белков. Электронное строение и свойства пептидной связи.
Свойства пептидов. Изоэлектрическое состояние и изоэлектрическая точка пептидов, кислотный и щелочной гидролиз пептидов.
4. Первичная структура пептидов и белков. Определение аминокислотной последовательности по Эдману (фенилизотиоцианатный метод).
5. Синтез пептидов in vitro методом «активации» и «защиты» функциональных групп.
Понятие о стратегии пептидного синтеза.
6. Вторичная структура пептидов и белков. Регулярные a-спиральные и b-структурные участки полипептидных цепей. Понятие о третичной и четвертичной структурах белков.
7. Понятие о сложных белках.
Гемоглобин, строение, свойства, значение.
ЛИТЕРАТУРА:
[1]. Тюкавкина Н.А., Биоорганическая химия. / Н.А.Тюкавкина, Ю.И. Бауков– М.: Медицина, 1991.– С. [2]. Гидранович Л.Г. Биоорганическая химия: Учеб. пособие. /Л.Г.Гидранович. – Витебск: ВГМУ, 2009.– С. [3]. Гидранович Л.Г. Лабораторные занятия по биоорганической химии.: Учеб. пособие / Л.Г.Гидранович. – Витебск: ВГМУ, 2012.– С.107-113. [4]. Гидранович Л.Г. Курс лекций по биоорганической химии.– Витебск.– 2003.– С. 197-210.
ЗАДАНИЯ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ.
1. Подготовить теоретический материал по вопросам для самоподготовки к занятиям.
Оформить протокол лабораторной работы.
3. Решить задачи 1-6,9,14, представленные на страницах 111-113 данного лабораторного практикума.
Примерный вариант заключительного контроля:
Напишите ионные формы дипептида Гис-Про при рН 1,0 и 7,5.
2. Напишите схемы реакций, обозначьте графически действующие реакционные центры, укажите, где возможно, тип и механизм реакций:
СОДЕРЖАНИЕ ЛАБОРАТОРНОГО ПРАКТИКУМА.
Нингидриновый реактив легко окисляется и темнеет при освещении и контакте с воздухом. Его следует хранить на холоду, в темноте и под азотом. Даже максимально короткие трубки подачи реактива приходится с помощью специального покрытия защищать от диффузии воздуха через их стенки. Для восстановления нингидрина в реактив иногда добавляют хлорид олова. От него в трубках постепенно накапливается нерастворимый осадок.
Приготовление нингидринового реактива: в сосуд из оранжевого стекла вместимостью 1 л помещают 375 мл монометилового эфира этиленгликоля ( ТУ 6 — 09 — 08 — 4398 — 77), прибавляют 125 мл натрий-ацетатного буферного раствора рН 5 5, при перемешивании на магнитной мешалке пропускают азот в течение 10 мин, затем прибавляют 10 г нингидрина и вновь пропускают азот в течение 10 мин, продолжая перемешивание на магнитной мешалке до полного растворения нингидрина.
После этого прибавляют 0 19 г олова двухлористого 2-водного и перемешивают.
Приготовление нингидринового реактива: 40 мг SnQ2 2Н2О растворяют в 25 мл цитратного буферного раствора и добавляют 4 0 мг нингидрина, предварительно растворенного в 12 5 мп метилцеллозольва.
Проявление проводят нингидриновым реактивом. Затем стеклянную пластинку с адсорбентом нагревают в сушильном шкафу 30 мин при 110 С.
Хрома-тограмму амина проявляют нингидриновым реактивом, причем после смачивания нингидрином нужно нагревать бумагу 5 мин при 105 С для получения интенсивной фиолетовой окраски.
Схема нингидринового анализатора, изготовленного из автоанализатора фирмы Technicon Chromatography Co.
Далее к пробе добавляется нингидриновый реактив, аналогичный по составу, описанному на стр.
Для определения пролина готовят нингидриновый реактив, содержащий 40 мл 6 М Н3Р04, 60 мл ледяной уксусной кислоты и 2 5 г нингидрина на каждые 100 мл смеси.
Для растворения нингидрина эту смесь нагревают до 70 на водяной бане.
Схема нингидринового анализатора, изготовленного из автоанализатора фирмы Technicon Chromatography Co. Далее к пробе добавляется нингидриновый реактив, аналогичный по составу, описанному на стр.
Последнее затруднение удалось преодолеть, применяя нингидриновый реактив, содержащий хлористое олово.
Важной особенностью работы автоматического аппарата является исключительно постоянный фон: 0 001 единиц оптической плотности до и после каждого пика. Уже с 1 / 10 мкмоль растворенного вещества можно получать удовлетворительные результаты; ввиду отличной воспроизводимости объемов вытекания удается идентифицировать компоненты смеси, присутствующие в низких концентрациях.
Применение тонкослойной хроматографии для проверки препаративного разделения на колонках ( с разрешения Am.
Chem. Soc.. Перешедшее на нее небольшое количество аминокислот элюировали нингидриновым реактивом. Разделенные на секции зоны анализировали далее методом ТСХ.
Розен [16] усовершенствовал методику Пье и Моррис [30], внеся некоторые изменения в состав нингидринового реактива, позволяющие получать более стабильные результаты и к тому же упрощающие методику.
Фактический предел детектирования ниже и до некоторой степени зависит от условий высушивания после нанесения нингидринового реактива.
Пробу ( 0 5 мл), если необходимо, разбавляют буфером еще до 2 мл и смешивают с 2 мл нингидринового реактива.
Петри; 7) NaHCO3; 8) 5 % — ная PbNO3 или РЬ ( СН3СОО) 2; 9) реактив Сальковского; 10) реактив Эрлиха; 11) нингидриновый реактив; 12) реактив Несслера; 13) гумусная почва; 14) свежие листья люпина или засушенные листья других бобовых; 15) рыбная, м