Что окисляется при дыхании
Что окисляется при дыхании
Дыхание — это окисление органического вещества, являющегося субстратом дыхания. Субстратами для дыхания служат углеводы, жиры и белки.
Углеводы. При наличии углеводов большинство клеток использует в качестве субстратов именно их. Полисахариды (крахмал у растений и гликоген у животных и грибов) вовлекаются в процесс дыхания лишь после того, как они будут гидролизованы до моносахаридов.
Липиды (жиры или масла). Липиды составляют «главный резерв» и пускаются в дело в основном тогда, когда запас углеводов исчерпан. Предварительно они должны быть гидролизованы до глицерола и жирных кислот. Жирные кислоты богаты энергией и некоторые клетки, например мышечные, в норме получают именно от них часть необходимой им энергии.
Белки. Поскольку белки выполняют ряд других важных функций, они используются для производства энергии лишь после того, как будут израсходованы все запасы углеводов и жиров, например при длительном голодании (разд. 8.9.3). Белки предварительно гидролизуются до аминокислот, а аминокислоты дезаминируются (лишаются своих аминогрупп). Образовавшаяся в результате дезаминирования кислота вовлекается в цикл Кребса или превращается сначала в жирную кислоту, чтобы затем подвергнуться окислению.
Главную роль в клеточном дыхании играют два типа реакций — окисление и декарбоксилирование.
Окисление
В клетке происходят окислительные реакции трех типов.
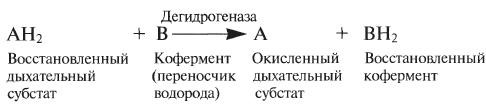
1. ОКИСЛЕНИЕ МОЛЕКУЛЯРНЫМ КИСЛОРОДОМ.
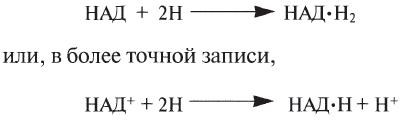
2. ОТЩЕПЛЕНИЕ ВОДОРОДА (ДЕГИДРИРОВАНИЕ). При аэробном дыхании окисление глюкозы происходит путем последовательных реакций дегидрирования. Отщепляемый при каждом дегидрировании водород используется для восстановления кофермента, называемого в этом случае переносчиком водорода:
Большая часть этих реакций происходит в митохондриях, где переносчиком водорода служит обычно кофермент НАД (никотинамидадениндинуклеотид):
НАД*Н (восстановленный НАД) затем вновь подвергается окислению с высвобождением энергии. Ферменты, катализирующие реакции дегидрирования, называются дегидрогеназами. В ряде последовательных реакций дегидрирования весь отщепляемый от глюкозы водород передается переносчикам водорода. Этот водород окисляется затем кислородом до воды, а высвобождаемая при этом энергия используется для синтеза АТФ. Феномен выделения энергии при окислении (горении) водорода можно наблюдать, если поднести горящую свечку к пробирке с водородом. При этом раздастся легкий короткий хлопок, вроде миниатюрного взрыва. В клетке выделяется такое же количество энергии, но выделяется оно в ряде окислительно-восстановительных реакций при переходе водорода от одного переносчика к другому по так называемой дыхательной цепи.
3. ПЕРЕНОС ЭЛЕКТРОНОВ. Это происходит, например, при переходе одной ионной формы железа (Fe2+) в другую (Fe3+)
Электроны могут передаваться от одного соединения к другому, как водород в реакциях описанных выше. Соединения, между которыми совершается этот перенос, называются переносчиками электронов. Протекает этот процесс в митохондриях.
Декарбоксилирование
Декарбоксилирование — это отщепление углерода от данного соединения с образованием СО2. В молекуле глюкозы, помимо водорода и кислорода, содержится еще шесть атомов углерода. Поскольку для описанных выше реакций нужен только водород, углерод удаляется в реакциях декарбоксилирования. Образующийся при этом диоксид углерода представляет собой «побочный продукт» аэробного дыхания.
Что окисляется при дыхании
Все биологические процессы, происходящие в окружающем мире, по своей сути являются химическими реакциями. Первую химическую реакцию человек осуществил, когда разжег костер – это реакция горения. Первое антибактериальное применение продуктов брожения и величайшее открытие в области медицины совершил Нострадамус. Большинство из нас знает его как предсказателя, но его основная заслуга состоит в том, что он нашел способ борьбы с чумой с помощью уксусной кислоты. История свидетельствует, чума лишила Нострадамуса и первой семьи, и друзей. С тех пор он искал средство борьбы от страшной болезни. Найдя чудо-лекарство, исследователь переезжал из города в город, где появлялась чума, спасая множество жизней [1].
Первым биохимиком была клетка, которая научилась энергетическому обмену: научилась поглощать свет и выделять энергию, необходимую для жизнеобеспечения. Таким образом, первый биохимик – это и есть сама жизнь. Все процессы, которые протекают в клетках живого организма, – это биохимические реакции.
Название «углеводы» появилось из-за того, что многие представители данного класса имеют общую формулу: Сn(Н2О)m, где n и m >= 4. Известно множество углеводов, не соответствующих этой формуле, но несмотря на это термин «углеводы» употребляется и по сей день. Другое общепринятое название этого класса соединений – сахара.
Все углеводы можно разделить на четыре больших класса.
Моносахариды – это гетерофункциональные соединения, содержащие оксогруппу и несколько гидроксильных групп. Они не могут быть гидролизованы до более простых форм углеводов и являются структурной единицей любых углеводов, например, глюкоза, фруктоза, рибулоза, рамноза. Содержатся в различных продуктах: фрукты, мёд, некоторые виды вина, шоколад.
Олигосахариды – это соединения, построенные из нескольких остатков моносахаридов, связанных между собой гликозидной связью. Они делятся по числу моносахаридов в молекуле на дисахариды, трисахариды и т.д. К биологически активным производным олигосахаридов относятся некоторые антибиотики, сердечные гликозиды.
Дисахариды – это углеводы, которые при гидролизе дают две одинаковые или различные молекулы моносахарида и связаны между собой гликозидной связью, например, лактоза, сахароза, мальтоза. При гидролизе из дисахаридов образуется глюкоза.
Полисахариды – имеют общий принцип строения с олигосахаридами, за исключением моносахаридных остатков – полисахариды могут содержать их сотни и даже тысячи. Примеры: крахмал, гликоген, хитин, целлюлоза [2].
Для лучшего понимания реакций расщепления углеводов в организме, рассмотрим более подробно глюкозу, участвующую в этих процессах.
Глюкоза является одним из самых распространенных углеводов в природе, моносахарид, или гексоза С6Н12О6. Второе её название – виноградный сахар. Это растворимое в воде вещество белого цвета, сладкое на вкус. В молекуле глюкозы имеется четыре неравноценных асимметрических атома углерода (рис. 1):
Рис. 1. Строение молекулы глюкозы
Для такого соединения возможно 24 = 16 стереоизомеров, которые образуют 8 пар зеркальных оптических антиподов. Каждое из восьми соединений представляет собой диастереомер (диа – двойной) с присущими только ему физическими свойствами (растворимость, температура плавления и т.д.).
Глюкоза содержится в растительных и живых организмах. Велико ее содержание в виноградном соке, в меде, фруктах и ягодах, в семенах, листьях крапивы. Глюкоза повышает работоспособность мозга, благотворно влияет на нервную систему человека. Именно поэтому в стрессовых ситуациях люди иногда хотят чего-нибудь сладкого. Помимо этого, глюкоза применяется в медицине для приготовления лечебных препаратов, консервирования крови, внутривенного вливания и т.д. Она широко применяется в кондитерском производстве, производстве зеркал и игрушек (серебрение). Ее используют при окраске тканей и кож.
Биохимические реакции расщепления углеводов в организме человека
Для поддержания жизнедеятельности организма используется энергия, скрытая в химических связях продуктов питания. Во многих продуктах питания содержится значительное количество углеводов в виде полисахаридов (сахар, крахмал, клетчатка) и моноз (глюкоза, фруктоза, лактоза и др.). К примеру, в картофеле содержание крахмала составляет до 16 %, в рисе – 78 %, а в белом хлебе – 51 %.
Уже во рту человека начинается процесс расщепления углеводов. Происходит гидролиз крахмала под действием биологического катализатора – фермента амилазы, который содержится в пище. Под действием амилазы молекула крахмала расщепляется на довольно короткие цепочки, которые состоят из глюкозных звеньев. После этого углеводы попадают в желудок. Далее под действием желудочного сока заканчивается кислотный гидролиз крахмала. Крахмал распадается до отдельных глюкозных звеньев. Глюкоза попадает в кишечник и через стенки кишок поступает в кровь, разносящую её по всему человеческому организму.
Содержание глюкозы в крови поддерживается на постоянном уровне при помощи гормона инсулина, который выделяется поджелудочной железой. Инсулин полимеризует избыточную глюкозу в животный крахмал – гликоген, который откладывается в печени. Часть гликогена в печени может гидролизоваться в глюкозу, далее поступающую обратно в кровь. Это происходит при понижении содержания глюкозы в крови. Если поджелудочная железа не может вырабатывать инсулин, содержание глюкозы в крови повышается, что приводит к диабету. Именно поэтому людям, болеющим сахарным диабетом, необходимо регулярно вводить в кровь инсулин.
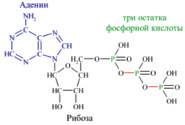
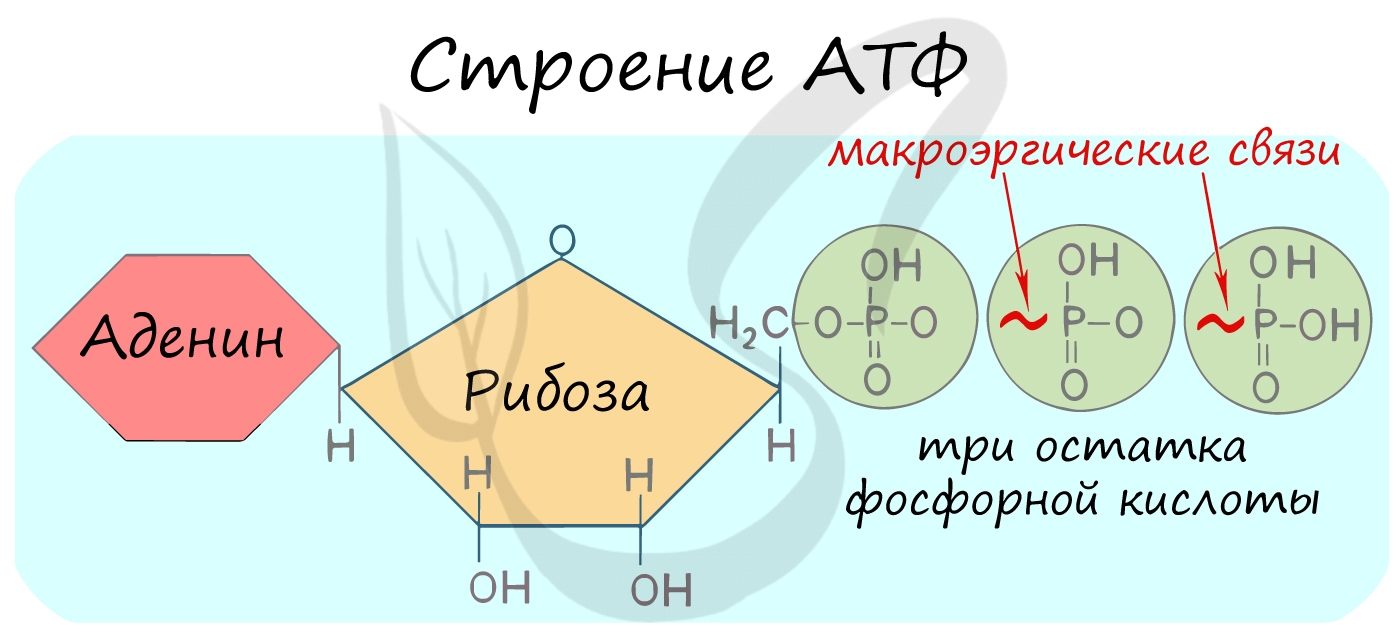
Молекула глюкозы, попадая в клетку организма, окисляется, «сгорает» с образованием воды и диоксида углерода. При этом выделяется энергия, необходимая организму для движения, согревания, осуществления различных физических нагрузок и т.д. Но биологическое окисление глюкозы похоже на обычное горение лишь по своим конечным результатам. Биологическое окисление – процесс медленный, многоступенчатый. Только малая часть высвобождаемой при окислении энергии превращается на каждой стадии данного процесса в тепло. Значительная доля энергии, заключенной в химических связях глюкозы, расходуется на образование других веществ, из которых важнейшее в биоэнергетике – аденозинтрифосфорная кислота C10H16N5O13P3 (АТФ). Это соединение состоит из трех частей – гетероцикла аденина, рибозы (сахара) и трех остатков фосфорной кислоты, образующей с рибозой сложный эфир (рис.2).
Рис. 2. Структура аденозинтрифосфорной кислоты
АТФ в клетках – универсальная энергетическая валюта. Множество ферментов умеют вести химические реакции, осуществляющиеся с затратой энергии, за счет гидролитического отщепления одного или двух остатков фосфорной кислоты от молекулы АТФ (этот процесс сопровождается выделением энергии), или наоборот, умеют использовать энергию, которая высвобождается в реакциях с выделением энергии для того, чтобы АТФ образовалась. Расщепляя АТФ, клетка использует высвобождаемую энергию на биосинтез различных соединений, а окисляя углеводы – синтезирует АТФ.
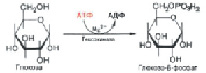
Первая стадия «сгорания» глюкозы в клетке – взаимодействие глюкозы с АТФ (рис. 3). При этом АТФ переходит в АДФ (аденозиндифосфат C10H15N5O10P2), а глюкоза – в 6-фосфат. Этот процесс фосфорилирования происходит под действием фермента гексокиназы за счет перенос остатка фосфорной кислоты (H3PO4) от фосфорилирующего агента – донора к субстрату:
Рис. 3. Взаимодействие глюкозы с АТФ
Следующий этап окисления – «рокировка» глюкозофосфата во фруктозофосфат, который происходит под действием фермента изомеразы (рис.4). Рокировка типа глюкоза–фруктоза делает доступным для фосфорилирования еще один гидроксил сахара (т.к. взаимодействовать с АТФ могут только краевые гидроксилы):
Рис. 4. Взаимодействие глюкозо-6-фосфата и фермента изомеразы
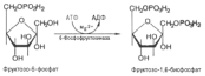
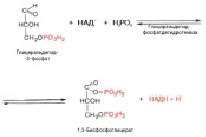
После второго фосфорилирования уже под действием другого фермента – фосфорфруктокиназы – получается в итоге фруктозо-1,6-дифосфат (C6H14O12P2 ) (рис.5):
Рис. 5. Взаимодействие фруктозо-6-фосфата и 6-фосфоруктокиназы
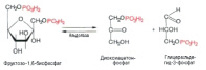
Фруктозо-1,6-дифосфат распадается на две части. Получается дигидроксиацетонфосфат ( C3H7O6P ) и глицеральдегид-3-фосфат ( C3H7O6P) (рис. 6).
Рис. 6. Распад Фруктозо-1,6-дифосфата
Клетке нужен только второй продукт, и она с помощью фермента изомеразы превращает первый фосфат во второй (чтобы не было отходов производства) (рис. 7).
Рис. 7. Превращение диоксиацетон-фосфата в глицеральдегид-3-фосфат
На данной стадии в реакцию вступают два соединения: глутатион – соединение, несущее меркаптогруппу SН и никотинамидаденинуклеотид (НАД). НАД легко присоединяет водород: НАД-Н2.
Далее развивается процесс, мало изученный в деталях, но описать его можно пока следующим образом. Под действием НАД и его восстановленной формы, фермента дегидрогеназы и фосфорной кислоты, глицеральдегид-3-фосфат превращается в смешанный ангидрид 3-фосфоглицериновой и фосфорной кислот (рис. 8).
Рис. 8. Превращение глицеральдегид-3-фосфата в смешанный ангидрид 3-фосфоглицериновой и фосфорной кислот
Всё это время энергия только поглощалась, так как АТФ переходил в АДФ. Теперь в реакции будет вступать АДФ, а в продуктах появится АТФ, и энергия будет выделяться. Так, под действием АДФ и фермента фосфоглицераткиназы образуется 3-фосфоглицериновая кислота (рис. 9).
Рис. 9. Образование 3-фосфоглицерата
В ней фермент фосфоглицеромутаза вызывает «рокировку» фосфатной группы в положение 2 (рис. 10).
Рис. 10. Превращение 3-фосфоглицерата в 2-фосфоглицерат
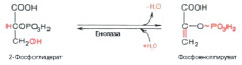
На полученный продукт воздействует фермент енолаза и АДФ – получается пировиноградная кислота (рис. 11, 12).
Рис. 11. Дегидратация 2-фосфоглицерата
Рис. 12. Перенос фосфорильной группы с фосфоенолпирувата на АДФ. Образование пирувата
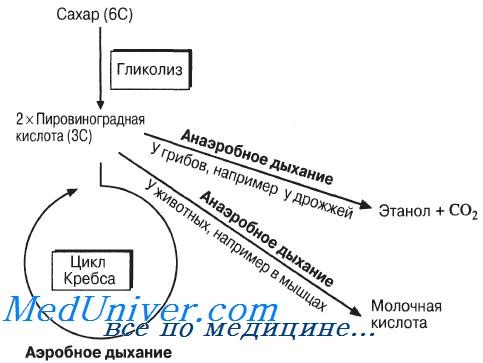
Процесс превращения глюкозы в пировиноградную кислоту в клетке называется гликолизом [3]. В результате гликолиза клетка получает из одной молекулы глюкозы восемь молекул АТФ и две молекулы пировиноградной кислоты. Превращение глюкозы в пировиноградную кислоту является первой стадией, общей для нескольких процессов. То же самое происходит под действием дрожжей на раствор сахара. Но реакция не закачивается получением пировиноградной кислоты. От этой кислоты отщепляется (под действием фермента декарбоксилазы) молекула диоксида углерода и образуется уксусный альдегид, который, в свою очередь, атакуется ферментом дегидрогеназой и НАД-Н2. В результате при отсутствии кислорода получается этиловый спирт.
На самом деле уравнение этого сложного процесса выглядит довольно просто:
С6Н12О6 à 2С2Н5ОН + 2СО2
Это и есть процесс брожения. В мышцах НАД-Н2 восстанавливает пировиноградную кислоту в молочную. Это происходит при большой нагрузке, когда кровь не успевает подводить кислород в нужном количестве. Поэтому у спортсменов, пробежавших дистанцию, резко увеличивается в крови количество молочной кислоты [4].
Ферменты – это биологические катализаторы, имеющие белковую природу, помогающие ускорить химические реакции как в живых организмах, так и вне их. Ферменты обладают высокой каталитической активностью. К примеру, чтобы расщепить молекулу полиуглевода (крахмал, целлюлозу) или какой – либо белок на составные части, их нужно несколько часов кипятить с крепкими растворами щелочей либо кислот. А ферменты пищеварительных соков (пепсин, протеаза, амилаза) способны гидролизовать эти вещества буквально за несколько секунд при температуре 37 °С. Помимо этого, ферменты обладают избирательностью своего действия в отношении структуры субстрата, условий проведения реакции и её типа (фермент превращает только данный тип субстратов в определенных реакциях и условиях). Ферменты катализируют огромное количество реакций, протекающих в живой клетке при размножении, дыхании, обмене веществ и т.д. [5].
В современном понимании биохимическое расщепление углеводов – это метаболический процесс, при котором регенерируется АТФ, а продукты расщепления органического субстрата могут служить одновременно и донорами, и акцепторами водорода. Огромную роль в биохимических процессах играют микроорганизмы, ферменты и катализаторы. Считается, что анаэробный гликолиз (расщепление углеводов) был первым источником энергии для общих предков всех живых организмов до того, как концентрация кислорода в атмосфере стала достаточно высокой, и поэтому эта форма генерации энергии в клетках – более древняя. За очень редкими исключениями она существует и у всех ныне живущих клеток.
В настоящее время ученые считают, что все реакции биохимического расщепления углеводов на начальной стадии имеют общую схему вплоть до образования пировиноградной кислоты. Затем, в зависимости от условий и качества ферментов, из пировиноградной кислоты образуются конечные продукты реакции: спирты, кислоты (уксусная, лимонная, молочная, яблочная, масляная и т.д.), альдегиды, углекислый газ, водород, вода и пр.
Изучение биохимических реакций расщепления углеводов в организме человека и анализ использованных источников позволили сделать следующие выводы:
1. В общем виде схему механизма расщепления углеводов можно представить следующим образом: сложный углевод (дисахарид, полисахарид) à глюкоза à эфиры фосфорных кислот à глицериновый альдегид à глицериновая кислота à пировиноградная кислота à далее возможны любые упомянутые выше направления.
2. Биохимические реакции углеводов лежат в основе жизнедеятельности клеток живых организмов, в том числе и человека.
3. Биохимические процессы расщепления углеводов, которые изображаются простыми, на первый взгляд, уравнениями начальных и конечных продуктов, на самом деле представляют собой сложные и многоступенчатые процессы.
4. Для осуществления биохимических процессов необходимы ферменты и катализаторы, которые ускоряют реакции расщепления углеводов в тысячи раз.
Изучая сложнейшие процессы, происходящие в живой клетке, ученые задумываются: а нельзя ли, научившись у природы, провести в колбах и ретортах искусственные химические процессы, копирующие биохимические реакции? Начатые по инициативе академика Н.Н. Семенова, такие исследования в области «химической бионики» успешно ведутся в России и во всем мире [6].
Энергетический обмен
Обмен веществ
Энергетический обмен
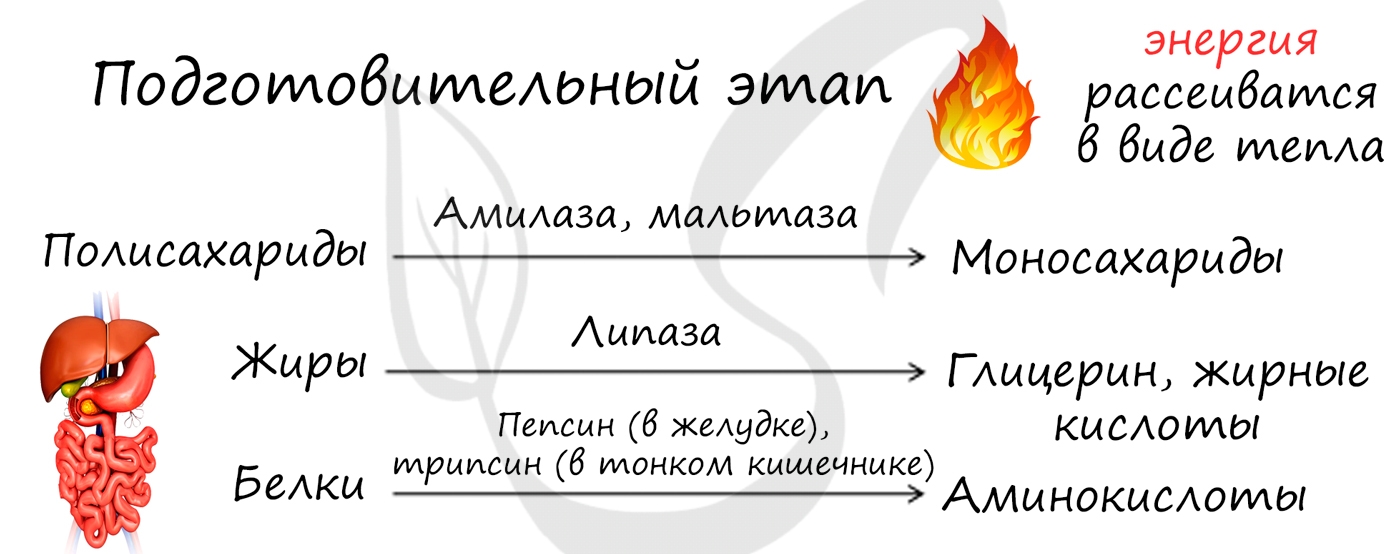
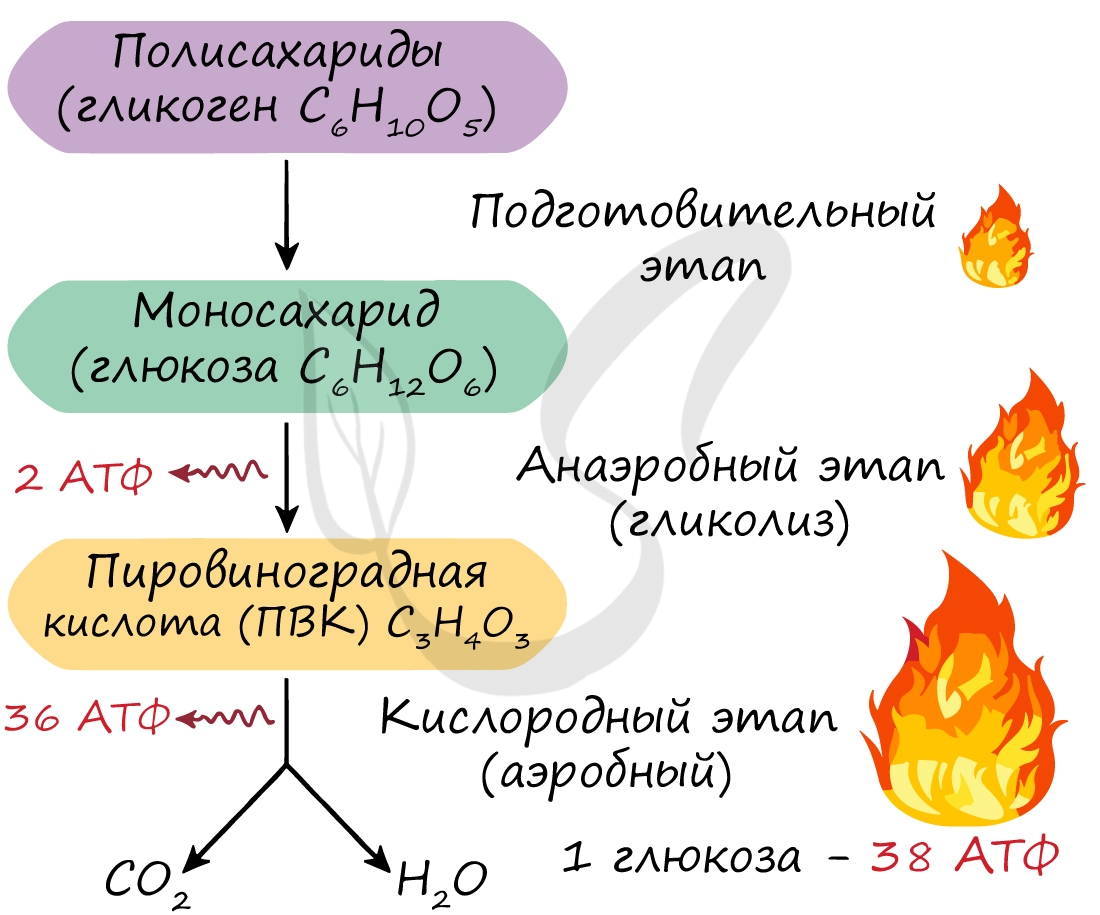
Возможно три этапа диссимиляции: подготовительный, анаэробный и аэробный. Среда обитания определяет количество этапов диссимиляции. Их может быть три, если организм обитает в кислородной среде, и два, если речь идет об организме, обитающем в бескислородной среде (к примеру, в кишечнике).
Подготовительный этап осуществляется ферментами в ЖКТ. В результате действия ферментов сложные вещества превращаются в более простые: полимеры распадаются на мономеры. Это сопровождается разрывом химических связей и выделением энергии, большая часть которой рассеивается в виде тепла.
Этот этап является последним для организмов-анаэробов, обитающих в условиях, где кислород отсутствует. На этапе гликолиза происходит расщепление молекулы глюкозы: образуется 2 молекулы АТФ и 2 молекулы пировиноградной кислоты (ПВК). Происходит данный этап в цитоплазме клеток.
Таким образом, суммарно с одной молекулы глюкозы можно получить 38 АТФ (гликолиз + кислородный этап).
Кислородный этап протекает на кристах митохондрий (складках, выпячиваниях внутренней мембраны), где наибольшая концентрация окислительных ферментов. Главную роль в этом процессе играет так называемый цикл Кребса, который подробно изучает биохимия.
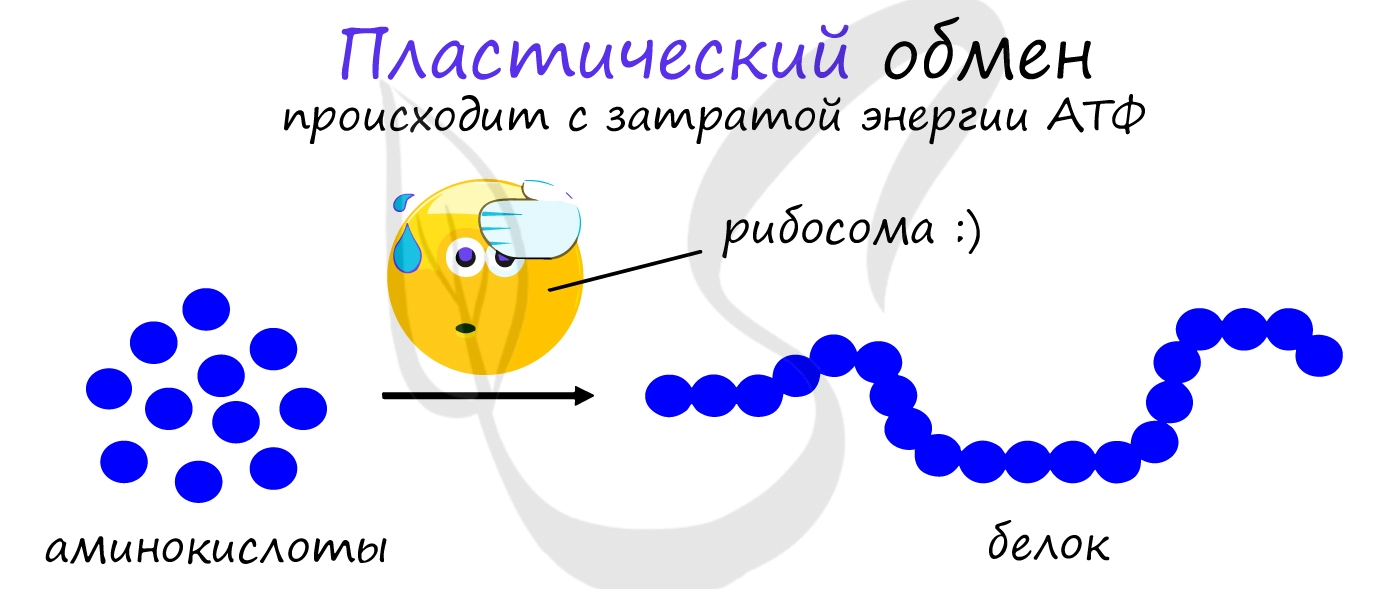
Пластический обмен
АТФ является универсальным источником энергии в клетке: энергия макроэргических связей АТФ используется для реакций пластического обмена (ассимиляции), протекающих с затратой энергии: синтеза белка на рибосоме (трансляции), удвоению ДНК (репликации) и т.д.
В результате пластического обмена в нашем организме происходит синтез белков, жиров и углеводов.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что окисляется при дыхании
8.1. Этиология и патогенез брадипноэ, гиперпноэ, тихипноэ, апноэ
Как известно, внешнее дыхание представляет собой процесс газообмена между внешней средой и альвеолярным воздухом, а также между альвеолами и притекающей к легким кровью (альвеолярное дыхание). Различают следующие виды нарушения внешнего дыхания:
Брадипноэ – редкое дыхание, которое возникает при поражении и угнетении дыхательного центра на фоне гипоксии, отека, ишемии и воздействия наркотических веществ, а также при перерезке n. vagus, несостоятельности хеморецепторного аппарата. При сужении крупных воздухоносных путей отмечается редкое и глубокое дыхание – стенотическое. Повышение артериального давления вызывает рефлекторное снижение частоты дыхательных движений (рефлекс с барорецепторов дуги аорты).
Гиперпноэ – глубокое и частое дыхание, отмечается при мышечной работе, гиперкапнии и высокой концентрации Н+, эмоциональном напряжении, тиреотоксикозе, анемии, ацидозе, снижении содержания кислорода во вдыхаемом воздухе (рефлекс с центральных и периферических хеморецепторов, проприорецепторов дыхательных мышц, с БАР воздухоносных путей и т.д.).
Тахипноэ – частое поверхностное дыхание. Возникает вследствие выраженной стимуляции дыхательного центра при гиперкапнии, гипоксемии и повышении концентрации ионов Н+(рефлекс с хемо-рецепторов, БАР и МАР воздухоносных путей и паренхимы легких). Этот вид дыхания наблюдается при лихорадке, пневмониях, застое в легких, ателектазе и т.п. Тахипноэ способствует развитию альвеолярной гиповентиляции в результате преимущественной вентиляции мертвого пространства.
Апноэ – отсутствие дыхательных движений наблюдается при гипокапнии, снижении возбудимости дыхательного центра вследствие поражения головного мозга, экзо- и эндоинтоксикаций, действия наркотических веществ.
Апнейстическое дыхание характеризуется судорожным усиленным удлиненным вдохом, который редко прерывается выдохом. Такой вид дыхания можно воспроизвести в эксперименте после перерезки у животного обоих блуждающих нервов и ствола на границе между верхней и средней третью моста.
Гаспинг-дыхание характеризуется редкими, глубокими, убывающими по силе “вздохами”, возникает в терминальной фазе асфиксии. При данном виде дыхания работают только клетки каудальной части продолговатого мозга.
8.2. Периодическое дыхание (Чейна-Стокса, Биота) и терминальное дыхание (Куссмауля)
Дыхание Чейна-Стокса характеризуется чередованием групп дыхательных движений с нарастающей амплитудой и периодов апноэ (остановка дыхания). Следует отметить, что дыхание Чейна-Стокса может встречаться не только в условиях патологии, но и в норме: у здоровых людей во сне, у недоношенных детей с незрелой системой регуляции дыхания, в старческом возрасте (когда имеется повышение порога возбудимости дыхательного центра).
Дыхание Биота характеризуется чередованием периодов апноэ с группами дыхательных движений равной амплитуды (рис.12).
В основе развития периодического дыхания Чейна-Стокса и Биота лежит снижение возбудимости дыхательного центра под влиянием экзогенных и эндогенных патогенных факторов, возникающее, в частности, при острой и хронической гипоксии, действии механической травмы мозга, развитии отека мозга, при аутоинтоксикациях (при сахарном диабете, почечной недостаточности, печеночной недостаточности), а также, на фоне развития коматозных состояний, воспалительного процесса, опухолевого поражения продолговатого мозга, при нарушениях мозгового кровообращения.
При дыхании Чейна-Стокса и Биота адекватные в условиях нормы гуморальные и нервные раздражители не оказывают стимулирующего влияния на бульбарный дыхательный центр Активация нейронов бульбарного дыхательного центра возникает лишь на фоне воздействия сверхпороговой афферентации с центральных и периферических хеморецепторов при возрастании РСО2, [H+] и снижении РаО2 по сравнению с показателями нормы.
В случаях развития дыхания Чейна-Стокса, несмотря на снижение возбудимости бульбарного дыхательного центра, возникает повышение активности бульбарных инспираторных нейронов на фоне дополнительной афферентации, возникающей в момент первых дыхательных движений с рецепторов воздухоносных путей, проприорецепторов дыхательных мышц и сухожильных рецепторов. Последнее приводит к углублению дыхания. Увеличение глубины дыхательных движений сопровождается нормализацией газового состава крови, когда дыхательный центр вновь оказывается нечувствительным к нормальным по силе гуморальным воздействиям. При этом вновь возникает апноэ, сопровождающееся развитием гипоксии, повышением концентрации РСО2 и [H+] сверх нормальных пороговых величин, вновь обеспечивающих гуморальную стимуляцию бульбарных инспираторных нейронов.
В случае развития дыхания Биота также имеет место снижение чувствительности нейронов бульбарного дыхательного центра к адекватным стимулирующим влияниям с хеморецепторов, их активация возникает лишь при воздействии сверхпороговых гуморальных раздражителей. Однако в случае развития дыхания Биота, в отличие от дыхания Чейна-Стокса, инспираторные нейроны дыхательного центра не реагируют повышением активности на дополнительную стимулирующую афферентацию, возникающую при первых дыхательных движениях с рецепторов воздухоносных путей, паренхимы легких, проприорецепторов дыхательных мышц и сухожильных рецепторов. В связи с этим амплитуда дыхательных движений не изменяется.
8.3. Одышка: виды и механизмы развития
1. Усиление стимулирующей афферентации в бульбарный дыхательный центр (с механорецепторов воздухоносных путей, с МАР растяжения альвеол, с рецепторов спадения, юкстакапиллярных рецепторов, проприорецепторов, а также с висцеральных рецепторов и рецепторов болевой, термической чувствительности).
2. Усиление рефлекторных влияний с барорецепторов аорты и каротидных синусов. Эти рецепторы включаются в патогенез одышки при кровопотере, шоке, коллапсе. При артериальном давлении ниже 70 мм рт. ст. (9,1 кПа и меньше) уменьшается поток импульсов, оказывающих тормозное влияние на центр вдоха.
3. При снижении в крови напряжения О2, увеличении СО2 или возрастании концентрации ионов [H+] возникают усиление афферентации с центральных и периферических хеморецепторов в бульбарный дыхательный центр, активация инспирации (сердечная недостаточность, дыхательная недостаточность, почечная недостаточность, анемии, нарушения КОС различного генеза).
4. Ощущение недостаточности дыхания может возникнуть при чрезмерном растяжении межреберных мышц (например, при тяжелой физической работе, уменьшении эластичности легких, сужении верхних дыхательных путей), когда возбуждаются проприорецепторы мышц, импульсация с которых поступает в высшие отделы головного мозга.
5. Стимуляция дыхательного центра и ощущение недостаточности воздуха имеет место при локальных нарушениях мозгового кровообращения (спазм, тромбоз сосудов мозга, эмболия, развитие деструктивных изменений инфекционного, аллергического и другого происхождения).
В случаях развития рестриктивных нарушений вентиляции легких (например, при бронхиальной астме, отеке легких, пневмофиброзе легочной ткани и т.д.), когда снижается эластичность легочной ткани и значительно затрудняется растяжение альвеол под влиянием физиологического объема вдыхаемого воздуха, с МАР растяжения альвеол длительное время поступает низкочастотная афферентация в бульбарный дыхательный центр. Последняя приводит к длительной стимуляции бульбарных инспираторных нейронов и удлинению акта вдоха, т.е. развитию инспираторной одышки.
При развитии обструктивной формы дыхательной недостаточности, в основе которой лежит нарушение проходимости воздухоносных путей, особенно в случаях развития бронхоспазма при атопической и инфекционной бронхиальной астме, возникает резкое затруднение удаления воздуха из альвеол в окружающую среду. При этом альвеолы длительное время находятся в перерастянутом состоянии. С МАР растяжения альвеол длительное время поступает высокочастотная импульсация в бульбарный дыхательный центр, пессимальная для инспираторных нейронов, что препятствует развитию акта вдоха и, соответственно, обеспечивает пролонгирование фазы экспирации, т.е. развитие экспираторной одышки.
Следует отметить, что выделение инспираторной и экспираторной одышки в определенной степени относительно, поскольку нередко одышка, начинаясь как инспираторная или экспираторная, достаточно быстро приобретает смешанный инспираторно-экспираторный характер.