Что нельзя кушать при опоясывающем герпесе
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
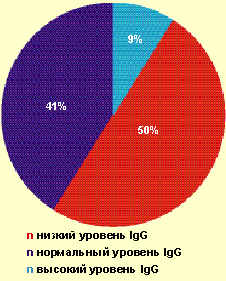 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
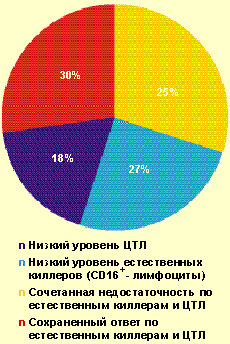 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Герпетическая инфекция. Профилактика.

Инфекция, вызванная герпесвирусами, распространена повсеместно. Инфицированность населения очень высокая. По данным Всемирной организации здравоохранения (ВОЗ) герпесвирусная инфекция занимает второе место среди вирусных заболеваний человека, уступая лишь гриппу.
Восприимчивость к инфекции всеобщая, независимо от пола и возраста.
Подъемы заболевания регистрируются в осенне-зимний период.
Проведенные за последние 10 лет эпидемиологические исследования показали, что к 15-летнему возрасту инфицировано 80% детей, а к 30 годам 90% населения имеют антитела к вирусам того или иного типа.
Возбудитель инфекции – вирус герпеса, включающий более 70 представителей, из которых наибольшую патогенность для человека имеют вирусы простого герпеса 1 и 2 типа (ВПГ 1 или ВПГ 2), вирус ветряной оспы, опоясывающего герпеса, цитомегаловирус (ЦМВ), вирус Эпштейна-Барр, вирус герпеса человека 6 типа, вирус герпеса человека 7 типа.
Попадая в клетку – вирус вызывает ее гибель. В отдельных клетках вирус может сохраняться длительное время, но при последующей активации вируса, клетка погибнет.
Вирусы простого герпеса неустойчивы к действию физических и химических факторов, легко разрушаются под действием ультрафиолетовых и рентгеновских лучей, чувствительны к этиловому спирту, эфиру. При низких температурах (-20-70 о С) вирус сохраняется десятилетиями.
Источники инфекции – вирусоносители и больные с различными формами болезни.
Пути передачи инфекции:
Факторами передачи вируса являются: слюна, кровь, слезная жидкость, сперма, секрет влагалища и цервикального канала, различные органы и ткани, используемые при трансплантации, моча, медицинский инструментарий.
Попадает вирус в организм через поврежденные участки кожи и слизистой, затем, в месте внедрения вируса происходит размножение вирусных частиц. Первичное инфицирование вызывает латентную (скрытую, вялотекущую) инфекцию.
Клиническая картина.
Клинические проявления герпетической инфекции отличаются значительным разнообразием. Они зависят от локализации поражения, распространенности, состояния иммунной системы, типа вируса, а также от механизма заражения.
По локализации поражения:
Генитальный герпес развивается у молодых людей после начала половой жизни. Первичный генитальный герпес отличается более тяжелым и продолжительным течением. Высыпания обильные и занимают большую площадь поражения. При первичном генитальном герпесе отмечается повышение температуры, общая слабость, раздражительность. В области гениталий появляются везикулезные высыпания, сохраняющиеся до 8 суток.
Влияние вируса простого герпеса на беременность и роды.
Первичное инфицирование и рецидивы во время беременности могут привести к мертворождению, выкидышам, а также к формированию пороков у плода. Наиболее опасно заражение в третьем триместре.
При первичном инфицировании матери во время беременности инфицирование плода происходит в 5% случаев. Чаще всего инфицирование ребенка происходит во время родов (85%) или после родов (10%).
Инфицирование ребенка ВПГ во время родов может стать причиной последующего развития герпетической инфекции новорожденного.
Основную опасность представляет выделение вируса со слизистой половых органов в момент родов. Выделение вируса может сопровождаться высыпаниями в области половых органов, а может и не сопровождаться никакими симптомами.
Последствия герпесвирусной инфекции для ребенка:
Профилактика герпесвирусной инфекции:
Важным принципом профилактики этого заболевания является прекращение близких контактов с больным человеком в период обострения.
Для того чтобы не допустить распространения заболевания на другие части тела рекомендуется:
Профилактика ВПГ-1 сводится к соблюдению общих правил предупреждения респираторных заболеваний. Профилактика ВПГ-2 соответствует профилактике инфекций передающихся половым путем (использование презервативов во время половых контактов), использование антисептических растворов после полового акта.
Профилактика инфицирования во время беременности:
Укрепление иммунитета.
Профилактика обязательно должна быть направлена на укрепление иммунитета, ведь при его ослаблении заболевание обязательно даст о себе знать снова. Переутомления, плохое питание, вредные привычки – все это может стать повторной причиной развития герпеса. Именно поэтому такие ситуации важно не допускать.
Прежде всего, обратите внимание на работу своего желудочно-кишечного трака, ведь все иммунные процессы берут свое начало именно отсюда. Деятельность его будет нормальной только при полноценной работе желчного пузыря.
Ослабнуть иммунитет может при длительном приеме лекарственных препаратов, особенно антибиотиков. По возможности их нужно заменять иными средствами. Так, например, для повышения иммунитета может применяться настойка эхинацеи, купить ее можно в аптеке. Отвар шиповника также оказывает укрепляющее действие на организм.
Главный метод, позволяющий повысить иммунитет – правильное питание. Поэтому если на ваших губах постоянно появляется герпес следует обратить внимание на свой рацион питания.
Должны присутствовать следующие продукты:
Не забывайте о сое, пивных дрожжах, они также полезны как при профилактике, так и в момент лечении. Есть также и те продукты, употреблять которые ни в коем случае нельзя: сахар, говядина, орехи.
Человеку, в период обострения, то есть когда появляются высыпания, рекомендуется больше времени проводить дома, ведь в этот момент есть большая опасность для окружающих.
Опоясывающий герпес и герпес-ассоциированная боль
Опоясывающий герпес (ОГ) — спорадическое заболевание, представляющее собой реактивацию латентной вирусной инфекции, вызванной вирусом герпеса 3-го типа (Varicella zoster virus (VZV)). Заболевание протекает с преимущественным поражением кожи и нервной сист
Опоясывающий герпес (ОГ) — спорадическое заболевание, представляющее собой реактивацию латентной вирусной инфекции, вызванной вирусом герпеса 3-го типа (Varicella zoster virus (VZV)). Заболевание протекает с преимущественным поражением кожи и нервной системы.
VZV является этиологическим агентом двух клинических форм заболевания — первичной инфекции (ветряной оспы) и ее рецидива (опоясывающего герпеса). После перенесенной, как правило, в детском или подростковом возрасте первичной инфекции (ветряной оспы) вирус переходит в латентное состояние, локализуясь в чувствительных ганглиях спинномозговых нервов. Общность возбудителя ветряной оспы и опоясывающего лишая была установлена еще до выделения вируса с помощью серологических реакций, в которых в качестве антигена использовалась жидкость, полученная из пузырьков на коже пациентов. Позднее методом геномной гибридизации было доказано, что в остром периоде заболевания опоясывающим лишаем частота выявления VZV составляет 70–80%, а у лиц без клинических проявлений, но имеющих антитела, ДНК вируса определяется в 5–30% нейронов и глиальных клеток.
Распространенность опоясывающего лишая в различных странах мира составляет от 0,4 до 1,6 случаев заболевания на 1000 пациентов/в год в возрасте до 20 лет и от 4,5 до 11,8 случаев на 1000 пациентов/в год в старших возрастных группах. Вероятность заболевания опоясывающим лишаем в течение жизни составляет до 20%. Основным фактором риска его возникновения является снижение специфического иммунитета к VZV, возникающее на фоне различных иммуносупрессивных состояний.
Клиническая картина ОГ
Клиническая картина ОГ складывается из кожных проявлений и неврологических расстройств. Наряду с этим у большинства больных наблюдаются общеинфекционные симптомы: гипертермия, увеличение региональных лимфатических узлов, изменение ликвора (в виде лимфоцитоза и моноцитоза). Приблизительно 70–80% пациентов с ОГ в продромальном периоде предъявляют жалобы на боли в пораженном дерматоме, в котором впоследствии проявляются кожные высыпания. Продромальный период обычно длится 2–3 дня, но нередко превышает неделю. Высыпания при ОГ имеют короткую эритематозную фазу, часто она вообще отсутствует, после чего быстро появляются папулы. В течение 1–2 дней эти папулы превращаются в везикулы, которые продолжают появляться в течение 3–4 дней — везикулярная форма herpes zoster. На этой стадии на коже могут присутствовать элементы всех типов. Элементы склонны к слиянию. Пустулизация везикул начинается через неделю или даже раньше после появления первых высыпаний. Через 3–5 дней на месте везикул появляются эрозии и образуются корочки. Если период появления новых везикул длится более одной недели, это указывает на возможность наличия иммунодефицитного состояния. Корочки обычно исчезают к концу 3-й или 4-й недели. Однако шелушение и гипо- или гиперпигментация могут надолго оставаться после разрешения ОГ.
Болевой синдром является наиболее мучительным проявлением ОГ. У одних пациентов сыпь и боль имеют относительно короткую длительность, у 10–20% пациентов возникает постгерпетическая невралгия (ПГН), которая может длиться месяцы и годы, значительно снижает качество жизни, доставляет большие страдания, может приводить к потере независимости и сопровождается существенными финансовыми затратами. Эффективное лечение болевого синдрома, ассоциированного с ОГ, является важной клинической задачей.
Герпес-ассоциированная боль
Согласно современным представлениям болевой синдром при ОГ имеет три фазы: острую, подострую и хроническую. Если в острой фазе болевой синдром носит смешанный (воспалительный и нейропатический) характер, то в хронической фазе — это типичная нейропатическая боль (рис.). Каждая из перечисленных фаз имеет свои особенности лечения, основанные на патогенетических механизмах болевого синдрома и подтвержденные контролируемыми клиническими исследованиями.
Острая герпетическая невралгия
Боль при острой герпетической невралгии возникает как правило в продромальную фазу и длится в течение 30 дней — это время, необходимое для разрешения сыпи. У большинства пациентов появлению сыпи предшествует чувство жжения или зуд в определенном дерматоме, а также боль, которая может быть колющей, пульсирующей, стреляющей, носить приступообразный или постоянный характер. У ряда больных болевой синдром сопровождается общими системными воспалительными проявлениями: лихорадкой, недомоганием, миалгиями, головной болью. Определить причину боли на этой стадии крайне сложно. В зависимости от ее локализации дифференциальный диагноз следует проводить со стенокардией, межреберной невралгией, острым приступом холецистита, панкреатита, аппендицита, плевритом, кишечной коликой и др. Причина болевого синдрома становится очевидной после появления характерных высыпаний. В типичных случаях продромальный период длится 2–4 дней, не более недели. Интервал между началом продромального периода до появления высыпаний — это время, необходимое для репликации реактивированного VZV в ганглии и переноса по кожному нерву в нервные окончания в дермоэпидермальном соединении. Еще некоторое время занимает репликация вируса в коже с последующим образованием воспалительных реакций. Непосредственной причиной продромальной боли является субклиническая реактивация и репликация VZV в нервной ткани. В экспериментальных исследованиях на животных было показано, что в местах репликации VZV повышается концентрация нейропептида Y в нервной ткани, являющегося маркером нейропатической боли [1]. Присутствие выраженной боли в продромальном периоде увеличивает риск более выраженной острой герпетической невралгии и вероятность развития впоследствии постгерпетической невралгии.
У большинства иммунокомпетентных пациентов (60–90%) сильная, острая боль сопровождает появление кожной сыпи. Выраженность острого болевого синдрома увеличивается с возрастом. Сильная боль отмечается также чаще у женщин и при наличии продрома. Характерной особенностью острой герпетической невралгии является аллодиния — боль, вызванная действием неболевого стимула, например прикосновением одежды. Именно аллодиния в остром периоде является предиктором возникновения постгерпетической невралгии [2, 3]. Отсутствие аллодинии, наоборот, хороший прогностический признак и может предполагать выздоровление в течение трех месяцев.
Подострая герпетическая невралгия
Подострая фаза герпетической невралгии начинается после окончания острой фазы и длится до начала постгерпетическй невралгии. Другими словами, это боль, которая длится более 30 дней от начала продрома и заканчивается не позднее 120 дней (рис.). Подострая герпетическая невралгия может переходить в постгерпетическую невралгию. К факторам, предрасполагающим к продолжению боли, относят: более старший возраст, женский пол, наличие продрома, массивные кожные высыпания, локализация высыпаний в области иннервации тройничного нерва (особенно области глаза) или плечевого сплетения, сильную острую боль, наличие иммунодефицита [3, 4].
Постгерпетическая невралгия
Согласно определению Международного форума по лечению герпеса ПГН определяют как боль, длящуюся долее четырех месяцев (120 дней) после начала продрома. ПГН, особенно у пожилых пациентов, может длиться в течение многих месяцев или лет после заживления высыпаний. При ПГН можно выделить три типа боли: 1) постоянная, глубокая, тупая, давящая или жгучая боль; 2) спонтанная, периодическая, колющая, стреляющая, похожая на «удар током»; 3) боль при одевании или легком прикосновении у 90%.
Болевой синдром, как правило, сопровождается нарушениями сна, потерей аппетита и снижением веса, хронической усталостью, депрессией, что приводит к социальной изоляции пациентов.
ПГН рассматривают как типичную нейропатическую боль, возникающую в результате поражения или дисфункции соматосенсорной системы. В ее патогенезе участвует несколько механизмов.
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части пациентов она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания. ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов, у которых могут развиваться тревога и депрессия.
Как уменьшить риск ПГН?
Этот вопрос является наиболее важным для любого врача, занимающегося лечением пациента с ОГ, и включает раннее начало этиотропной (противовирусной) терапии и адекватное обезболивание в острой стадии.
Противовирусная терапия. Результаты многих клинических исследований показали, что назначение противовирусных препаратов уменьшает период вирусовыделения и образование новых очагов, ускоряет разрешение сыпи и уменьшает тяжесть и продолжительность острой боли у пациентов с ОГ. Так, в контролируемых исследованиях с использованием рекомендуемых дозировок время до полного прекращения болевого синдрома при назначении фамцикловира составило 63 дня, а при назначении плацебо — 119 дней. В другом исследовании была показана большая эффективность валацикловира по сравнению с ацикловиром: болевой синдром при назначении валацикловира (Валавира) исчезал полностью через 38 дней, а при назначении ацикловира через 51 день. Валацикловир и фамцикловир имеют сходный эффект на герпес-ассоциированную боль у иммунокомпетентных пациентов [13, 23]. Таким образом, противовирусная терапия показана не только для скорейшего купирования кожных проявлений, но и острой фазы болевого синдрома.
Во всех контролируемых клинических исследованиях по противовирусной терапии (табл.) рекомендуется начало терапии в течение 72 часов от начала высыпаний [1, 14].
Эффективность противоболевого действия противовирусной терапии, начатой в более поздние сроки, систематически не изучалась, однако многочисленные клинические данные говорят о том, что и поздно начатая терапия также может влиять на длительность и выраженность острого болевого синдрома.
Противоболевая терапия. Эффективное купирование острого болевого синдрома при ОГ является важнейшим этапом профилактики ПГН. Целесообразно поэтапное лечение зостер-ассоциированного болевого синдрома во всех его фазах. Так, при лечении острой и подострой герпетической невралгии противоболевая терапия состоит из трех основных этапов:
Учитывая, что в нашей стране имеются известные организационные трудности при назначении опиоидных анальгетиков, при недостаточной эффективности простых анальгетиков и НПВС необходимо переходить к назначению препаратов с центральным действием.
Лечение постгерпетической невралгии
В настоящее время выделяют 5 основных групп лечебных средств: антиконвульсанты, трициклические антидепрессанты, пластырь с лидокаином, капсаицин, опиоидные анальгетики [21].
Антиконвульсанты: габапентин и прегабалин — два наиболее часто используемых для купирования невропатической боли, связанной с ПГН, антиконвульсанта. Препараты чаще применяются в начале развития ПГН для уменьшения острого компонента невропатической боли. В одном из исследований [15] у пациентов, принимавших габапентин, у 43,2% уменьшилось восприятие боли при 12,1% в группе плацебо. В аналогичном испытании [16] прегабалин также способствовал уменьшению числа пациентов с ПГН, особенно в возрасте 65 лет и старше. По-видимому, габапентин и прегабалин одинаково эффективны в отношении уменьшения невропатической боли [17]. Габапентин является препаратом первого выбора для лечения любого типа невропатической боли, относится к числу наиболее хорошо изученных и широко используемых в практике невролога средств для купирования болевого синдрома при ПГН. Это структурный аналог гамма-аминомасляной кислоты (ГАМК). Габапентин усиливает синтез ГАМК, стимулируя активность глутаматдекарбоксилазы; модулирует активность NMDA-рецепторов; блокирует a-2-d-субъединицы потенциалзависимых кальциевых каналов и тормозит вход Са 2+ в нейроны; снижает высвобождение моноаминов и активность натриевых каналов; уменьшает синтез и транспорт возбуждающего нейромедиатора глутамата; способствует уменьшению частоты потенциалов действия периферических нервов. Концентрация габапентина в плазме крови достигает пика через 2–3 ч после приема, период полувыведения 5–7 ч. Интервал дозирования не должен превышать 12 ч, биодоступность составляет 60%. Прием пищи не влияет на фармакокинетику препарата, антациды снижают его концентрацию в крови, поэтому принимать габапентин следует не ранее чем через 2 ч после приема антацидов. Выводится с грудным молоком; действие препарата на организм ребенка не изучено. Крайне редко развиваются побочные реакции: легкое головокружение, сонливость. Габапентин усиливает эффект лидокаина и антидепрессантов. Следует воздерживаться от сочетания его с алкоголем, транквилизаторами, антигистаминными препаратами, барбитуратами, снотворными средствами, наркотиками. Препарат имеет важные преимущества при лечении невропатической боли: безопасность, низкий потенциал взаимодействия с другими препаратами, хорошая переносимость, он не метаболизируется в печени. Габапентин — препарат выбора для лечения пожилых людей при полифармакотерапии, удобен при использовании, доказана его высокая эффективность.
Схема применения габапентина. Начальная доза: 1-й день 300 мг вечером; 2-й день по 300 мг 2 раза (днем и вечером); 3-й день по 300 мг 3 раза. Титрование: 4–6 день 300/300/600 мг; 7–10 день 300/600/600 мг; 11–14 день 600/600/600 мг. Cуточная терапевтическая доза 1800–3600 мг, поддерживающая доза 600–1200 мг/сут.
Прегабалин обладает сходным с габапентином механизмом действия, однако не требует медленного титрования и поэтому более удобен при клиническом применении. Препарат назначают два раза в сутки. Начальная доза 75 мг два раза, суточная терапевтическая доза 300–600 мг. Проведено несколько рандомизированных клинических исследований эффективности прегабалина при постгерпетической невралгии, в которых было показано быстрое развитие противоболевого эффекта (в течение первой недели приема), хорошая переносимость, простота применения и уменьшение нарушений сна, связанных с болевым синдромом [22].
Антидепрессанты. Препараты этой группы, особенно трициклические (нортриптилин и амитриптилин), являются важными компонентами в лечении боли при ПГН. Благодаря активации нисходящих серотонин- и норадреналинергических антиноцицептивных систем и способности блокировать натриевые каналы антидепрессанты блокируют восприятие боли. В клинических исследованиях эффективности трициклических антидепрессантов в уменьшении боли при ПГН от 47% до 67% пациентов сообщили об «умеренном до превосходного» эффекте купирования болевого синдрома, причем сообщалось об эквивалентном действии амитриптилина и нортриптилина [17]. Однако нортриптилин не вызывает большого числа антихолинергических эффектов, поэтому может быть более предпочтительным по сравнению с амитриптилином.
Пластырь с 5% лидокаином апплицируется на зону воздействия в начале хронизации боли или сразу после установления диагноза ПГН. Пластырь накладывают на интактную, сухую, невоспаленную кожу. Его не используют на воспаленной или поврежденной коже (т. е. во время активных герпетических высыпаний). Лидокаин является антагонистом ионных натриевых анналов, анальгетический эффект развивается в результате предотвращения генерации и проведения потенциалов нейрональной активности, путем связывания натриевых каналов гиперактивных и поврежденных ноцицепторов. Пластырь с 5% лидокаином обладает местным действием и почти не оказывает системных влияний. В нескольких работах показано, что пластырь с лидокаином уменьшает интенсивность боли по сравнением с плацебо [18]. В сравнительных исследованиях эффективности 5% лидокаина и прегабалина показана их одинаковая эффективность [19]. Капсаицин, изготовляемый из красного перца и оказывающий раздражающее действие, используется в виде мази или пластыря. При нанесении на кожу истощает запасы пептидергических нейромедиаторов (например, вещество Р) в первичных ноцицептивных афферентах. Препарат должен наноситься на область поражения 3–5 раз в день для поддержания длительного эффекта. Несмотря на то, что в ряде исследований показана эффективность капсаицина в отношении ПГН, у многих пациентов часто наблюдались существенные побочные реакции: так, треть больных сообщали о развитии «невыносимого» раздражающего эффекта препарата, что значительно ограничивает его клиническое применение при ПГН.
Опиоидные анальгетики (оксикодон, метадон, морфий) также могут использоваться в лечении ПГН. Они уменьшают невропатическую боль благодаря связыванию опиоидных рецепторов в ЦНС либо ингибированию обратного захвата серотонина или норадреналина в периферических нервных окончаниях — нервных синапсах. Согласно результатам исследований, оксикодон по сравнению с плацебо способствует большему облегчению боли и уменьшает тяжесть аллодинии, но вызывает развитие таких побочных реакций, как тошнота, запор, сонливость, потеря аппетита, лекарственная зависимость [20]. Сравнительное изучение эффективности опиоидов и трициклических антидепрессантов продемонстрировало их эквивалентную эффективность.
В разделе «Лечение постгерпетической невралгии» в Европейских рекомендациях 2009 [21] по лечению нейропатической боли выделяют терапию первой линии (препараты с доказанной эффективностью — класс А): прегабалин, габапентин, лидокаин 5%. Препараты второй линии (класс В): опиоиды, капсаицин.
При лечении пациентов с ПГН целесообразно соблюдать определенные этапы.
Вначале назначают препараты первой линии: габапентин (прегабалин), или ТЦА, или местные анестетики (пластины с 5% лидокаином). Если удается достигнуть хорошего снижения боли (оценка боли по ВАШ –3/10) при допустимых побочных эффектах, то лечение продолжают. Если ослабление боли недостаточно, то добавляют другой препарат первого ряда. При неэффективности средств первого ряда можно назначить препараты второго ряда: трамадол или опиоиды, капсаицин, нефармакологическую терапию. В комплексной терапии постгерпетической невралгии используют также нефармакологическую терапию: иглорефлексотерпию, обезболивающий аппарат ЧЭНС, наиболее перспективным и эффективным методом является нейростимуляция.
Лечение ПГН является крайне сложной задачей. Даже при использовании различных противоболевых препаратов и направлении к специалисту-алгологу не всегда удается добиться исчезновения болевого синдрома.
Литература
Первый МГМУ им. И. М. Сеченова, Москва
.gif)