Что негативно влияет на тестостерон
Дефицит тестостерона и соматическая патология
Тестостерон является основным половым гормоном, определяющим функционирование мужского организма. Вместе с дигидротестостероном, андростендионом и их метаболитами тестостерон создает соответствующий тонус центральной нервной системы, подкорковых образова
Тестостерон является основным половым гормоном, определяющим функционирование мужского организма. Вместе с дигидротестостероном, андростендионом и их метаболитами тестостерон создает соответствующий тонус центральной нервной системы, подкорковых образований, центров автономной нервной системы, поддерживая функциональную активность половых желез и обеспечивая копулятивную функцию.
Андрогенная активность тестостерона и его активного метаболита — дигидротестостерона определяется их эффективным взаимодействием с андрогенными рецепторами. Основное место образования и секреции тестостерона — интерстициальные клетки тестикул — клетки Лейдига. Кроме того, биосинтез определенных, но значительно меньших количеств этого гормона может осуществляться в коре надпочечников.
Тестостерон, наряду с андрогенными эффектами, способен оказывать мощное анаболическое действие на различные ткани человека (мышцы, почки, печень, матку), т. е. увеличивать в них синтез белка. В результате действия на клетки-мишени реализуется ряд эффектов тестостерона (рис. 1).
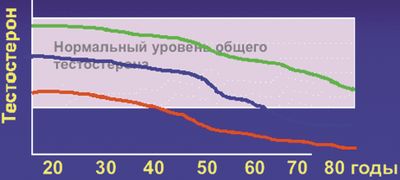
По данным Массачусетского исследования по изучению вопросов старения мужчин (MMAS), количество общего тестостерона снижается с 30–35-летнего возраста на 0,8%, а свободного тестостерона и связанного с альбумином — на 2% в год, при этом уровень глобулина, связывающего половые гормоны (ГСПГ), повышается на 1,6% в год (J Clin Endocrinol Metab, 2002).
В клинической картине андрогенной недостаточности можно выделить несколько групп симптомов.
– увеличение грудных желез,
– уменьшение оволосения на лице.
– снижение мышечной массы,
– неадекватный физическим нагрузкам прирост мышечной массы,
– лабильность настроения со склонностью к депрессиям,
– снижение творческой продуктивности,
Изменения нервно-эмоционального статуса проявляются повышенной раздражительностью, снижением способности к концентрации внимания, а также когнитивных функций, творческой продуктивности, функций памяти; депрессией, нарушениями сна, ощущением снижения жизненной энергии. Поскольку тестостерон является основным анаболическим гормоном, его дефицит приводит к развитию соматических нарушений: снижению мышечной массы и силы, увеличению количества жировой ткани, развитию остеопороза, уменьшению тонуса и толщины кожи.
Считающиеся «прерогативой» женского климакса вегето-сосудистые расстройства — приливы, потливость, кардиалгии, колебания уровня артериального давления, чувство нехватки воздуха — также беспокоят мужчин в период развития синдрома возрастного гипогонадизма.
Тестостерон играет основную роль в становлении сексуальной функции и формировании полового поведения, поэтому снижение его уровня сопровождается уменьшением либидо и эректильной дисфункцией.
На сегодняшний день у большинства специалистов не вызывает сомнений как само существование синдрома дефицита андрогенов (или возрастного гипогонадизма) у мужчин, так и необходимость его коррекции. Ежегодно на фармацевтическом рынке появляются все новые и новые препараты тестостерона. Но так было не всегда.
Поиски «эликсира жизни», продолжавшиеся несколько столетий, ознаменовались величайшим открытием в середине 30-х годов прошлого века структуры тестостерона. В 1934 г. югославский химик Леопольд Ружичка с коллегами из Федерального института (г. Цюрих) частично синтезировал андростерон и тестостерон. Другой ученый, Адольф Бутенандт, один из главных соперников Ружички в области химии половых гормонов, в августе 1935 г. отправил описание процесса получения тестостерона из холестерина и самой структуры тестостерона в немецкий журнал физиологической химии (F. J. Butenandt et al., 1935).
Спустя неделю Ружичка сообщил в швейцарский химический журнал о получении патента на способ производства тестостерона из холестерола (L. Ruzichka et al., 1935).
С этого времени началась новая эра лечения проявлений недостаточности тестостерона.
В течение 2 лет с момента открытия тестостерона в клинической практике появилось несколько его препаратов, однако вскоре выяснилось, что из-за плохой растворимости в воде они не могут усваиваться при приеме внутрь в чистом виде. Поэтому через какое-то время был синтезирован и стал широко применяться тестостерона пропионат. Так, в 1940 г. H. B. Thomas и R. T. Hill сообщили об успешном лечении мужского климакса тестостерона пропионатом (H. B. Thomas, R. T. Hill, 1940). Исследования, проведенные за период 1930 — 1940 гг., показали, что тестостерон оказывает благоприятное действие на состояние мужского организма в целом.
Благодаря очевидной эффективности применения препаратов тестостерона с 1940 г. многие врачи стали признавать наличие ряда симптомов, сходных с проявлениями женской менопаузы, у мужчин среднего возраста.
В 1944 г. Карл Дж. Хеллер и Гордон Б. Майерс в журнале Американской медицинской ассоциации опубликовали статью «Климакс у мужчин: его симптоматика, диагностика и лечение», в которой показали, что активность хорионического гонадотропина у мужчин с климактерическими расстройствами значительно выше, чем у здоровых; при этом удалось продемонстрировать эффективность инъекций тестостерона пропионата: у 85% пациентов было отмечено полное исчезновение вазомоторных, психических и урологических симптомов, а также полное восстановление либидо (C. G. Heller, G. B. Myers, 1944).
Поскольку продолжительность действия тестостерона пропионата составляла около 3 дней, была предпринята успешная попытка изготовления из сжатых кристаллов тестостерона капсул цилиндрической формы, которые имплантировались под кожу ягодиц или живота. В 1953 г. немецкий врач Тиберий Райтер продемонстрировал эффективное использование имплантатов тестостерона; при этом он первым стал измерять уровень тестостерона перед началом лечения, показал безопасность тестостерона в отношении действия на сердечно-сосудистую систему и простату (Tiberius Reiter// Practicioner. 1953).
Однако победное шествие тестостерон-терапии в 1950-е годы натолкнулось на стену непонимания большого числа как ученых, так и руководителей здравоохранения. В частности, успешное применение датскими врачами Моллером и Твердегаардом инъекций тестостерона у пациентов с перемежающейся хромотой, буквально спасшее многих от гангрены, вызвало бурную реакцию чиновников из Датской службы здоровья. В 1957 г. было выдвинуто официальное обвинение в измене правительству, так как препараты тестостерона не только не входили в число жизненно важных препаратов, но и не сочетались с понятиями традиционной медицины того времени. Работы ученых не допускались в печать, не обсуждались на конгрессах (М. Каррузерс, 2004).
Как уже говорилось выше, в настоящее время проблема назначения препаратов тестостерона при возрастном гипогонадизме считается практически решенной, однако зачастую она решается лишь в кругу узких специалистов — урологов, андрологов, эндокринологов. В то же время подавляющее большинство мужчин в так называемом переходном возрасте имеют как минимум одно соматическое заболевание. Так, по данным патологоанатомической службы лечебно-профилактических учреждений г. Москвы, частота умерших в 2003 г. мужчин с двумя и более заболеваниями составила от 31% в возрасте 41–50 лет до 62% в возрастной категории от 71 до 80 лет.
Соматическая патология (атеросклероз, ожирение, сахарный диабет, заболевания печени) вносит значительный вклад как в снижение секреции тестостерона, так и в его метаболизм. В отличие от здоровых мужчин содержание тестостерона в крови у мужчин, страдающих перечисленными болезнями, в аналогичном возрасте значительно ниже (D. Handelsman, 1994; G. Lunglmayr, 1997).
Сердечно-сосудистая патология сегодня занимает ведущее место среди причин заболеваемости и смертности в развитых странах. При этом распространенность сердечно-сосудистых заболеваний среди мужчин выше, чем среди женщин, летальность среди мужчин также существенно превышает таковую среди женщин, особенно в молодом возрасте. Так, в исследовании The Rancho Bernardo Study показатели летальности в возрастной категории 50–59 лет составили 10,4% у мужчин и только 1,2% у женщин, в возрасте 60–69 лет — 27,8% и 19% соответственно среди мужчин и женщин, и только у пожилых людей (70–79 лет) показатели сердечно-сосудистой смертности среди женщин несколько приблизились к показателям у мужчин — соответственно 39,1% и 47,6% (D. Goodman-Gruen and E. Barrett-Connor, 1996).
Таким образом, налицо взаимосвязь пола, гормонального статуса и развития кардиоваскулярной патологии (рис. 2).
Артериальная гипертония является независимым фактором риска ишемической болезни сердца, и хотя сегодня разработаны стандарты фармакотерапии этого заболевания, на практике и врачи, и пациенты зачастую сталкиваются с неэффективностью гипотензивных препаратов и их комбинаций. Возможным объяснением этому может явиться некорригированный дефицит андрогенов. В доказательство вышесказанного можно привести тот факт, что еще в 1930 г. наши исследователи показали, что артериальная гипертония чаще развивается у мужчин со снижением половой функции (С. И. Карчикян, 1930), а лечение тестостероном оказывает выраженное гипотензивное действие (Т. Т. Глухенький, 1946).
В это же время появляются первые сообщения о положительном влиянии лечения тестостероном на течение стенокардии у мужчин, которое проявлялось в уменьшении выраженности симптомов заболевания и повышении толерантности к физическим нагрузкам (T. C. Walker et al., 1942). Антиишемическое действие тестостерона было показано M. D. Jaffe в 1977 г., и позднее (S. Z. Wu, X. Z. Weng, 1993) на фоне лечения выявлено уменьшение степени депрессии сегмента ST на ЭКГ.
В подавляющем большинстве одномоментных (поперечных) исследований, проведенных во второй половине XX в., была доказана отрицательная корреляционная связь между уровнем тестостерона и кардиоваскулярной патологией.
В частности, удалось получить корреляцию между уровнем свободного тестостерона и степенью окклюзии коронарных артерий: чем ниже был уровень тестостерона, тем больше степень окклюзии (G. B. Phillips et al., 1994).
В исследовании The South Yorkshire Study (2003) показана высокая распространенность гипогонадизма у мужчин с ишемической болезнью сердца — 23,4%, при этом наличие атеросклероза верифицировалось с помощью ангиографии. В данном исследовании также выявлена положительная корреляция наличия гипогонадизма и артериальной гипертонии.
За последние 25 лет проведен ряд исследований, результаты некоторых из них продемонстрировали связь между уровнем тестостерона в сыворотке и показателями липидного спектра.
В большинстве работ показана положительная корреляционная связь между уровнем тестостерона и липопротеинами высокой плотности (ЛПВП) и отрицательная — между содержанием в сыворотке общего холестерина, липопротеинов низкой плотности (ЛПНП) и тестостерона (Nordoy, 1979; Gutai, 1981; Heller, 1983; Freedman, 1991; Pottelbergh, 2003). В то же время некоторые исследования демонстрируют положительное влияние терапии тестостероном на липидный спектр. Так, в работе S. Zgliczynski и соавторов (1996) выявлено достоверное снижение общего холестерина и ЛПНП на фоне лечения тестостерона энантатом по 200 мг каждые 2 нед в течение года (рис. 3).
Результаты исследования, в котором приняли участие 22 мужчины с острым инфарктом миокарда, позволяют предположить возможность снижения показателей смертности от инфаркта миокарда при терапии экзогенным тестостероном.
Динамика уровней тестостерона, эстрадиола и инсулина в течение 6 дней после развития инфаркта миокарда свидетельствует о том, что низкий исходный уровень тестостерона ассоциируется с недостаточным инсулиновым «ответом», а также худшим прогнозом у нестрадающих сахарным диабетом больных с инфарктом миокарда (Peter J. Pugh, 2001).
У участников данного исследования средний уровень тестостерона плазмы резко падал в течение первых 2 сут после развития инфаркта миокарда, затем повышался и к 6-му дню превышал исходные показатели.
В 2004 г. в журнале Heart те же авторы опубликовали результаты плацебоконтролируемого исследования, посвященного эффективности применения смеси эфиров тестостерона (сустанон) у мужчин с сердечной недостаточностью. После 12 нед терапии в группе вмешательства была достигнута достоверно лучшая переносимость физической нагрузки (R. Pugh, D. Jones, 2004).
Kevin S. Channer и его коллеги (Клиника Royal Hallamshire Hospital, Шеффилд) провели небольшое по объему плацебоконтролируемое исследование, в ходе которого мужчины со стабильным течением хронической сердечной недостаточности получали тестостерон по 60 мг/сут.
По сравнению с плацебо тестостерон приводил к существенному повышению сердечного выброса (p
А. Л. Верткин, доктор медицинских наук, профессор
Л. Ю. Моргунов, кандидат медицинских наук
Е. Н. Аринина
Е.С. Колосова
МГМСУ, Москва
Современный взгляд на проблему возрастного андрогенного дефицита у мужчин
Традиционно считается, что мужчины являются сильным полом
Традиционно считается, что мужчины являются сильным полом. Однако факты доказывают обратное: в современном мире мужчины уступают женщинам не только по качеству жизни, но и ее продолжительности (в России разница в продолжительности жизни мужчин и женщин драматична и составляет 13 лет!). У мужчин значительно выше распространенность онкологических и сердечно-сосудистых заболеваний. Потребление алкоголя и курение в России значительно выше, чем на Западе, что ведет к раннему возникновению эректильной дисфункции, негативно влияющей на качество жизни как пары в целом, так и женщины.
Таким образом, факты демонстрируют некоторую слабость мужчин. Можно ли как-то влиять на их слабые стороны? Можно ли изменить качество жизни мужчины и увеличить ее продолжительность? За последние 10 лет произошла настоящая «тестостероновая революция», мы уже не задаем вопрос, является ли возрастной андрогенный дефицит мифом или реальностью, поскольку наличие возрастного андрогенного дефицита является научно доказанным фактом. Более того, сегодня мы знаем, что содержание тестостерона определяет функционирование практически всех органов мужского организма. Тестостерон является своего рода протективным гормоном в отношении развития целого ряда возраст-ассоциированных заболеваний. Продолжительность жизни у мужчин с низким уровнем тестостерона ниже, по сравнению с мужчинами с нормальным уровнем тестостерона. Еще в 1983 году Дильман В. М. писал, что «одним из обязательных условий профилактики рака является поддержание гормонально-метаболических показателей на уровне, которого организм достигает в возрасте 20–25 лет…». Сегодня мечты ученых прошлого века осуществимы, поскольку у нас есть для этого эффективные и безопасные препараты, но они, к сожалению, практически не используются.
Несмотря на то, что соматические заболевания ведут к андрогенному дефициту, усугубляющему их течение, определение тестостерона не стало рутинной практикой. Восполнение андрогенного дефицита повышает эффективность лечения эректильной дисфункции ингибиторами фосфодиэстеразы 5 типа (ФДЭ-5), нарушений мочеиспускания 5 альфа-адреноблокаторами, сахарного диабета сахаропонижающими препаратами, способствует снижению веса — основного компонента метаболического синдрома.
Возрастное снижение секреции тестостерона у мужчин начинается с 30 лет, причем скорость снижения свободного тестостерона превышает скорость снижения общего тестостерона (за счет усиления с возрастом синтеза глобулина, связывающего половые стероиды (ГСПС)). Ежегодно у пациентов 30–40 лет снижение тестостерона составляет около 0,7–1,0% от общего тестостерона и 1,2–1,4% от его свободной его фракции. В литературе данный синдром получил множество названий: «андропауза», «мужской климакс», мужская менопауза. В настоящее время вышеперечисленные термины признаны неточными и практически не используются. В прямом смысле климакса (пер. с греч. — ступень, лестница) у мужчин с возрастом не наблюдается. Однако происходит постепенное угасание половых и гормональных функций, хотя полного их выключения не наблюдается до глубокой старости.
В современной литературе используются следующие термины:
ВАД представляет собой клинический и биохимический синдром, связанный со старением. Характеризуется типичными симптомами хронической недостаточности системного действия тестостерона и проявляется нарушением функции различных органов и систем, а также снижает качество жизни (Nieschlag E., Swerdloff R. et al., 2005).
Сроки наступления и распространенность ВАД. Сроки наступления клинически значимого ВАД индивидуальны и зависят от уровня тестостерона на пике его секреции в 20–30 лет: чем выше его содержание, тем позже наступит его снижение, выходящее за нормативные показатели (рис. 1).
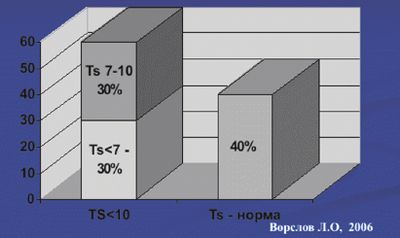
Любое хроническое соматическое заболевание негативно влияет на секрецию тестостерона, приводя к ускорению наступления андрогенного дефицита, в связи с чем распространенность андрогенного дефицита при хронических соматических заболеваниях крайне высока. По нашим данным распространенность ВАД при сахарном диабете 2-го типа составляет 68% (рис. 2), а при ИБС — 60% (рис. 3).
Уровень ГСПС, наоборот, повышается при старении, поэтому содержание свободной фракции тестостерона дополнительно снижается. У мужчин без соматических заболеваний распространенность ВАД увеличивается с возрастом и составляет в среднем 30% в популяции мужчин старше 50 лет (табл. 1).
Сочетанные с ВАД возрастные изменения секреции других гормонов. Процесс старения происходит практически во всех органах эндокринной системы, захватывает в том числе надпочечники. Изменения, происходящие в них с возрастом, получили название адренопаузы. Этот термин описывает снижение уровня дегидроэпиандростерона (ДГЭА) и ДГЭА-сульфата в надпочечниках, в то время как секреция кортикотропина долгое время остается неизменной. Недостаток ДГЭА приводит к снижению настроения, либидо, ослаблению потенции, остеопении, уменьшению массы и силы мышц, нарушению иммунитета, появлению инсулинорезистентности.
В процессе старения уменьшается выработка второго важного анаболического гормона — гормона роста (соматопауза). По данным ряда авторов, наблюдается возрастное снижение уровня мелатонина (меланопауза). С дефицитом этого гормона связывают нарушение равновесия в системе «сон–бодрствование».
Хотя старение не приводит к полному гормональному дефициту, возможно медицинское вмешательство в процессы андро-, сомато-, мелано- и адренопаузы с целью отсрочить некоторые проявления процесса старения (Лоран О. Б., Сегал А. С., 1999).
Клиническая картина ВАД представлена в табл. 2. На фото дан клинический пример ВАД. Обращает внимание увеличение количества жировой ткани (абдоминальное ожирение), уменьшение мышечной массы, дряблость кожи, уменьшение роста волос на туловище, конечностях, лобке.
Диагностика ВАД
Этапы диагностики ВАД
Категории пациентов, имеющих повышенный риск ВАД, у которых проведение гормонального скрининга абсолютно необходимо:
Категории пациентов, имеющих повышенный риск развития ВАД, у которых проведение гормонального скрининга желательно:
Постановка диагноза. Общепринято, что для подтверждения ВАД исследуют уровень общего тестостерона и ГСПС. Забор крови должен проводиться утром между 7.00 и 11.00 ч. Если уровень общего тестостерона выше 12 нмоль/л (3,46 нг/мл), при наличии клинической картины андрогенного дефицита, то необходимо подсчитать уровень свободного тестостерона по формуле. Если уровень общего тестостерона ниже 12 нмоль/л (200 пмоль/л), необходимо определить ТТГ, пролактин, провести оценку функции печени и почек, состояния углеводного и липидного обменов для исключения индуцированного гипогонадизма другими заболеваниями. ВАД должен быть диагнозом исключения, т. е. устанавливается только после исключения всех возможных причин гипогонадизма, включая медикаментозно-индуцированный гипогонадизм (рис. 4).
Роль ВАД в развитии ожирения и метаболического синдрома (МС) у мужчин. Как было установлено в ряде исследований, одним из определяющих факторов развития ожирения, инсулинорезистентности и МС у мужчин является дефицит половых гормонов и, в частности, тестостерона. Так, Simon D. et al. в TELECOM-Study при обследовании 1292 мужчин выявили четкую отрицательную взаимосвязь между уровнем тестостерона и уровнем инсулина (Simon D.). Chen R. Y. et al. показали, что уровень общего тестостерона у мужчин с МС значимо ниже, чем у здоровых. При этом выявлена обратная корреляция между концентрацией тестостерона и окружностью талии, а также уровнем холестерина липопротеидов низкой плотности. В то же время в данном исследовании не было выявлено причинной взаимосвязи между низким уровнем тестостерона и развитием сахарного диабета 2-го типа (Chen R. Y.). Однако проведенное ранее широкомасштабное исследование Massachusetts Male Aging Study свидетельствует о тесной корреляции между низким уровнем свободного тестостерона и риском развития инсулинорезистентности и сахарного диабета 2-го типа (Stellato R. K.).
Таким образом, низкий уровень тестостерона у мужчин следует рассматривать как один из компонентов МС наряду с инсулинорезистентностью, гиперинсулинемией, ожирением, дислипидемией, артериальной гипертензией, нарушением толерантности к глюкозе и нарушениями в свертывающей системе крови.
Лечение ВАД
Заместительная терапия андрогенами имеет уже 60-летнюю историю, благодаря Thomas H. B., Hill R. T., которые в 1940 году впервые успешно применили Тестостерона пропионат для лечения андрогенной недостаточности у мужчин. Долгое время показаниями для применения оставались классические формы гипогонадизма, а именно врожденный или приобретенный гипогонадизм (в основном опухолевого или травматического характера). В последнее время показания значительно расширились и все большую популярность и распространенность терапия андрогенами приобретает в лечении ВАД.
Терапия ВАД направлена на восполнение андрогенного дефицита. Камнем преткновения широкого назначения терапии препаратами тестостерона до сих пор является безопасность в отношении предстательной железы. Долгое время считалось, что андрогены являются стимуляторами онкогенеза в предстательной железе. Однако исследования последних лет опровергают это мнение, основанное на единичных наблюдениях повышения уровня кислой фосфатазы у больных с раком предстательной железы на фоне применения препаратов тестостерона, проведенных в прошлом столетии. Сегодня доказано, что андрогенотерапия не только безопасна в отношении предстательной железы, но и, более того, гипогонадизм рассматривается как фактор, ассоциированный с более тяжелым и агрессивным течением рака предстательной железы. Исследования последних лет, проведенные в Европе и США, показали, что частота развития рака простаты на фоне андрогенотерапии не превышает частоту выявления рака простаты в популяции мужчин, не получающих терапию препаратами тестостерона (Morgentaller A., 2006), а низкий уровень тестостерона ассоциирован с более агрессивными формами рака предстательной железы.
В настоящее время имеется широкий выбор препаратов для восполнения андрогенного дефицита (табл. 3). У мужчин с сохраненной секреторной способностью клеток Лейдига можно использовать как терапию экзогенными препаратами, так и стимулирующую терапию гонадотропином хорионическим. Стимулирующая терапия должна быть методом выбора у пациентов, планирующих иметь детей, поскольку экзогенные препараты, особенно инъекционные формы, оказывают негативное действие на сперматогенез.
У мужчин с повышением уровня ЛГ, являющегося маркером поражения клеток Лейдига, необходимо проведение постоянной терапии андрогенами, причем дозу препарата следует подбирать именно под контролем ЛГ, который при правильно подобранной дозе должен находиться в пределах нормальных показателей.
В настоящее время существует достаточно широкий спектр препаратов тестостерона для проведения андрогенотерапии, включающий в себя пероральные формы, масляные растворы для внутримышечных инъекций, а также трансдермальные гели и пластыри. Поскольку все препараты тестостерона обладают своими преимуществами и недостатками, при выборе метода гормональной терапии необходимо руководствоваться принципами эффективности, безопасности и удобства применения. Как правило, при начале терапии андрогенами при ВАД, препаратами выбора являются неинвазивные формы — трансдермальные гели, которые на российском рынке представлены препаратом «Андрогель».
Тестостерон в виде геля всасывается с поверхности кожи и поступает в кровоток, при этом постоянная концентрация в плазме наблюдается в течение 24 часов. Единственный его недостаток заключается в наличии возможности контакта геля с кожей партнерши.
При выраженном андрогенном дефиците, сопровождаемом повышением уровня ЛГ, лучше использовать препараты тестостерона длительного действия.
Ранее в нашей стране были зарегистрировано 2 андрогенных препарата с относительно длительным действием — Сустанон-250 и Омнадрен 250, инъекции которых необходимо делать 2–3 раза в месяц. Эти препараты являются смесью четырех эфиров тестостерона — тестостерона капроната, изокапроната, пропионата и фенилпропионата, которые характеризуются разной фармакокинетикой. Тестостерона пропионат начинает действовать быстро, однако к концу первого дня действие его практически прекращается, фенилпропионат и изокапронат начинают действовать примерно через сутки, действие продолжается до двух недель, а самый длительно действующий — капронат, его действие может продолжаться до 3–4 недель. Существенным недостатком этих препаратов являются колебания концентрации тестостерона в крови от супра- до субфизиологических, что ощущается рядом больных. Кроме того, супрафизиологические подъемы содержания тестостерона в некоторых случаях ведут к повышению гематокрита, что не только требует контроля за состоянием крови, но и в некоторых случаях требует отмены препарата. В 2005 г. для больных с андрогенной недостаточностью стал доступен новый препарат тестостерона с по-настоящему длительным действием — тестостерона ундеканоат (Небидо®) в виде масляного раствора, который во всем мире признан препаратом выбора для проведения длительной заместительной гормональной терапии гипогонадизма любого генеза и, в том числе, ВАД. Небидо® не только длительно поддерживает тестостерон сыворотки крови на физиологическом уровне, что позволяет надежно и эффективно ликвидировать и предотвращать симптомы недостаточности тестостерона, но и значительно лучше переносится пациентами, по сравнению с указанными ранее известными внутримышечными препаратами, поскольку после инъекции Небидо® уровень тестостерона в течение 12 недель поддерживается в физиологических пределах, без резких повышений и снижений. Пациентам требуется всего 4–5 инъекций в год. Однако, учитывая достаточно большой объем масляного раствора препарата — 4 мл, необходимость медленного внутримышечного введения препарата, мы рекомендуем введение препарата под контролем врача, для избежания возможного возникновения абсцессов.
Побочные эффекты андрогенотерапии
Терапия андрогенами при ВАД является заместительной терапией, т. е. происходит нормализация содержания тестостерона, поэтому при правильно подобранной дозе, т. е. при дозе, при которой уровень тестостерона находится в нормальных физиологических пределах и никаких побочных эффектов от проводимой терапии быть не может.
При превышении дозы возможно развитие побочных эффектов, связанных с передозировкий андрогенов: