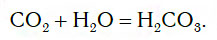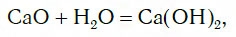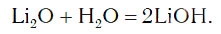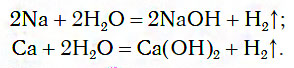Что не реагирует с водой химия
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
SiO2 + H2O → реакция не идет.
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
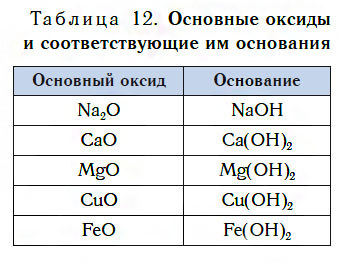
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Что не реагирует с водой химия
1.2. Химические свойтсва воды
Вода активное в химическом отношении вещество.
Железо реагирует с водой при нагревании по реакции:
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях такого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
С + H2O = H2 + СО (при сильном нагревании)
2. Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
3. Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения.
4. Некоторые оксиды металлов также могут вступать во взаимодействие с водой.
СаО + Н2О = Са(ОН)2 гидроксид кальция или гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически нерастворима в воде и поэтому с водой не реагирует. Это ZnO, TiO2, Cr2O3, из которых приготавливают стойкие к воде краски. Оксиды железа и алюминия также не растворимы в воде и не реагируют с ней.
5. Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
NaOH + H2O = NaOH H2O гидрат едкого натра
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С помощью их, например, удаляют водяные пары из влажного атмосферного воздуха.
6. Особая реакция воды – синтез растениями крахмала (С6Н10О5)n и других подобных соединений (углеводов), происходящая с выделением кислорода.
7. В комплексных соединениях вода является лигандом и координируется как катионами [Cr(H2O)6]Cl3, [Pt(H2O)2Cl4], так и анионами [A(H2O)m]n-.
8. При взаимодействии с солями происходит гидролиз последних с образованием кислых, основных и средних солей:
Процесс ступенчатого гидролиза солей используют при очистке воды с помощью коагулянтов. Например, при использовании в качестве коагулянта сернокислого алюминия, ступенчатый гидролиз соли протекает по схеме:
Что не реагирует с водой химия
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
гидроксид кальция (гашеная известь)
вещество белого цвета (безводный сульфат меди)
кристаллогидрат (медный купорос ), синие кристаллы
Приведем другие примеры образования гидратов:
H 2 SO 4 + H 2 O = H 2 SO 4 . H 2 O (гидрат серной кислоты)
NaOH + H 2 O = NaOH . H 2 O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Особая реакция воды – синтез растениями крахмала (C 6 H 10 O 5 ) n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO 2 + 5n H 2 O = (C 6 H 10 O 5 ) n + 6n O 2 (при действии света)
Таким образом, почти все важнейшие химические реакции воды уже встречались нам в предыдущих параграфах.
7.10. Сколько граммов воды потребуется для превращения всего оксида серы (VI), полученного из 64 г серы, в серную кислоту? Сколько при этом получится серной кислоты?
7.12. Безводный хлорид кальция CaCl 2 в количестве 11,1 г растворили в воде. Затем раствор упарили, а выделившиеся кристаллы высушили на воздухе. Их масса составила 18,3 г. Напишите формулу образовавшегося кристаллогидрата.
** 7.13 (НГУ). Определите число молекул кристаллизационной воды в кристаллогидрате сульфата алюминия Al 2 (SO 4 ) 3 × nH 2 O, если в 6,66 г этого соединения содержится 1,806 × 10 23 атомов кислорода.
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н + 2О = 2NaOH + H 0 2↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2) Взаимодействие с неметаллами, имеющими низкую ЭО
(реакции происходят в жестких условиях)
C + Н + 2О = CO + H 0 2↑ («водяной газ»)
В присутствии щелочей кремний вытесняет водород из воды:
3) Взаимодействие с гидридами металлов
NaH + Н + 2 O = NaOH + H 0 2↑
4) Взаимодействие с угарным газом и метаном
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
1) Взаимодействие с фтором
2) Взаимодействие с атомарным кислородом
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
Реакции гидратации
I. Гидратация ионов.
Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
II. Гидратация оксидов
III. Гидратация органических соединений, содержащих кратные связи
Реакции гидролиза
Fe 3+ + Н2O = FeOH 2+ + Н + ; (кислая среда. рН
в) по катиону и по аниону соли
II. Гидролиз карбидов металлов
III. Гидролиз силицидов, нитридов, фосфидов
IV. Гидролиз галогенов
V. Гидролиз органических соединений
Классы органических веществ
Продукты гидролиза (органические)
Альдегиды или кетоны
Галогенангидриды карбоновых кислот
Ангидриды карбоновых кислот
Сложные зфиры карбоновых кислот
Карбоновые кислоты и спирты
Глицерин и высшие карбоновые кислоты
Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза)