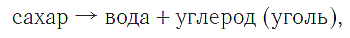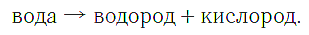Что называют сложными веществами
Сложные вещества
Сложные вещества
Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических элементов. Сложными веществами являются большинство неорганических веществ и все органические. (см. также простые вещества)
Сложные вещества состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием нескольких других веществ и могут образоваться из нескольких менее сложных веществ. Например, вода состоит из атомов кислорода и водорода, сульфид железа состоит из атомов железа и серы.
Примечания
См. также
Ссылки
Смотреть что такое «Сложные вещества» в других словарях:
СЛОЖНЫЕ РЕАКЦИИ — химические реакции, в которых конечные продукты получаются из исходных через промежуточные вещества. Образование каждого из промежуточных веществ называется элементарной стадией сложной реакции. К сложным реакциям относятся, напр., цепные реакции … Большой Энциклопедический словарь
Сложные эфиры — Сложный эфир карбоновой кслоты. R и R обозначают любую алкильную или арильную группу Сложные эфиры производные оксокислот (как карбоновых так и минеральных) Rk … Википедия
Сложные тиоэфиры — Общая структура сложных тиоэфиров Сложные тиоэфиры органические соединения, содержащие функциональную группу C S CO C и являющиеся сложными эфирами тиолов и карб … Википедия
сложные реакции — химические реакции, в которых конечные продукты получаются из исходных через промежуточные вещества. Образование каждого из промежуточных веществ называется элементарной стадией сложных реакций. К сложным реакциям относятся, например, цепные… … Энциклопедический словарь
Сложные реакции — такие Реакции химические, элементарные акты которых различны. В противоположность С. р. элементарные акты простых реакций не отличаются один от другого природой участвующих в них веществ, а лишь, возможно, направлением превращения, если… … Большая советская энциклопедия
Сложные белки — (протеиды, холопротеины) двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы простетическая группа. При гидролизе сложных белков, кроме свободных аминокислот, освобождается… … Википедия
Простые вещества — Аллотропная модификация углерода алмаз (в материнской породе) Простые вещества вещества, состоящие исключительно из атомов одного химического элемента (из гомоядер … Википедия
Неорганические вещества — Неорганические вещества это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
высокочистые вещества — [highly purified materials] простые (химические элементы) и сложные вещества, содержат примесей от 10 6до 10 8 мас. %, но ≤10 3 мас. %. Такие вещества играют важную роль в полупроводниковой промышленности, атомной энергетике, волоконной оптике … Энциклопедический словарь по металлургии
ЭФИРЫ СЛОЖНЫЕ — ЭФИРЫ СЛОЖНЫЕ, вещества из класса органических соединений, которые образуются в результате реакции между СПИРТАМИ и КИСЛОТАМИ … Научно-технический энциклопедический словарь
Что называют сложными веществами
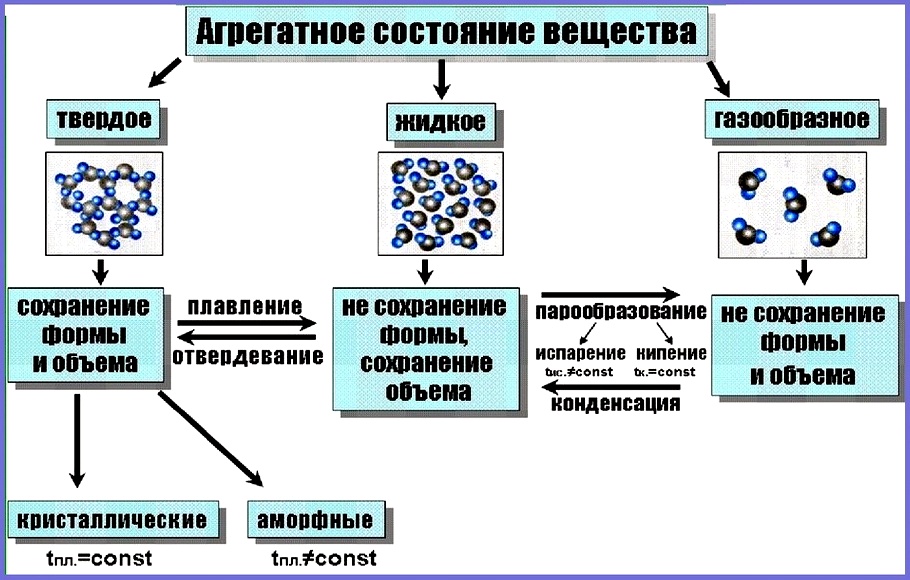
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.
В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.
Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
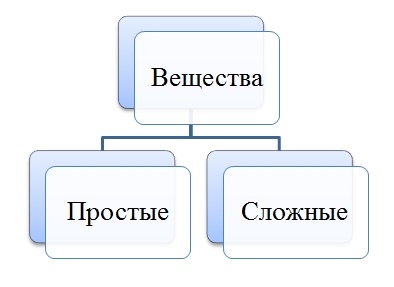
Простые и сложные вещества
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.
Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
Аллотропия
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями. Примеры аллотропии:
С (углерод) — алмаз, графит, карбин, фуллерен, графин;
О (кислород) — собственно кислород, озон;
Р (фосфор) — белый, красный, черный, фиолетовый;
S (сера) — ромбическая, моноклинная, пластическая;
Si (кремний) — аморфный, кристаллический;
As (мышьяк) — желтый, серый, черный.
К примеру, у азота аллотропных модификаций нет.
Конспект урока «Простые и сложные вещества».
Виды простых и сложных веществ
Простые и сложные вещества в химии
В неорганической химии вещества по составу делятся на простые и сложные.
Сложные вещества — соединения:
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
Li+1 и O-2→ Li2O; Al+3 и O-2→ Al2O3; N+5 и O-2→ N2O5.
Название оксида: слово «оксид» в именительном падеже + название элемента Э в родительном падеже: оксид лития Li2O, оксид алюминия Al2O3.
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид SO3, азотный ангидрид N2O5 и др.
K+1 и OH- → KOH, Mg+2 и OH- → Mg(OH)2.
Название: слово «гидроксид» в именительном падеже + название элемента в родительном падеже: гидроксид калия, гидроксид магния.
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Fe(OH)2 — гидроксид железа (II), Cr(OH)3 — гидроксид хрома (III).
Названия бескислородных кислот: корень русского названия элемента, образующего кислоту + суффикс «о» + «-водородная кислота», например: HBr — бромоводородная кислота, HCl — хлороводородная кислота, H2S — сероводородная кислота.
Названия кислородсодержащих кислот: русское название образующего элемента + «кислота», с учетом правил:
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| HAlO2 метаалюминиевая | метаалюминат |
| H3AlO3 ортоалюминиевая | ортоалюминат |
| HAsO3 метамышьяковая | метаарсенат |
| H3AsO4 ортомышьяковая | ортоарсенат |
| H3BO3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| HBrO3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H2CO3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| HClO2 хлористая | хлорит |
| HClO3 хлорноватая | хлорат |
| HClO4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| HMnO4 марганцовая | перманганат |
| HNO2 азотистая | нитрит |
| HNO3 азотная | нитрат |
| HPO3 метафосфорная | метафосфат |
| H3PO4 ортофосфорная | ортофосфат |
| H2S сероводородная | сульфид |
| H2SO3 сернистая | сульфит |
| H2SO4 серная | сульфат |
| H2SiO3 метакремниевая | метасиликат |
| H3SiO4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Для некоторых есть тривиальные названия: NH3 — аммиак, SiН4 — силан, PH3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
Химические свойства благородных газов
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
ZnO + H2SO4 → ZnSO4 + H2О,
ZnO+ 2NaOH + H2O → Na2[Zn(OH)4].
Все основания реагируют с кислотами (реакция нейтрализации):
1. Щелочи взаимодействуют с:
2. Нерастворимые основания разлагаются при нагревании: Cu(OH)2 → CuO + H2O.
Также о химических свойствах неорганических соединений можно почитать в статье «Классы неорганических соединений».
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Явление аллотропии вызывается двумя причинами:
Основные классы неорганических веществ
Бинарные соединения
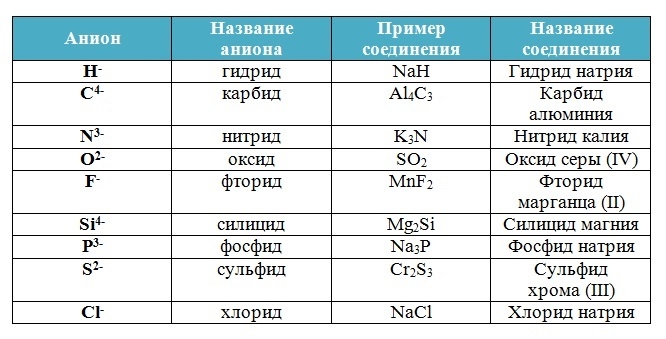
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Оксиды
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
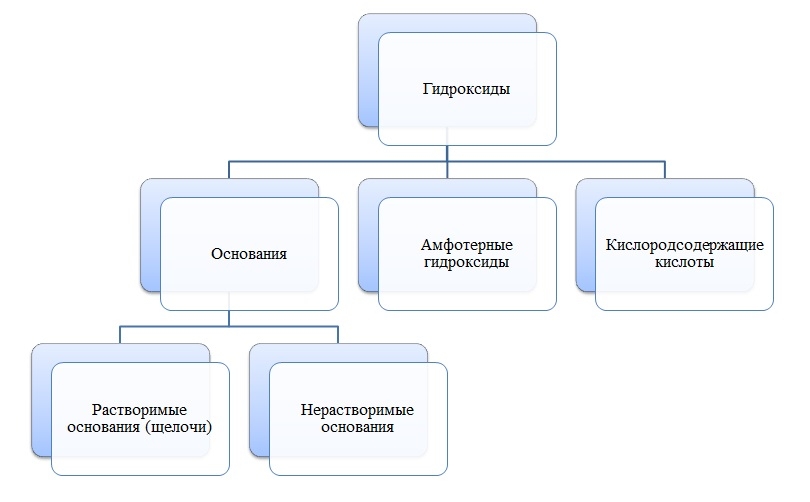
Гидроксиды
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Дополнительные материалы
Станьте первым, кто оставит
комментарий к данному материалу.
Урок 4. Сложные вещества
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.