Что называют простыми веществами в химии
Простые вещества
Содержание
Аллотропные модификации
Агрегатное состояние
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать. «Атом» — конкретное понятие, так как атомы существуют реально. «Химический элемент» — это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже [4] :
| Характеристики химического элемента | Характеристики простого вещества |
|---|---|
| атомный номер относительная атомная масса изотопный состав распространённость в природе положение в периодической системе строение атома энергия ионизации сродство к электрону электроотрицательность степени окисления валентность аллотропные модификации химический знак … | окраска запах электропроводность теплопроводность растворимость твёрдость температура кипения температура плавления вязкость молярная масса оптические свойства магнитные свойства химическая формула … |
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (дикислород O2) и озон; углерода — алмаз, графит, карбин, фуллерен.
Каждый химический элемент имеет свое условное обозначение — химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество «кислород» имеет формулу O2.
См. также
Примечания
Литература
Ссылки
Полезное
Смотреть что такое «Простые вещества» в других словарях:
Простые эфиры — Простые эфиры органические вещества, имеющие формулу R O R1, где R и R1 углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами… … Википедия
Неорганические вещества — Неорганические вещества это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
Молекулярные вещества — Молекулярные и немолекулярные вещества один из признаков химических веществ относительно их строения. Содержание 1 Молекулярные вещества 2 Немолекулярные вещества … Википедия
Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических элементов. Сложными веществами являются большинство неорганических веществ и все органические. (см. также простые вещества) Сложные вещества состоят из атомов разного… … Википедия
Эфиры простые — Простые эфиры органические вещества, имеющие формулу R O R1, где R и R1 углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений не являющихся простыми эфирами (см.… … Википедия
Органические вещества — Органические соединения, органические вещества класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[1] Содержание 1 История 2 Класси … Википедия
Белковые вещества — Б. вещества составляют громадный класс органических, то есть углеродистых, а именно углеродисто азотистых соединений, неизбежно встречаемых в каждом организме до того, что каждая клетка растений содержит Б. вещества, а клетки животных организмов… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Простые и сложные вещества
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества и их классификация
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О.
Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Типы строения веществ
По типу частиц, входящих в состав веществ, вещества делят на вещества молекулярного и немолекулярного строения. В состав вещества могут входить различные структурные частицы, такие как атомы, молекулы, ионы. Следовательно, существует три типа веществ: вещества атомного, ионного и молекулярного строения. Вещества различного типа строения будут иметь различные свойства.
Вещества атомного строения
Примером веществ атомного строения могут быть вещества, образованные элементом углеродом: графит и алмаз. В состав этих веществ входят только атомы углерода, но свойства этих веществ очень сильно отличаются. Графит – хрупкое, легко расслаивающееся вещество серо-черного цвета. Алмаз – прозрачный, один из самых твердых на планете, минерал. Почему вещества, состоящие из одного типа атомов, имеют различные свойства? Все дело в строении этих веществ. Атомы углерода в графите и алмазе соединяются различным способом. Вещества атомного строения имеют высокие температуры кипения и плавления, как правило, нерастворимы в воде, нелетучи. Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Вещества молекулярного строения
Вещества молекулярного строения – это практически все жидкости и большинство газообразных веществ. Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Вещества ионного строения
Вещества ионного строения – это твердые кристаллические вещества. Примером вещества ионного соединения может быть поваренная соль. Ее химическая формула NaCl. Как видим, NaCl состоит из ионов Na+ и Cl⎺, чередующихся в определенных местах (узлах) кристаллической решетки. Вещества ионного строения имеют высокие температуры плавления и кипения, хрупкие, как правило, хорошо растворимы в воде, не проводят электрический ток. Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать.
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Когда мы говорим о материале или компоненте смеси – например, колба наполнена газообразным хлором, водный раствор брома, возьмём кусочек фосфора, – мы говорим о простом веществе. Если же мы говорим, что в атоме хлора содержится 17 электронов, вещество содержит фосфор, молекула состоит из двух атомов брома, то имеем в виду химический элемент.
Нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже:
Сложные вещества необходимо отличать от смесей, которые тоже состоят из разных элементов. Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав. Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Таким образом, состав соединений можно описать одной химической формулой, а состав смеси – нет. Компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ.
И сера, и железо в этой смеси сохраняют свои свойства: железо притягивается магнитом, а сера не смачивается водой и плавает по ее поверхности. Если же сера и железо прореагируют друг с другом, образуется новое соединение с формулой FeS, не имеющее свойств ни железа, ни серы, но обладающее набором собственных свойств. В соединении FeS железо и сера связаны друг с другом, и разделить их методами, которыми разделяют смеси, нельзя.
Выводы из статьи по теме Простые и сложные вещества
Что называют простыми веществами в химии
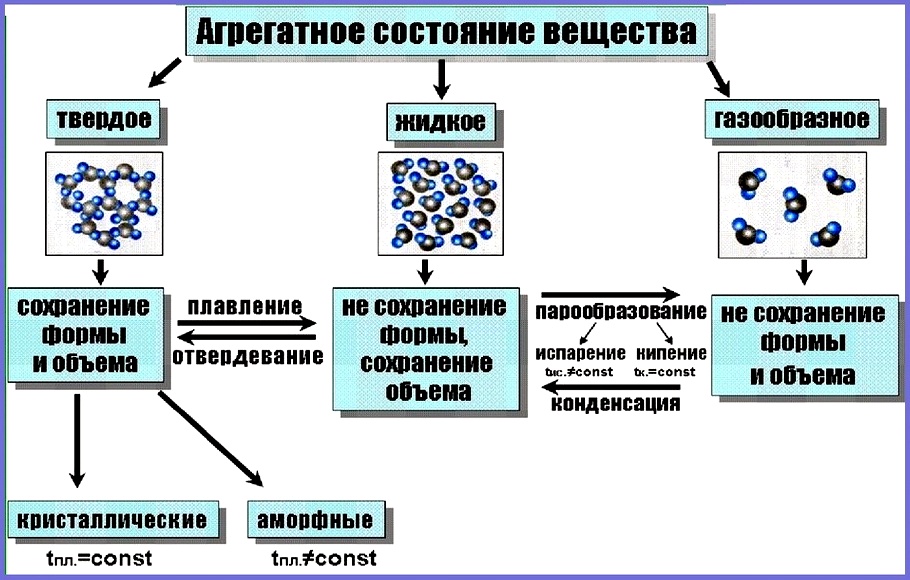
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.
В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.
Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Простые и сложные вещества
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.
Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
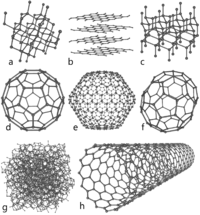
Аллотропия
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями. Примеры аллотропии:
С (углерод) — алмаз, графит, карбин, фуллерен, графин;
О (кислород) — собственно кислород, озон;
Р (фосфор) — белый, красный, черный, фиолетовый;
S (сера) — ромбическая, моноклинная, пластическая;
Si (кремний) — аморфный, кристаллический;
As (мышьяк) — желтый, серый, черный.
К примеру, у азота аллотропных модификаций нет.
Конспект урока «Простые и сложные вещества».
Виды простых и сложных веществ
Простые и сложные вещества в химии
В неорганической химии вещества по составу делятся на простые и сложные.
Сложные вещества — соединения:
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
Li+1 и O-2→ Li2O; Al+3 и O-2→ Al2O3; N+5 и O-2→ N2O5.
Название оксида: слово «оксид» в именительном падеже + название элемента Э в родительном падеже: оксид лития Li2O, оксид алюминия Al2O3.
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид SO3, азотный ангидрид N2O5 и др.
K+1 и OH- → KOH, Mg+2 и OH- → Mg(OH)2.
Название: слово «гидроксид» в именительном падеже + название элемента в родительном падеже: гидроксид калия, гидроксид магния.
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Fe(OH)2 — гидроксид железа (II), Cr(OH)3 — гидроксид хрома (III).
Названия бескислородных кислот: корень русского названия элемента, образующего кислоту + суффикс «о» + «-водородная кислота», например: HBr — бромоводородная кислота, HCl — хлороводородная кислота, H2S — сероводородная кислота.
Названия кислородсодержащих кислот: русское название образующего элемента + «кислота», с учетом правил:
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| HAlO2 метаалюминиевая | метаалюминат |
| H3AlO3 ортоалюминиевая | ортоалюминат |
| HAsO3 метамышьяковая | метаарсенат |
| H3AsO4 ортомышьяковая | ортоарсенат |
| H3BO3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| HBrO3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H2CO3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| HClO2 хлористая | хлорит |
| HClO3 хлорноватая | хлорат |
| HClO4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| HMnO4 марганцовая | перманганат |
| HNO2 азотистая | нитрит |
| HNO3 азотная | нитрат |
| HPO3 метафосфорная | метафосфат |
| H3PO4 ортофосфорная | ортофосфат |
| H2S сероводородная | сульфид |
| H2SO3 сернистая | сульфит |
| H2SO4 серная | сульфат |
| H2SiO3 метакремниевая | метасиликат |
| H3SiO4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Для некоторых есть тривиальные названия: NH3 — аммиак, SiН4 — силан, PH3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
Химические свойства благородных газов
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
ZnO + H2SO4 → ZnSO4 + H2О,
ZnO+ 2NaOH + H2O → Na2[Zn(OH)4].
Все основания реагируют с кислотами (реакция нейтрализации):
1. Щелочи взаимодействуют с:
2. Нерастворимые основания разлагаются при нагревании: Cu(OH)2 → CuO + H2O.
Также о химических свойствах неорганических соединений можно почитать в статье «Классы неорганических соединений».