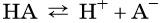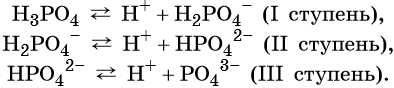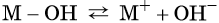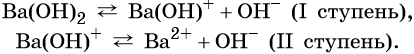Что называют катионами и анионами
Катионы и анионы в химии, таблица растворимости
Показатели растворимости в воде
Она помогает при решении химических уравнений, где участвуют ионные реакции. Если результатом будет получение нерастворимого вещества, то реакция возможна. Существует несколько вариантов:
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Электролиты
Это растворы или сплавы, проводящие электрический ток. Электропроводность их объясняется мобильностью ионов. Электролиты можно поделить на 2 группы:
Теория электролитической растворимости
Одновременно с диссоциацией проходит противоположный процесс – соединение ионов в молекулы. Кислоты – это такие электролиты, при распаде которых образуется катион – ион водорода. Основания – анионы – это гидроксид ионы. Щелочи – это основания, которые растворяются в воде. Электролиты, которые способны образовывать и катионы и анионы, называются амфотерными.
Это такая частица, в которой больше протонов или электронов, он будет называться анион или катион, в зависимости от того, чего больше: протонов или электронов. В качестве самостоятельных частиц они встречаются во многих агрегатных состояниях: газах, жидкостях, кристаллах и в плазме. Понятие и название ввёл в обиход Майкл Фарадей в 1834 году. Он изучал воздействие электричества на растворы кислот, щелочей и солей.
Простые ионы несут на себе ядро и электроны. Ядро составляет почти всю атомную массу и состоит из протонов и нейтронов. Количество протонов совпадает с порядковым номером атома в периодической системе и зарядом ядра. Ион не имеет определённых границ из-за волнового движения электронов, поэтому невозможно измерить их размеры.
Отрыв электрона от атома требует, в свою очередь, затрат энергии. Она называется энергия ионизации. Когда присоединяется электрон, происходит выделение энергии.
Катионы
Это частицы, носящие положительный заряд. Могут иметь разную величину заряда, например: Са2+ — двузарядный катион, Na+ — однозарядный катион. Мигрируют к отрицательному катоду в электрическом поле.
Анионы
Это элементы, имеющие отрицательный заряд. А также обладает различным количеством величины зарядов, например, CL- — однозарядный ион, SO42- — двухзарядный ион. Такие элементы входят в состав веществ, обладающих ионной кристаллической решёткой, в поваренной соли и многих органических соединениях.
Химия – наука, где возможно творить практически любые чудеса. Катион вы можете узнать по ссылке.
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Многоосновные кислоты диссоциируют ступенчато, например:
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
10. Степень диссоциации слабых электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Анион
Одноатомные анионы и многоатомные анионы
Подобно ионам, анионы могут быть:
Многоатомные ионы чаще всего являются анионами.
Они также могут быть:
Анионы и катионы
Примеры анионов
Сетевое издание «Новая Наука» (16+).
Сетевое издание, зарегистрировано 10.11.2021 г. Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор).
Свидетельство о регистрации Эл № ФС77-82267 от 10.11.2021 г.
Интернет-журнал Новая Наука каждый день сообщает о последних открытиях и достижениях в области науки и новых технологий. Читайте последние новости высоких технологий, науки и техники.
Перепечатка материалов без согласования допустима при наличии активной ссылки на страницу-источник.
Направляя нам электронное письмо или заполняя любую
регистрационную форму на сайте, Вы подтверждаете факт ознакомления и безоговорочного согласия с принятой у нас Политикой конфиденциальности.
Что такое катионы и анионы?
Справочные таблицы, в которых дана сероводородная аналитическая классификация анионов 1-3 групп, качественные реакции и групповые реагенты, а также аналитические сигналы на анионы.
Данная аналитическая классификация анионов основана на растворимости солей бария Ba2+ и серебра Ag+, и включает в себя 3 аналитические группы анионов.
Таблица аналитическая классификация анионов
Таблица аналитические сигналы на анионы первой группы
Таблица аналитические сигналы на анионы второй группы
| № | Реагенты | Анионы | ||
| Cl- | Br- | I- | ||
| 1. | AgNO3 в присутствии HNO3 | AgCl белый творожистый растворим в избытке NH4ОН | AgBr желто-белый, частично растворим в избытке NH4ОН, хорошо растворим в Na2S2O3 | AgI светложелтый, растворим в Na2S2O3 и в большом иодида калия |
| 2. | Хлорная вода в кислой среде | — | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
| 3. | диоксид марганца MnO2 в кислой среде | Свободный хлор, практически не окрашивает бензол-толуол | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
Таблица аналитические сигналы на анионы третьей группы
| № | Реагенты | Анионы | |
| NO3- | NO2- | ||
| 1. | металлический алюминий или цинк (Al,Zn) в щелочной среде | выделяется аммиак NH3 | — |
| 2. | металлическая медь (Cu) | выделяются буро-желтые пары диоксида азота (NO2) | — |
| 3. | дифениламин | раствор окрашивается в синий цвет | раствор окрашивается в синий цвет |
| 4. | сильные кислоты (HCl, H2SO4) | — | выделяются желто- бурые пары окислов азота |
| 5. | перманганат калия(KMnO4) | — | раствор перманганата калия обесцвечивается |
Таблица аналитическая классификация анионов на окислительно-восстановительных свойствах
Эта аналитическая классификация анионов основана на их окислительно-восстановительных свойствах. Она также включает три аналитические группы анионов.
| № группы | Анионы | Групповой реагент | Результат действия реагента |
| 1. Анионы-окислители | BrO3-, AsO43-, NO3-, NO2- | KI в сернокислой среде | Выделение иода I2 |
| 2. Анионы-восстановители | S2-, SO32-, S2O32-, AsO33- | I2 | |
| S2-, SO32-, S2O32-, AsO33-, NO2-, C2O42-, Cl-, Br-, I-, CN-, NCS- | KMnO4 в сернокислой среде | Обесцвечивание раствора KMnO4 | |
| 3. Индифферентные анионы | SO42-, CO32-, PO43-, CH3COO-, B4O72- (BO2-) | Нет реагента | — |
Качественные реакции на неорганические вещества и ионы
Представим себе такую ситуацию: Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку.
При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет. В этих случаях придется отличать вещества с применением других реагентов. В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют: NaOH + HCl = NaCl + H2O
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок: 2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
Качественные реакции на катионы
Качественные реакции на анионы
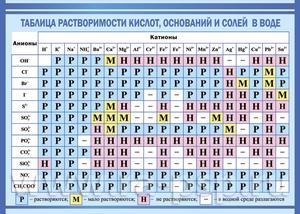
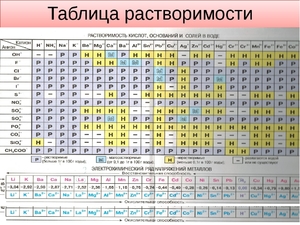
Таблица растворимости
Растворимостью называется способность одного или нескольких веществ вступать в реакцию с другими веществами таким образом, чтобы в результате получалась однородная система. При этом оба вещества распадаются на молекулы, атомы или ионы.
Наравне с таблицей периодической системы Д. И. Менделеева, таблица растворимости является основным теоретическим пособием при изучении химии. Не все вещества взаимодействуют между собой одинаково.
Начинающие химики, учащиеся школ, колледжей и вузов не всегда могут запомнить степень растворимости в воде тех или иных веществ. Именно поэтому таблицу периодической системы Менделеева и таблицу растворимости можно увидеть в каждом кабинете или классе химии, каждой лаборатории.
То или иное сочетание веществ из таблицы может вступать в семь различных реакций с водой:
Чаще всего таблица растворимости применяется при решении уравнений с участием ионных реакций. Реакция возможна только в том случае, если конечный продукт малорастворим или нерастворим вообще.
Условные обозначения в таблице растворимости:
| Р | Вещество хорошо растворимо в воде |
| М | Малорастворимо |
| Н | Практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах |
| РК | Нерастворимо в воде и растворяется только в сильных неорганических кислотах |
| НК | нерастворимо ни в воде, ни в кислотах |
| Г | полностью гидролизуется при растворении и не существует в контакте с водой |
| – | вещество вообще не существует |
| Катионы | Анионы | ||||||||||
| OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | – | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | – | – | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | – | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Что означает слово Катионы и анионы?
Катионы и анионы — это типы ионов, то есть атомы, которые приобрели или потеряли электроны через химические связи.
Атом, имеющий одинаковое количество протонов (положительный заряд) и электронов (отрицательный заряд), считается электрически нейтральным. Когда этот атом принимает или передает электроны, он называется ионом, который, в свою очередь, может быть:
Катион
Катион — это атом, который имеет положительный заряд, потому что в нем больше протонов, чем электронов.
Щелочные металлы (литий, натрий, калий, рубидий, цезий и францио), как правило, образуют катионы, поскольку в их валентном слое имеется только 1 электрон. Это означает, что энергия, необходимая для удаления этого электрона, очень мала, что делает эти элементы очень реактивными.
Катион представлен символом +, следующим за именем элемента. Количество потерянных электронов указывает на тип катиона:
Типы катионов также можно определить по количеству знаков +. Таким образом, элемент, представленный только +, является одновалентным катионом, в то время как другой элемент, представленный +++, является трехвалентным катионом.
Примеры катионов
Анион
Анион — это атом с отрицательным зарядом, потому что в нем больше электронов, чем протонов. Элементы семейства азота, калькогенов и галогенов имеют тенденцию образовывать анионы, потому что они легко принимают электроны.
Анион представлен символом — после имени элемента. Количество полученных электронов указывает на тип аниона:
Примеры анионов
Ионные Связи
Ионные или электровалентные связи представляют собой связи, которые возникают между катионами и анионами.
Элементы могут принимать, давать или делить электроны таким образом, чтобы их последний энергетический слой имел 8 электронов. Это известно как теория октетов.
Согласно теории октетов, атомы имеют тенденцию стабилизироваться, когда в валентном слое (последнем электронном слое) находится 8 электронов. Таким образом, будучи положительно заряженными, катионы связываются с отрицательно заряженными анионами. Таким образом, атомы дают или принимают электроны для достижения равновесия.
Связи, образованные между катионами и анионами, очень прочны и имеют тенденцию иметь следующие признаки:
Ионные связи образуют ионные соединения, такие как хлорид натрия (поваренная соль), образованный связью Na + (катион натрия) + Cl- (хлорид-анион) → NaCl.
Примеры ионных соединений
Некоторые примеры ионных соединений:
Катионный стол
Li +Fe + 2Na +Со + 2К +Ni + 2Rb +Sn + 2Cs +Pb + 2(NH 4 ) +Mn + 2Ag +Pt + 2Cu +Би + 3Hg +Al + 3Au +Cr + 3Mg + 2Au + 3Ca + 2Fe + 3Sr + 2Со + 3Ба + 2Ni + 3Zn + 2Sn + 4CD + 2Pb + 4Cu + 2Мн + 4Hg + 2Pt + 4
| литий | железистый |
| натрий | cobaltoso |
| калий | Niqueloso |
| рубидий | содержащий двухвалентное олово |
| цезий | Plumboso |
| аммоний | марганцевых |
| серебро | относящийся к платине |
| медь | висмут |
| Ртути | Нержавеющая сталь |
| Auroso | хром |
| магний | золотоносный |
| кальций | трехвалентного железа |
| стронций | кобальтовые |
| барий | Niquélico |
| цинк | оловянный |
| кадмий | свинцовый |
| двухвалентной | марганца |
| содержащий двухвалентную ртуть | платина |