Что называют изотермическим процессом
Изотермический процесс
Изотермический процесс (от др.-греч. ἴσος «равный» и θέρμη «жар») — термодинамический процесс, происходящий в физической системе при постоянной температуре.
Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
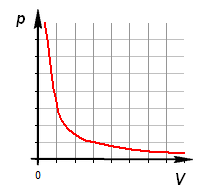
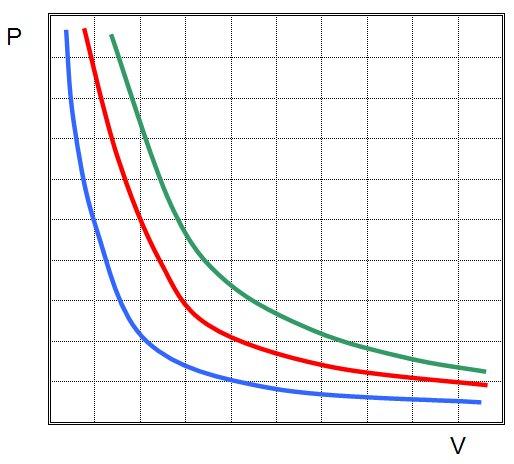
В идеальном газе при изотермическом процессе произведение давления на объём постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатах 
При изотермическом процессе системе, вообще говоря, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса записывается в виде:
Какой процесс называется изотермическим
Что такое изотермический процесс
Изотермический процесс – процесс изменения состояния идеального газа при постоянной температуре.
Главное условие: T=const
С разницей в 14 лет закон открыли Роберт Бойль (1662 г.) и Эдм Мариотт (1676 г.) Название дано в честь обоих ученых.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Закон Бойля-Мариотта
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
Закон выражается графиками:
1. Зависимость давления от объема:
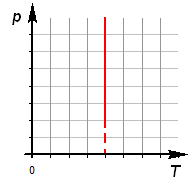
2. Зависимость давления от температуры:
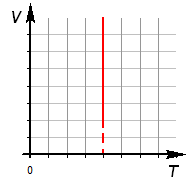
3. Зависимость объема от температуры:
Как изменяется внутренняя энергия при изотермическом процессе
Внутренняя энергия изменяется вместе с температурой. Отличительной чертой изотермического процесса является его протекание с постоянной температурой. Из этого следует, что внутренняя энергия не изменяется.
Формула количества теплоты в изотермическом процессе
Запишем первый закон термодинамики:
Поскольку температура постоянна, то изменение внутренней энергии равно нулю. Уравнение принимает вид:
Изопроцессы в газах.
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (p), объема (V), температуры (T).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Изобарный процесс.
Изобарный (или изобарический) процесс — это изменение термодинамической системы с условием не изменения давления (P = const). Изобарой называют линию, которая отображает изобарический процесс на графике. Этот процесс описывает закон Гей-Люссака.
Изохорный процесс.
Изохорный (или изохорический) процесс — это изменение термодинамической системы с условием не изменения объема (V = const). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где γ — показатель адиабаты, определяемый типом газа.
Термодинамическая система
Системой в термодинамике принято называть некоторую совокупность составляющих ее элементов, которые могут обмениваться между собой энергией. Как правило, этими элементами являются атомы и молекулы. Система находится в термодинамическом равновесии, когда все ее макроскопические характеристики не меняются во времени.

Системы бывают открытые, закрытые и изолированные. В открытых происходит обмен энергией и веществом с внешней средой, в закрытых системах возможен только обмен энергией с окружающей средой. Наконец, изолированные системы полностью предоставлены самим себе. Их энергия и количество вещества сохраняются с течением времени.
Отметим, что понятие термодинамической системы не связано с агрегатным состоянием материи. Так, вода и водяной пар в закрытом сосуде или лед, плавающий в стакане с водой, являются примерами термодинамических систем, в которых в равновесии одновременно находятся два агрегатных состояния одного и того же химического вещества.
Термодинамические параметры

Рассмотрим каждый из них подробнее в статье.
Закон Бойля-Мариотта
Во второй половине XVII века англичанин Роберт Бойль и француз Эдм Мариотт независимо друг от друга экспериментально установили следующее отношение для газовых систем:
В экспериментах они использовали разные газы. При этом произведение давления на объем всегда оставалось постоянным. Это уравнение называется законом Бойля-Мариотта. Графически функция P(V) представляет собой гиперболическую зависимость.
Мы только что рассмотрели изотермический процесс в идеальном газе. Понять выражение выше несложно, если вспомнить, как выглядит универсальное уравнение состояния для газовой системы:
Принцип Авогадро
В 1810 году, экспериментируя с разными газами, Амедео Авогадро пришел к удивительному выводу. Оказалось, что занимаемый газом объем является функцией только количества вещества при определенном давлении и температуре. Не важно, из каких молекул и атомов состоит газовая система, 1 моль любого газа всегда занимает один и тот же объем, если P=const и T=const.
Понять изложенный принцип не сложно, если обратиться снова к универсальному уравнению для идеального газа. Имеем:
V/n = R*T/P = const при P=const, T=const
Рассмотренный процесс является изобарно-изотермическим.
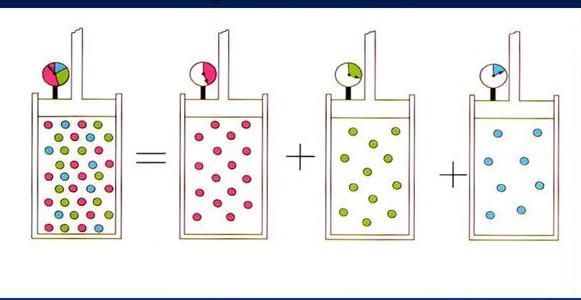
Принцип Авогадро положен в основу закона Дальтона. Если проводить смешение двух идеальных газов при постоянной температуре в сосуде с некоторым фиксированным объемом, то абсолютное давление в системе будет равно сумме парциальных давлений каждого компонента. В свою очередь парциальное давление компонента прямо пропорционально атомной доле его частиц в смеси:
P = ∑i=1m(Pi) = R*T/V*∑i=1m(ni)
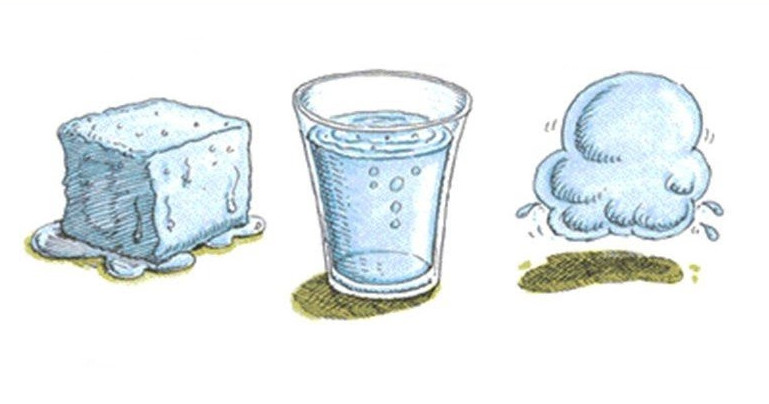
Переход между агрегатными состояниями вещества
Речь идет о процессах плавления твердого тела или кристаллизации жидкости, о процессах кипения жидкости или конденсации газа. Все эти переходы происходят либо с выделением, либо с поглощением тепла. Так, в результате кристаллизации молекулы жидкости теряют энергию, выделяя ее в окружающую среду. Последнее приводит к уменьшению кинетической энергии молекул и формированию из них определенной структуры (аморфной, кристаллической). Наоборот, плавление является эндотермическим процессом, то есть он идет с поглощением теплоты. Эта теплота расходуется на разрушение химических связей между молекулами и атомами в твердом теле.
Определение теплового эффекта перехода между агрегатными состояниями
Все термодинамические расчеты процессов кристаллизации, плавления, конденсации и кипения проводятся с использованием следующей формулы:
Изотермический процесс
Из Википедии — свободной энциклопедии
Изотермический [1] или изотермный [2] процесс (от др.-греч. ἴσος «равный» и θέρμη «жар») — термодинамический изопроцесс, происходящий в физической системе при постоянной температуре.
В идеальном газе при изотермическом процессе для неизменной массы газа произведение давления на объём постоянно (закон Бойля-Мариотта):
откуда при изменении объёма или давления, имеем:
P 1 ∗ V 1 = P 2 ∗ V 2 <\displaystyle P_<1>*V_<1>=P_<2>*V_<2>>
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса записывается в виде:
где учитывается, что внутренняя энергия системы в изотермическом процессе не изменяется. Таким образом, в изотермическом процессе вся теплота, полученная системой, расходуется на совершение системой работы над внешними телами.