Что называется уравнением состояния
Уравнение состояния вещества
Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
где n = N V – это количество частиц в единице объема или же концентрация частиц.
Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
где a V μ 2 – это внутреннее давление, обусловленное силами притяжения между молекулами, b – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
где d – это диаметр молекулы. Значение a рассчитывается по формуле:
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
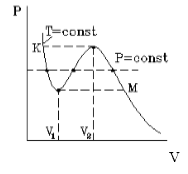
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на 2 фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте «извилины» изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси V (рисунок 2 ).
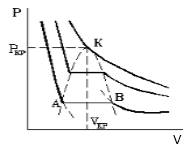
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
С учетом уравнения Менделеева-Клайперона:
V вместо объема, получаем:
Из уравнения Ван-Дер-Ваальса имеем:
Для идеального газа:
Уравнение состояния
| Уравнения состояния |
|---|
 |
| Статья является частью серии «Термодинамика». |
| Уравнение состояния идеального газа |
| Уравнение Ван-дер-Ваальса |
| Уравнение Дитеричи |
| Разделы термодинамики |
| Начала термодинамики |
| Уравнение состояния |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
Уравнение состояния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными.
Уравнение состояния системы не содержится в постулатах термодинамики и не может быть выведено из неё. Оно должно быть взято со стороны (из опыта или из модели, созданной в рамках статистической физики). Термодинамика же не рассматривает вопросы внутреннего устройства вещества.
Заметим, что соотношения, задаваемые уравнением состояния, справедливы только для состояний термодинамического равновесия.
Содержание
Виды уравнений состояния
Термическое уравнение состояния
Термическое уравнение состояния связывает макроскопические параметры системы. Для системы с постоянным числом частиц его общий вид можно записать так:
То есть, задать термическое уравнение состояния значит конкретизировать вид функции 
Калорическое уравнение состояния
Калорическое уравнение состояния показывает, как внутренняя энергия выражается через давление, объем и температуру. Для системы с постоянным числом частиц оно выглядит так:
или, учитывая, что давление можно выразить из термического уравнения,
Каноническое уравнение состояния
Каноническое уравнение, независимо от того, в каком из этих четырех видов оно представлено, содержит полную информацию о термических и калорических свойствах термодинамической системы.
См. также
Литература
| Твёрдое тело | Жидкость | Газ | Плазма Коллоид | Сверхкритическая жидкость | Сверхтекучая жидкость | Сверхтвёрдое тело | Вырожденная материя | Кварк-глюонная плазма | Конденсат Ферми-Дирака | Конденсат Бозе — Эйнштейна | Странная материя Переходные точки: точка плавления | точка кипения | тройная точка | критическая точка Другие понятия: уравнение состояния | кривая охлаждения |
Выделить Уравнение состояния и найти в: