Что называется титром раствора
Титр раствора
Титр раствора (от фр. titre — качество, характеристика) — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³).
Различают титр по растворённому веществу и титр по определяемому веществу (условный титр).
Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора.
Рассчитывается по формуле:



Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора.
Рассчитывается по формуле:



Условный титр и титр по растворённому веществу связаны следующей формулой:


См. также
Ссылки
Полезное
Смотреть что такое «Титр раствора» в других словарях:
титр раствора — число граммов растворённого вещества на 1 мл раствора. * * * ТИТР РАСТВОРА ТИТР РАСТВОРА, число граммов растворенного вещества в 1 мл раствора … Энциклопедический словарь
ТИТР РАСТВОРА — в аналитической химии количество растворённого вещества в граммах, содержащееся в 1 мл раствора. Напр. Т. (титр) 0,001 означает, что в 1 мл раствора содержится 0,001 г растворённого вещества … Большая политехническая энциклопедия
ТИТР РАСТВОРА — число граммов растворенного вещества в 1 мл раствора … Большой Энциклопедический словарь
ТИТР РАСТВОРА — число граммов растворённого в ва на 1 мл раствора … Естествознание. Энциклопедический словарь
титр — а, м. titre m. 1. хим., биол. В аналитической химии концентрация раствора. применяемого в объемном химическом анализе, выраженная в граммах на кубический миллиметр. Титр раствора. БАС 1. ♦ Титр бактерий это максимальное разведение исследуемой… … Исторический словарь галлицизмов русского языка
Титр (в аналитич. химии) — Титр (от франц. titre качество, характеристика), в аналитической химии концентрация раствора, выраженная количеством (в граммах) растворённого вещества в 1 мл раствора или количеством какого либо вещества, реагирующего с 1 мл данного раствора.… … Большая советская энциклопедия
Титр — Титр: Титр раствора в химии. Титры в кино и телевидении. Титр бактерий Титр в иммунохимическом анализе Титр в текстильной промышленности … Википедия
Титр — I (от франц. titre качество, характеристика) в аналитической химии (См. Аналитическая химия) концентрация раствора, выраженная количеством (в граммах) растворённого вещества в 1 мл раствора или количеством какого либо вещества,… … Большая советская энциклопедия
титр — а; м. (франц. titre) 1) Надпись на кадре в фильме, передающая слова действующих лиц или содержащая пояснительный текст. Титры кинофильма. Внутрикадровый титр. (субтитр) 2) хим. Концентрация раствора, употребляемого для титрования. Титр раствора … Словарь многих выражений
ТИТР — 1) вес шелковых нитей определенной длины; 2) в химии крепость раствора, измеряемая весом растворенного вещества в кубическом сантиметре (или другой объемной единице) его раствора. Полный словарь иностранных слов, вошедших в употребление в русском … Словарь иностранных слов русского языка
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа



МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННЫЙ СТАНДАРТ КАЧЕСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Титрованные растворы ОФС
Взамен ГФ XII, 1ч., ОФС 42-0071-07
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
Концентрация титрованного раствора (титранта) обычно выражается его молярностью, титром или титром по определяемому веществу.
Молярность – это выраженное в молях количество растворённого вещества, содержащееся в одном литре раствора. Раствор, содержащий x молей вещества в одном литре раствора, обозначают xМ раствором.
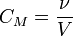
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Титр – это выраженная в миллиграммах масса растворенного вещества, содержащаяся в одном миллилитре раствора (размерность – мг/мл).
Титр титранта по определяемому веществу – это выраженная в миллиграммах масса определяемого вещества, эквивалентная одному миллилитру данного титранта. Титр титранта по определяемому веществу вычисляют, исходя из молярности или титра титранта с учётом стехиометрических коэффициентов уравнения химической реакции, протекающей при титровании, и молярных масс реагирующих веществ (размерность – мг/мл).
Иногда концентрацию раствора выражают числом грамм-эквивалентов вещества в одном литре раствора. Такие растворы называются нормальными и обозначаются символом «н.». Грамм-эквивалентом называется число граммов вещества, равное его эквиваленту. Эквивалент вещества – это такое количество вещества, которое реагирует с 1,008 г водорода или вытесняет такое же количество водорода из его соединений. Величина эквивалентной массы определяется, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений. Из этого определения следует, что эквивалент данного вещества может изменяться в различных реакциях; величина его зависит от той конкретной реакции, в которой вещество участвует.
Для приготовления титрованных растворов применяют химически чистые вещества или промышленного производства стандарт-титры (фиксаналы) для титриметрии. Допускается приготовление титрованного раствора приблизительно требуемой концентрации, несколько большей, чем требуется по расчету, который при необходимости можно довести до нужной концентрации путем разведения или укрепления.
Приготовленные титрованные растворы стандартизуют двумя способами: по стандартному титрованному раствору или по точной навеске исходного стандартного вещества. Перед стандартизацией титрованный раствор необходимо тщательно перемешать. Концентрацию титрованных растворов определяют путем достаточного количества титрований (не менее трех).
Если титрованный раствор используют в количественном анализе, в котором конечную точку титрования определяют электрометрическим методом (например, методом амперометрии или потенциометрии), раствор стандартизуют тем же методом. Состав среды, в которой стандартизуют титрованный раствор, должен быть таким же, как и тот, в котором он будет использован.
Если концентрация приготовленного титрованного раствора отличается от теоретически заданной (например, из-за длительного хранения), то необходимо вычислить поправочный коэффициент (К), представляющий собой отношение фактически полученной концентрации титрованного раствора к теоретически заданной.
Вычисление поправочного коэффициента производят одним из указанных ниже способов.
Способ 1 – по навеске исходного стандартного вещества:
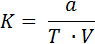
где а – навеска вещества, по которому устанавливают титр, г;
Т – количество вещества, по которому устанавливается титр,
содержащееся в 1 мл раствора заданной нормальности, г;
V – объем приготовленного раствора, израсходованный на титрование, мл.
Способ 2 – по титрованному раствору известной концентрации:
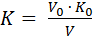
где V0 – объем раствора вещества, по которому устанавливается титр, мл;
V – объем приготовленного раствора, израсходованного на титрование, мл;
K0 – поправочный коэффициент раствора, по которому устанавливается титр.
Коэффициент К должен находиться в пределах от 0,98 до 1,02. Если коэффициент К отличается от указанных пределов (более чем на ±2 %), то раствор следует разбавить или укрепить на основании следующего расчета:
В случае разбавления раствора из величины К вычитают единицу и полученную разность умножают на 1000. Результат умножения соответствует количеству воды в миллилитрах, которое следует прибавить к каждому литру разбавляемого раствора. В случае укрепления из единицы вычитают коэффициент К и разность умножают на количество граммов исходного вещества, взятое для приготовления 1 л раствора. Полученное количество добавляют на каждый литр раствора. После этого раствор тщательно перемешивают.
Относительное стандартное отклонение при определении молярности не должно превышать 0,2 %
Титрованные растворы меньшей молярности можно приготовить посредством точного разведения более концентрированных титрованных растворов водой, свободной от углерода диоксида. Поправочные коэффициенты полученных разбавленных растворов такие же, как у исходных растворов. Исключение составляют титрованные растворы для окислительно-восстановительного титрования, которые после разбавления нуждаются в повторной установке титра. Методика установки титра должна быть приведена в фармакопейной статье.
Растворы с молярностью ниже 0,1 М готовят непосредственно перед использованием.
Так как при хранении концентрация титрованного раствора может измениться, необходимо перепроверять поправочные коэффициенты титрованных растворов. При описании титрованных растворов приведены особенности условий хранения и периодичность проверки коэффициента поправки отдельных титрованных растворов.
В описании каждого титрованного раствора указывается теоретическое содержание химически чистого вещества в миллиграммах в 1 мл раствора.
Титрованные растворы хранят при комнатной температуре, защищая их, при необходимости, от воздействия углерода диоксида и влаги воздуха и от прямых солнечных лучей.
Рекомендуется готовить, стандартизовать и использовать титрованные растворы при одной и той же температуре.
Количественный анализ. Титриметрический метод
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Количественный анализ. Титриметрический метод
Название „титриметрические” связано со словом титр, обозначающим концентрацию раствора (масса вещества в 1 см 3 раствора). Ранее более распространенным было название объемные методы анализа. Сейчас под объемным анализом понимают совокупность методов анализа, основанных на измерении объема жидкой, газовой или твердой фаз.
1. Определение и классификация методов объёмного анализа
Титриметрический (объёмный) метод анализа основан на регистрации объёма реагента, расходуемого на реакцию с определяемым веществом.
Титриметрические методы анализа подразделяют по типу реакции, лежащей в основе метода на четыре большие группы.
1. Протолитометрия
Методы кислотно-основного титрования основаны на протолитической реакции в водном растворе:
В соответствии с природой титранта (реагента) методы протолитометрии делят на:
Например, определение титра раствора соляной кислоты, раствора гидроксида калия, титруемой кислотности молока, определение кислотности хлеба и т.д.
2. Редоксометрия
Методы окислительно-восстановительного титрования основаны на реакциях, протекающих с изменением степеней окисления реагирующих веществ. Вещество может существовать в двух формах – окисленной (Ox) и восстановленной (Red), которые образуют сопряженную редокс — пару. В растворе протекает окислительно-восстановительная реакция:
| Ox1 + е → Red1 | │восстановление |
| Red2– е → Ox2 | │окисление |
Методы редоксометрии классифицируют в зависимости от названия титранта:
Например, определение содержания железа (II и III) в питьевой воде, остаточного хлора в воде, витамина С в фруктовых соках и т.д.
3. Комплексонометрия
Метод анализа основан на взаимодействии ионов металлов с моно- или полидентантными лигандами с образованием комплексных соединений.
К пробе добавляют индикатор. Раствор приобретает винно-красную окраску вследствие образования комплекса металла с индикатором:
| Me 2+ + HInd 2- | ↔ [Me Hind ] – + H + |
| Синий | Винно-красный |
Окрашенный раствор титруют раствором комплексона III (HY 3- ). Комплекс металла с индикатором разрушается вследствие образования комплексоната металла. Окраска раствора становится синий благодаря выделению индикатора в свободном виде, например:
| [Me HInd ] – + HY 3- ↔ | [MeY] 2- + Hind 2- |
| Винно-красный | Синий |
Например, определение жесткости воды, содержания кальция и магния в различных средах.
4. Осадительный анализ (седиметрия)
Метод анализа основан на реакциях осаждения определяемого компонента пробы. Согласно вида титранта различают следующие методы:
Например, определение хлоридов в колбасных изделиях.
2. Основные положения титриметрии
Принцип титриметрического анализа:
титриметрические методы анализа основаны на регистрации массы реагента, расходуемого на реакцию с определяемым веществом.
В основе проведения объёмного анализа лежит закон эквивалентов:
химические элементы и их соединения вступают в химические реакции друг с другом в строго определенных массовых количествах, соответствующих их химическим эквивалентам: m1 / m2 = Э1 / Э2
Реагент (титрант) добавляют к анализируемому раствору либо в твердом виде (порошок, таблетки, бумага, пропитанная реагентом), либо чаще всего в виде раствора с точно известной концентрацией реагента. Можно измерять массу израсходованного титранта, взвешивая сосуд с исследуемым раствором и добавляемым реагентом (гравиметрическое титрование), или объем титранта, пошедший на титрование. В последнем случае массу титранта выражают через его объем по формулам:
где T— титр раствора титранта, г/см 3 ;
V— объем раствора титранта, см 3 ;
Сн — нормальная концентрация раствора титранта, моль/дм ;
Э — эквивалент титранта, г/моль.
Титрант добавляют к точно отмеренному объему анализируемого раствора небольшими порциями. После добавления каждой новой порции титранта в системе, описываемой уравнением химической реакции, устанавливается равновесие, например:
где А — анализируемое вещество;
n, m — стехиометрические коэффициенты.
По мере протекания реакции равновесные концентрации определяемого вещества и титранта уменьшаются, а равновесные концентрации продуктов реакции увеличиваются. Когда будет израсходовано количество титранта, эквивалентное количеству титруемого вещества, реакция закончится. Этот момент называется точкой эквивалентности, которая описывается соотношением:
В точке эквивалентности произведение нормальности первого раствора на его объём равен произведению нормальности второго раствора на его объём. На практике фиксируют точку конца реакции, которая с какой-то степенью приближения соответствует точке эквивалентности. В химических методах анализа ее фиксируют визуально по заметному аналитическому эффекту (изменению окраски раствора, выпадению осадка), вызываемому каким-либо из исходных соединений, продуктов реакции или специально введенных в систему веществ — индикаторов. В физико-химических методах анализа конечную точку определяют по резкому изменению измеряемого физического параметра — рН, потенциала, электрической проводимости и т. д.
0,5% (отн.). Эти цифры зависят от чувствительности применяемых индикаторов и концентрации реагирующих растворов.
3. Стандартные растворы
Процесс любого измерения заключается в сравнении выбранного параметра объекта с аналогичным параметром эталона. В титриметрических анализах эталонами служат растворы с точно известной концентрацией (титром, нормальностью). Такие растворы называют стандартными (титрованными). Их можно приготовить несколькими способами:
Рассмотрим способы приготовления стандартных растворов.
1) Приготовление титрованного раствора по точной навеске стандартного вещества. Рассчитывают массу навески стандартного вещества, необходимую для приготовления раствора заданной концентрации в заданном объеме раствора. Массу навески вещества, взятую на аналитических весах с точностью 0,0002 г, количественно (полностью) переносят в мерную колбу заданной вместимости, растворяют в небольшом объёме воды, доводят до метки дистиллированной водой.
В первом способе в качестве исходных веществ можно применять только химически чистые устойчивые соединения, точно известного состава, отвечающие следующим требованиям:
Соединения, удовлетворяющие этим требованиям, называют стандартными исходными веществами или нормалями для установки титра других рабочих растворов. Примеры стандартных веществ: щавелевая кислота (H2C2O4•2H2O), тетраборат натрия (Na2B4O7•10H2O), карбонат натрия (Na2CO3), хлорид натрия (NaCl).
Задача: Рассчитайте массу навески для приготовления децинормального раствора 250,0 мл щавелевой кислоты (H2C2O4•2H2O).
Расчёт: 1. Рассчитаем массу навески по формуле: m = Сн.•Э•V
Найдем эквивалентную массу щавелевой кислоты по формуле:
3. Вычислим массу кислоты: m = 0,1•63•0,25=1,5750 г
2) Приготовление рабочего раствора по неточной навеске (KOH, NaOH, Na2S2O3). При этом нет необходимости отбирать точную навеску вещества, так как при всей тщательности взвешивания из таких веществ нельзя получить раствор с точной концентрацией. Поэтому для приготовления рабочих растворов навеску взвешивают на технических весах и применяют неточную мерную посуду. Для стандартизации рабочего раствора его титруют другим стандартным раствором.
Растворы, титр которых находят не по точной навеске, а устанавливают по тому или иному стандартному веществу, называют стандартизированными или растворами с установленным титром.
Так, нормальность раствора гидроксида натрия и перманганата натрия устанавливают по стандартному раствору щавелевой кислоты, а нормальность соляной кислоты – по исходному раствору тетрабората натрия.
Задача: Определите нормальность раствора KMnO4, если на титрование 10,0 мл его раствора было израсходовано 12,5 мл 0,1 н. раствора щавелевой кислоты.
Для определения нормальности раствора KMnO4 по итогам титрования используем уравнение титрования:
Н KMnO4= 12,5 · 0,1/ 10,0 = 0,1250 моль/л
3) Приготовление рабочего раствора разбавлением более концентрированного раствора (HCl, H2SO4, HNO3).
1. Рассчитаем массу (г) NaOH в 500 мл раствора при нормальной концентрации 0,1 н. по формуле:
m = Сн. •Э • V m = 0,1• 40 • 0,5 = 2,0 г
m = 2•100 / 13,28 = 15,1 г
З. С учётом плотности раствора рассчитаем его объём:
V= 15,1 / 1,145 = 13,2 мл.
Мерной пипеткой отбирают 13,2 мл концентрированного раствора щелочи, переносят в мерную колбу на 500 мл и разбавляют дистиллированной водой до требуемого объёма.
Задача: Нужно приготовить 0,02 н. раствор серной кислоты 500 мл из 0,1 н. раствора кислоты.
1. Определим массу серной кислоты в 0,02 н. растворе 500 мл.
2.Вычислим объём исходного раствора серной кислоты, в котором содержится 0,49 г кислоты.
V= m / Сн.· Э = 0,49 / 49 •0,1 = 0,1 л
Для приготовления раствора нужно 100 мл 0,1 н. раствора серной кислоты перенести в мерную колбу на 500 мл и разбавить дистиллированной водой до метки.
Определим объём исходного раствора по формуле:
Установление титров растворов — стандартизация — может быть осуществлено гравиметрическим и объемным методами. В последнем методе титр устанавливается быстрее, поэтому он в основном и используется. Точную навеску первичного стандарта (метод отдельных навесок) или раствор первичного стандарта (метод пипетирования) титруют стандартизируемым раствором. Правильность установки титра проверяют вычислением систематической ошибки установки титра.
4)Приготовление титрованного раствора из фиксанала.
Фиксанал – запаянная ампула, в которой находится точно известное количество вещества или раствора (0,1 моль·экв).
Содержимое ампулы количественно переводят в мерную колбу заданного объема, разбивая ампулу о вложенный в воронку боек, вторым бойком разбивают верхнее углубление ампулы, с помощью промывалки через отверстие тщательно промывают ампулу. Для промывки рекомендуется не менее, чем 6-кратный объем воды (по сравнению с вместимостью ампулы). Раствор доводят до метки дистиллированной водой и перемешивают. Из фиксанала готовят как стандартные, так и рабочие растворы. Это быстрый и достаточно точный способ приготовления титрованных растворов.
Для каждого титриметрического метода разработаны методики стандартизации применяемых титрантов, даются рекомендации по выбору первичных стандартов. Необходимо помнить, что характеристики стандартных растворов должны быть определены с необходимой точностью. Титр, молярность и нормальность определяют до четвертой значащей цифры, не считая нулей после запятой (например, TNaOH = 0,004014 г/см 3 ; СKMnO4 = 0,04995 н.).
Задача: Вычислите объём 0,02 н. раствора НСl, который можно приготовить из фиксанала (0,1 моль-экв).
Определим степень разбавления, для этого исходную концентрацию делим на искомую:
Для приготовления 0,02 н. раствора НСl необходимо фиксанал количественно перенести в мерную колбу на 5 литров и объём раствора довести дист. водой до метки.







