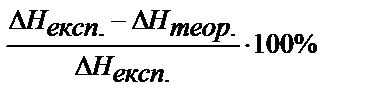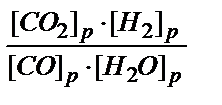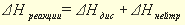Что называется теплотой нейтрализации
Большая Энциклопедия Нефти и Газа
Теплотой нейтрализации называют количество теплоты, выделяющееся при взаимодействии грамм-эквивалента кислоты с грамм-эквивалентом щелочи. [31]
Теплотой нейтрализации называется количество теплоты, выделяющееся при нейтрализации эквивалента кислоты эквивалентом основания. Так как теплота растворения кислоты, основания и образующейся соли зависит от концентрации растворов, то при нейтрализации концентрированных растворов кислот и щелочей в величинах теплот нейтрализации не обнаруживается простой закономерности. [32]
Помимо теплоты нейтрализации выделяющейся при вливании раствора кислоты в раствор щелочи в тепловой эффект входят теплоты разведения кислоты щелочью и щелочи кислотой. [36]
Поэтому теплота нейтрализации зависит от природы и концентрации взаимодействующих кислот и оснований. [37]
Однако теплота нейтрализации для слабых кислот и оснований в значительной мере варьирует благодаря неполной их диссоциации в растворе. [38]
Поэтому теплота нейтрализации ДЯХ первой реакции равна теплоте нейтрализации ДЯ2 второй реакции. Надо иметь в виду, что ионы в водном растворе гидратированы. [39]
Постоянство теплоты нейтрализации не наблюдается, когда в реакции нейтрализации участвуют слабые кислоты и слабые основания. Это объясняется тем, что при применении слабых электролитов на тепловой эффект нейтрализации накладывается теплота диссоциации, которая представляет собой эндотермический процесс. [41]
Постоянство теплоты нейтрализации не наблюдается, когда в реакции нейтрализации участвуют слабые кислоты и слабые основания. Это объясняется тем, что при применении слабых электролитов на тепловой эффект нейтрализации накладывается теплота диссоциации, которая представляет собой сумму изменения теплового эффекта при распаде молекул на ионы и гидратации последних. [42]
Величина теплоты нейтрализации зависит от степени диссоциации взаимодейстиующих кислот и оснований и от характера ядра органического соединения и имеющихся заместителей. [43]
Теплота нейтрализации и её определение
ХОД РАБОТЫ
Теплота гидратации соли и её определение
Физико-химический процесс взаимодействия частиц растворенного вещества с молекулами воды (растворителя) называется гидратацией. В процессе гидратации образуются сложные пространственные структуры, называемые гидратами, и при этом в окружающую среду выделяется энергия в виде тепла.
Тепловой эффект реакции образования 1 моль гидратированной соли из безводной соли называется теплотой гидратации.
При растворении в воде безводной соли, способной образовывать гидраты, последовательно протекают два процесса: гидратация и растворение образовавшегося кристаллогидрата. Например:
Растворение электролитов сопровождается процессом электролитической диссоциации. Теплота гидратации молекулы равна сумме теплот гидратации образовавшихся при этом ионов с учетом теплоты диссоциации. Процесс гидратации-экзотермический.
Приближенно теплота гидратации вещества может быть определена как разность между теплотами растворения безводной соли и ее кристаллогидрата:
Таким образом, для определения теплоты гидратации молекул необходимо предварительно определить теплоту растворения безводной соли и теплоту растворения кристаллогидрата этой соли.
Теплоту растворения безводного сульфата меди CuS04 и кристаллогидрата CuS04×5H20 необходимо определить, используя лабораторный калориметр и методику проведения работы 1.
Для более точного определения теплоты гидратации необходимо получить навески по 10-15 г кристаллогидрата и безводной соли сульфата меди. Необходимо знать, что безводная соль меди легко поглощает воду из воздуха и переходит в гидратированное состояние, поэтому безводную соль необходимо взвешивать непосредственно перед опытом. По полученным данным необходимо рассчитать теплоты растворения безводной соли и кристаллогидрата, а затем из соотношения (3) определить теплоту гидратации. Рассчитайте относительную ошибку опыта в процентах, используя полученные данные и данные табл.2.
Теплота нейтрализации равна количеству теплоты, выделяющейся при реакции нейтрализации эквивалентных количеств кислоты и щелочи с образованием одного моля жидкой воды. В случае разбавленных растворов нейтрализация сильных кислот сильным основанием сопровождается, независимо от их природы, выделением 55,9 кДж/моль тепла. Это связано с тем, что при взаимодействии сильных кислот и оснований, полностью диссоциированных в водных растворах, образуются молекулы воды:
Таким образом, теплота нейтрализации 1 эквивалента сильной кислоты 1 эквивалентом основания равна теплоте образования одного моля жидкой воды из ионов водорода и гидроксид-ионов. Поэтому тепловые эффекты таких реакций одинаковы.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Определение теплового эффекта реакции нейтрализации
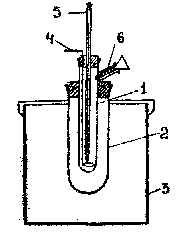
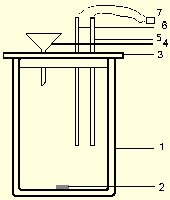
Опыт проводится в калориметре (риc. 3).
Рис.3. Стеклянный калориметр
Калориметр состоит из реакционного сосуда (1) емкостью 50 мл, помещенного в изотермическую оболочку (2) и (3). В пробке, закрывающей реакционный сосуд, имеются отверстия для мешалки (4) и термометра (5). Растворы реагирующих веществ наливают через боковой отросток (6).
Нейтрализации слабых кислот и оснований предшествует процесс диссоциации слабой кислоты (основания) на ионы, поэтому суммарная теплота нейтрализации в данном случае меньше, чем 55,9 кДж / моль, то есть, по закону Гесса можно определить теплоту диссоциации.
Данный опыт удобно выполнять вдвоем или втроем, так как необходимо одновременно перемешивать жидкость, следить по секундомеру, фиксировать положение ртутного столбика в термометре и производить запись экспериментальных данных.
Используя исходные 1н. растворы кислот и оснований, отмеряют в 4 стаканчика по 25 мл кислоты и основания в соответствии с полученной задачей (табл.1).
Индивидуальные задания по определению теплоты нейтрализации:
| Вариант | Задание | Вариант | Задание |
| NaOH + HCl NaOH + HАc | KOH + HCl NH4OH + HCl | ||
| NaOH + H2SO4 KOH + HАc | KOH + H2SO4 NH4OH + H2SO4 | ||
| NaOH + HNO3 NH4OH + HNO3 | NaOH + HNO3 KOH + HAc |
Через воронку внутреннего сосуда калориметра аккуратно переливают раствор кислоты во внутренний сосуд. В течение нескольких минут измеряют температурный ход калориметра при постоянном плавном перемешивании кислоты, фиксируют показания термометра с точностью до десятых долей градуса каждые 0,5 минуты. Если в ходе измерений в течение 5 минут изменение температуры равномерное или небольшое, начинают эксперимент, не прекращая перемешивать раствор кислоты.
Переливают через воронку во внутренний сосуд калориметра приготовленный раствор основания той же концентрации. Аккуратно перемешивают мешалкой раствор и следят за быстрым повышением температуры, пытаясь измерять температуру системы через возможно малые интервалы времени (5-10 с). Фиксируют максимальное значение (tк) («скачок» температуры).
После того, как рост температуры прекратится и станет равномерно снижаться, продолжают измерения еще не менее 3 минут при постоянном перемешивании раствора.
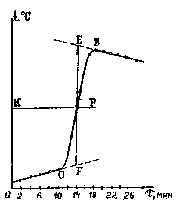
При построении графика следует помнить, что поскольку все измерения (времени и температуры) проводятся с определенной ошибкой, наблюдается некоторый разброс экспериментальных данных. Поэтому линии на графике проводят не строго через экспериментальные точки, а в виде плавной кривой. Уточняют по графику Δt реакции.
Рис. 4. График изменения температуры во времени
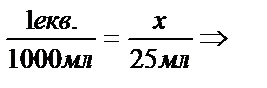
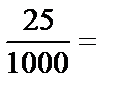
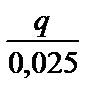
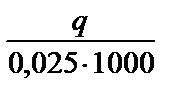
Оценивают погрешность полученного значения теплоты нейтрализации относительно табличного значения:
П =
Зная, что при образовании 1 моль воды из ионов при комнатной температуре выделяется 55,9 кДж, по закону Гесса определяют теплоту диссоциации уксусной кислоты или гидроксида аммония:
Результаты вычислений заносятся в таблицу.
— На основании экспериментальных и расчетных данных оцените силу изученных кислот и оснований;
— Почему тепловой эффект этой реакции для сильных кислот и щелочей в разбавленных растворах не зависит от их природы?
— Объясните отклонения экспериментально полученной теплоты нейтрализации от теоретической.
Опыт 2. Определение теплоты гидратации соли (элементы НИРС)
При выполнении данного опыта необходимо помнить, что теплотой гидратации является количество тепла, затрачиваемое на образование 1 моль твердого кристаллогидрата из твердой безводной соли и соответствующего количества воды. Эту величину находят расчетным путем, основываясь на калориметрических данных по теплотам растворения безводной соли и кристаллогидрата в достаточно больших количествах воды.
Процесс образования раствора безводной соли МеХn в воде осуществляется в две стадии: 1)процесс образования кристаллогидрата МеХn·mН2O; 2)растворение МеХn·mН2O:
1. Определение постоянной калориметра:
а) по известной теплоте растворения КNО3
Для этого тщательно растирают соль в фарфоровой ступке и взвешивают с точностью до 0,01 г 2 г соли. Реакционный сосуд заполняют точно 50 мл дистиллированной воды, закрывают ее пробкой и закрепляют в ней термометр и мешалку. После установления постоянного значения температуры в калориметре, быстро высыпают навеску нитрата калия и, размешивая аккуратно раствор, наблюдают за изменением температуры, записывая показания термометра каждые полминуты. Рассчитывают Δt после того, как указано выше.
Определяют значение постоянной калориметра К по уравнению:
б) по известному количеству теплоты q, сообщенного калориметру.
2. Определение теплоты растворения безводной соли и ее кристаллогидрата
Для проведения опыта используют навески солей, полученных у преподавателя в соответствии с вариантами заданий (табл. 2).
Варианты заданий и значение ΔН о растворения солей
Соль берут в количестве 0,005-0,01 моль и взвешивают с точностью до 0,01 г, предварительно растерев в порошок. В калориметр наливают точно 50 мл дистиллированной воды, закрепляют термометр и мешалку. В течение нескольких минут измеряют температурный ход калориметра при постоянном плавном перемешивании воды, фиксируя показания термометра с точностью до десятых долей градуса каждые 0,5 минуты.
Если в ходе измерений в течение 5 минут изменение температуры равномерное или небольшое, начинают эксперимент, не прекращая перемешивать воду: быстро высыпают в калориметр навеску соли и, перемешивая раствор, проводят измерения температуры до полного растворения соли (примерно в течение 2-3 минут). Фиксируют максимальное значение (tк). После того, как рост температуры прекратится и температура станет равномерно снижаться, продолжают замеры еще 3-4 минуты при постоянном перемешивании раствора.
Обработка данных и вычисления:
Молярную интегральную теплоту растворения соли и ее кристаллогидрата DНраств МеХn×m Н2O определяют по формуле:
Определяют теплоту гидратообразования по формуле:
Экспериментальные данные для расчёта значения DН 0 раств
| Соль | m, г | n, моль | Dt | Значения DН 0 раств | Относит. ошибка, % |
| табл. | эксп. | ||||
| МеХn | |||||
| МеХn×mН2 О |
В выводах укажите: как с помощью следствий из закона Гесса можно определить ΔН 0 гидратации?
Скорость протекания химических реакций и химическое равновесие
Необходимым условием протекания химического процесса является столкновение молекул. Поэтому необходимо внимательно рассмотреть положения теории активных столкновений, согласно которой число активных столкновений (Nа) равно:
A B A … B A — B
| + | 
A B A … B A — B
исходное состояние переходное состояние конечное состояние
(исходные реагенты) (активированный комплекс) (продукты реакции)
Для термодинамически разрешенных (ΔG 0 а ·[В] b
Более универсальной характеристикой зависимости скорости реакции от температуры является уравнение С.Аррениуса:
Вопрос химического равновесия следует рассматривать, исходя из того, что все химические реакции можно разделить на обратимые и практически необратимые. В момент наступления равновесия прямая и обратная реакции не прекращаются, а продолжают протекать с равными скоростями, то есть равновесие является динамичным. Для реакции, записываемой в общем виде: aА+bВ ↔ cС+dD в состоянии равновесия, выполняется соотношение: 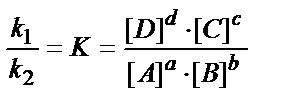
Следует отметить, что в выражении константы равновесия гетерогенных реакций входят только концентрации веществ, находящихся в жидкой и в газовой фазе, так как концентрации твердых веществ условились считать постоянными (равными 1). Значение константы равновесия не зависит от концентрации, парциальных давлений для реакций в газовой фазе, но зависит от природы реагирующих веществ и температуры. Использование катализаторов не изменяет константу равновесия, а лишь сокращает время, необходимое для достижения состояния равновесия.
Задача 1. Как изменится скорость прямой реакции 2NO + Br2 → 2NOBr, если давление в системе увеличить в 3 раза?
Решение. Обозначим исходные давления NO через Р1, а Br2 через Р2, тогда скорость реакции равна: υ1 = kp×P 2 1×P2. При увеличении общего давления в три раза парциальные давления тоже увеличатся в три раза NO = 3P1, Br2 = 3P2, а скорость реакции υ2 = kp×(3P1) 2 ×(3P2). Þ υ2/υ1= 27. Таким образом, скорость возрастает в 27 раз.
Задача 2. Как возрастет скорость реакции при повышении температуры от 10 до 100 0 С, если температурный коэффициент скорости равен 2?
Решение. Используем правило Вант-Гоффа
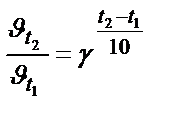
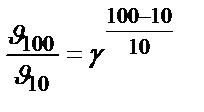
. Скорость возрастет в 512 раз.
Задача 3. Для равновесной системы СО + Н2О ↔ СО2 + Н2 константа равна: К = 1. Определить концентрации всех веществ в состоянии равновесия, если начальные концентрации [CO] = 2 и [H2O] = 3 моль / л.
Решение. Для данной равновесной системы выражение константы равновесия имеет вид: К=
Поскольку СОравн = СОнач.– СОрасх., то [СО]равн = (2-х), [Н2О]равн = (3-х). То есть, 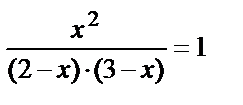
Что называется теплотой нейтрализации
Глава 2. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
2.1. Теоретическая часть
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. Все химические процессы сопровождаются выделением или поглощением теплоты. Реакции, сопровождающиеся выделением теплоты из системы в окружающую среду, называются экзотермическими, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называется теплотой реакции Qр, а противоположная ему по знаку величина, описывающая изменение состояния системы в результате протекания реакции энтальпией реакции 
В качестве основной единицы измерения теплоты в системе СИ установлен джоуль. В качестве единицы измерения теплоты встречается также калория, равная 4,184 Дж. В настоящее время она сохраняется как внесистемная единица для сравнения результатов современных работ с экспериментальными и справочными данными, накопленными за многие предыдущие годы.
Для описания тепловых явлений в химических реакциях принято пользоваться так называемыми термохимическими уравнениями. Термохимические уравнения записываются как обычные уравнения химических реакций, но с указанием величины и знака теплового эффекта реакции. В случае экзотермических реакций с правой стороны уравнения отмечают количество выделившейся теплоты со знаком «плюс», а в случае эндотермических реакций — количество поглощенной теплоты со знаком «минус». При этом у формулы каждого вещества индексом указывается его физическое состояние: газообразное (г), жидкое (ж), кристаллическое (к) или раствор (р-р).Существует термодинамический способ записи термохимических уравнений — когда в самом уравнении тепловой эффект не указывается, а изменение энтальпии реакции (
В данной реакции Q > 0, соответственно, 
Расчеты тепловых эффектов химических реакций основаны на применении закона Гесса (1836 г.): Тепловой эффект химической реакции при постоянном давлении и объеме, не зависит от способа ее проведения, а зависит лишь от начального и конечного состояния реагирующих веществ.
Например, растворение безводного сульфата меди:






Значения теплоты растворения безводной соли Q и кристаллогидрата Q2 известны и составляют 66,11 и –11,5 кДж соответственно. Тогда тепловой эффект реакции образования кристаллогидрата может быть рассчитан по формуле:
Q1 = Q – Q2 = 66,11 кДж – (–11,51 кДж) = 77,69 кДж, (2.5)
соответственно энтальпия равна 
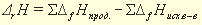
Например, значение энтальпии реакции между растворами сильной кислоты и сильного основания может быть получено по табличным данным энтальпий образования исходных веществ., если представить эту реакцию:, например
может быть получено по табулированным энтальпиям образования в виде реакций между ионами, поскольку эта реакция в действительности является реакцией между ионами H + и OH – :
Табличные значения энтальпий образования (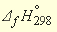




–285,84 – (–229,94) = –55,9 кДж/моль
При нейтрализации слабой кислоты сильным основанием или сильной кислоты слабым основанием тепловой эффект реакции будет зависеть от того, какая слабая кислота или слабое основание вступает в реакцию. (Другими словами от природы этих веществ). Это связано с тем, что слабые кислоты и основания существуют в растворах преимущественно в виде молекул. Например, при нейтрализации уксусной кислоты щелочью:
в действительности идет следующая реакция:
которой соответствует энтальпия 
В то же время реакцию (2.8) можно представить в виде суммы двух процессов:
1) диссоциации кислоты
CH3COOH = CH3COO + Н + 
2) и нейтрализации возникающих при этом ионов H + :
H + + ОН – = Н2О 
Тогда, по закону Гесса, энтальпия ее равна сумме энтальпий этих реакций:
Следовательно, если известныизмерить энтальпии реакций нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием, то по этим данным можно найти энтальпияю реакции диссоциации слабой кислоты может быть рассчитана по этим данным:
Общий вид используемой калориметрической установки
Рис.2.2 Схематическое изображение калориметрического стакана.
Если калориметрическая установка работает с компьютером, то сбор данных и построение графика осуществляется автоматически.
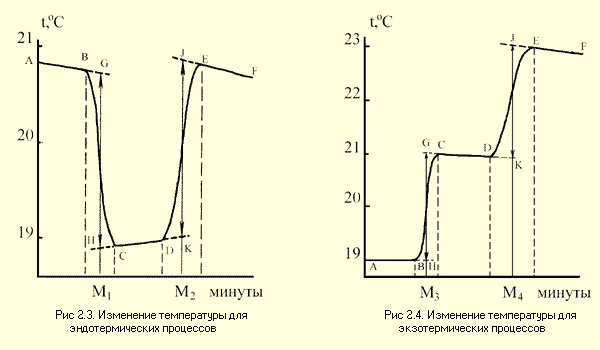
Примерные графики изменения температуры для экзотермических и эндотермических процессов представлены на рис.2.3 и 2.4.
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру установки (участок АВ на рис. 2.3 и 2.4).
Участок ВС на графиках соответствует собственно реакции: экзндотермической на рис. 2.3 и экзотермической на рис.2.4. В результате реакции наблюдается значительное изменение температуры калориметра (
Наличие небольшого наклона на графике температурной зависимости в начальном (АВ) и конечном (СD) периодах, свидетельствует о том, что во время опыта имеет место некоторый теплообмен калориметра с окружающей средой. В расчетах теплообмен учитывается следующим образом. Прямая AB экстраполируется вправо, а прямая CD влево. Интервал времени от B до C делится пополам и через эту точку проводится перпендикуляр к оси абсцисс до пересечения его с экстраполированными участками прямых АВ и СД (точки H,G). Величина отрезка HG соответствует изменению температуры калориметрической системы 
Тепловой эффект химической реакции может быть рассчитан по формуле
Q = K
Количество тепловой энергии qэл,, сообщенное калориметрической системе при нагреве,, вычисляется по формуле Джоуля:
Тепловое значение калориметра:
K = qэл/
Подставив значение K в формулу (2.11), получаем значение теплового эффекта реакции.
Измеренный тепловой эффект следует отнести к 1 моль вещества, для чего необходимо разделить его на число молей (n ) того из участников реакции, который находится в недостатке, тогда:
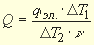
Увеличивается или уменьшается при этом энтальпия системы? Чему равно изменение энтальпии?
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами.. Экспериментально определить теплоты растворения кристаллогидрата CuSO4• 5H20O и безводной соли CuSO4. Оценить достоверность полученных результатов.
Дистиллированная вода, безводный CuSO4, CuSO4• 5H20O.
Калориметрическая установка, технические весы, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл.
2.2.4. Порядок выполнения эксперимента
Опыт 1. Определение теплоты растворения кристаллогидрата CuSO4•5H2O.
Начинающим рекомендуется работать вдвоем. Один студент следит за показаниями температуры и времени на дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» и диктует эти данные второму студенту, который заносит данные в таблицу 1 в рабочем журнале.)
Взвесьте с точностью до сотых 15 г CuSO4•5H2O.
В калориметрический стакан с помощью мерной колбы налейте 150 мл дистиллированной воды, температура которой должна быть близка к комнатной. Оставьте небольшое количество воды (
Опустите в калориметрический стакан сердечник магнитной мешалки и включите в розетку 220 В блок питания.
Нажмите кнопку включения на блоке питания (при этом на блоке питания должна загореться красная лампочка).
Нажмите и удерживайте в течение 2 сек. кнопку «ВКЛ» (рис.2 Приложения) на измерительном преобразователе «ЭКСПЕРТ-001-3» (при этом начнет светиться его жидкокристаллический дисплей). Первая надпись на ж/к дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» показывает уровень зарядки собственных аккумуляторов преобразователя. При величине менее 30 % необходимо зарядить аккумуляторы при помощи сетевого адаптера.
Вращая ручку включения магнитной мешалки, добейтесь оптимальной скорости вращения сердечника магнитной мешалки.
Выберите время работы электрического нагревателя (с) при определении теплового значения калориметра. Для этого на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3» нажмите кнопку «Ф2» и далее кнопку «ЧИСЛ». Цифровыми кнопками наберите время работы нагревателя, с. Рекомендуемое время 200 с. После установки времени нагрева два раза нажмите кнопку «ВВОД».
Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР».
Начните выполнение опыта, нажав кнопку «ИЗМ». На дисплее появятся данные работы секундомера, работающего в режиме прямого отсчета времени и значения температуры в калориметрическом стакане.
Определите тепловой ход калориметрической установки. (Участок АВ на рис. 2.3) При работе в ручном режиме записывайте в рабочий журнал в таблицу 1 показания температуры через каждые 30 с. в течение пяти минут. Если измерения показывают, что в течение 5 мин температурные изменения достаточно равномерны и невелики, начинайте эксперимент.
В определенный момент времени, отметив его в рабочем журнале, высыпьте в калориметрический стакан через сухую воронку приготовленную навеску кристаллогидрата сульфата меди CuSO4•5H2O. Оставшейся в мерной колбе водой смойте остатки соли с воронки.
| Время измерений, с | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 |
| Температура измерений, о С |
За счет растворения соли происходит быстрое изменение температуры, поэтому, пока наблюдается рост температуры, фиксирутефиксируйте значения температуры через возможно малые промежутки времени (каждые 5–10 с).
После того, как растворение соли закончится, изменение температуры замедлится и температурный ход снова станет равномерным (участок СD на рис. 2.3), продолжайте измерения температуры через 30 с. еще в течение 5 мин.
После отключения тока нагревателя, рост температуры замедлится, а затем температура начнет медленно падать. Фиксируйте изменение температуры через каждые 30 с еще в течение 5мин..
Нажмите клавишу «ОТКЛ» на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3».
Выполните команду «Стоп» на экране монитора компьютера.
При работе установки с компьютером измерения температуры в зависимости от времени в течении всего эксперимента будут фиксироваться автоматически. В результате на мониторе компьютера появиться график, соответствующий изменению температуры системы в течении всего эксперимента. После его окончания расечатайтераспечатайте полученный график на принтере.
Опыт 2. Определение теплоты растворения безводной соли CuSO4
Взвесьте с точностью до 0,01 г
Затем проведите опыт по определению теплоты растворения безводной соли CuSO4. Опыт выполняется так же, как и опыт 1.
Результаты температурных измерений представьте в виде графика.
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Экспериментально определить теплоты нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием. Оценить достоверность полученных результатов.
Дистиллированная вода, 0,4 М HCl, 0,4 M CH3COOH, 6 М KOH.
Калориметрическая установка, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл
2.3.4. Порядок выполнения эксперимента
Опыт 3 Определение теплоты нейтрализации сильной кислоты сильным основанием
Определение теплоты нейтрализации сильной кислоты и сильного основания проводите в калориметрической установке, которая была описана выше.
С помощью мерной колбы налейте в калориметрический стакан 150 мл 0,4 М. раствора соляной кислоты. Оставшиеся в колбе следы соляной кислоты смойте в калориметр небольшим количеством дистиллированной воды.
В мерный цилиндр налейте 12 мл 6 М раствора КОН.
Опустите в калориметрический стакан сердечник магнитной мешалки, включите блок питания установки и, вращая ручку регулировки вращения магнитной мешалки, добейтесь оптимальной скорости ее вращения.
Выберите время работы электрического нагревателя, так как это описано в опыте 1. Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР» и начните выполнение опыта, нажав кнопку «ИЗМ».
Для того, чтобы результаты измерения фиксировались компьютером, одновременно выполните команду «СТАРТ» в меню программы«Expert001.exe» измерения данных на компьютере.
Определите тепловой ход калориметрической установки (участок АВ на рис. 2.4), записывая в таблицу 1 показания температуры через каждые 30 с. в течение 5 минут.
Влейте через воронку в калориметрический стакан 12 мл 6 М раствора КОН и с этого момента записывайте изменение температуры в калориметрической системе через возможно малые интервалы времени (5-10 с).
После того, как температура стабилизируется, в течение 5 минут фиксируйте изменение температуры через каждые 30 с.
Определите тепловое значение калориметрической установки как это описано в опыте 1 и закончите эксперимент нажатием клавиши «ОТКЛ». Выполните команду «Стоп» на экране монитора компьютера.
Постройте график зависимости температуры калориметрической системы в зависимости от времени или распечатайте его на компьютере.
Опыт 4. Определение теплоты нейтрализации слабой кислоты сильным основанием
Работу проводите так же, как и в опыте 3, только для реакции нейтрализации возьмите 150 мл 0,4 М раствора уксусной кислоты.
Рк +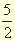
Чему равна энтальпия образования пентахлорида фосфора?