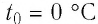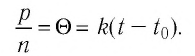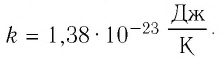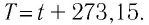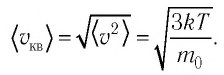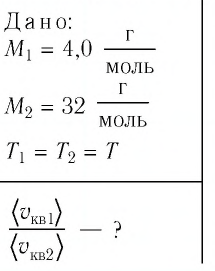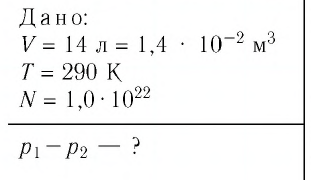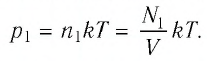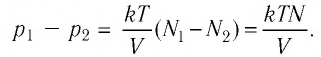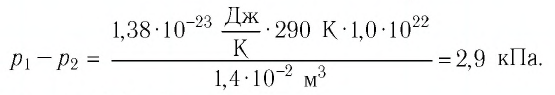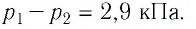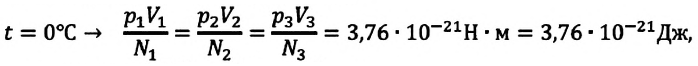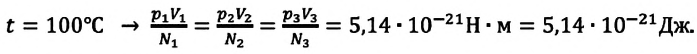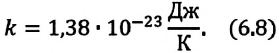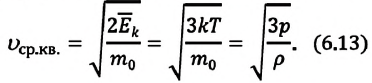Что называется состоянием теплового равновесия
Содержание:
Тепловое равновесие:
Температура — мера средней кинетической энергии теплового движения частиц вещества
В повседневной жизни под температурой мы понимаем степень нагретости тела (холодное, тёплое, горячее). Такой подход является довольно субъективным, он зависит не только от состояния рассматриваемого тела, но и от наших ощущений. Чтобы избежать субъективной неопределённости, необходимо установить способ измерения температуры.
Тепловое равновесие
Если привести в соприкосновение два тела, то молекулы этих тел, взаимодействуя между собой, будут обмениваться энергией. При этом молекулы с большей кинетической энергией передают часть энергии молекулам с меньшей кинетической энергией. В результате средняя кинетическая энергия теплового движения молекул одного тела увеличивается, а другого — уменьшается. Отдающее энергию тело называют более нагретым, а тело, к которому энергия переходит, — менее нагретым. Как показывает опыт, такой переход энергии продолжается до тех пор, пока не установится некоторое состояние, в котором тела могут находиться сколь угодно долго. В этом состоянии степень нагретости тел становится и остаётся одинаковой, следовательно, у тел одинаковая температура. Это учитывают при измерении температуры тела. Термометр приводят в соприкосновение с телом, но отсчёт его показаний выполняют не сразу, а через некоторый промежуток времени. Это необходимо для того, чтобы между термометром и телом установилось тепловое равновесие.
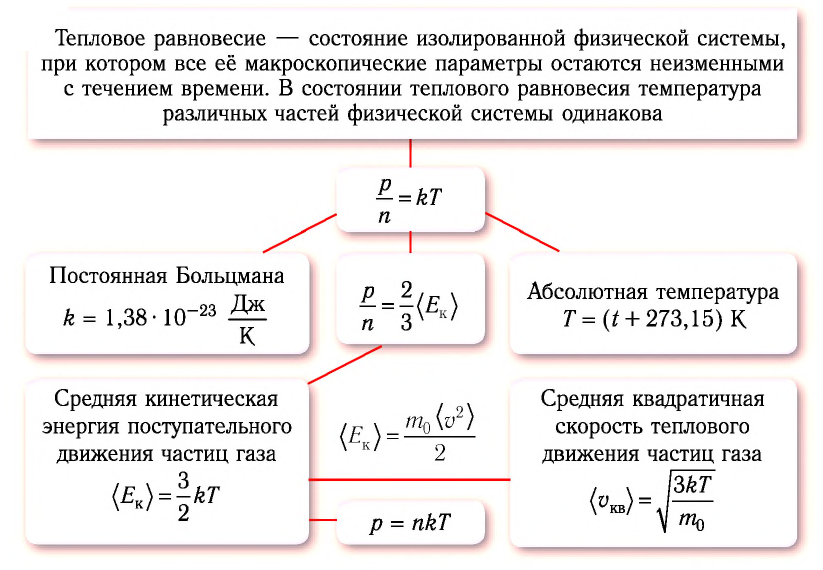
Тепловое равновесие — состояние изолированной физической системы, при котором все её макроскопические параметры остаются неизменными с течением времени.
Под изолированной, или замкнутой, системой понимают систему тел, которая не обменивается энергией с окружающими телами.
Отметим, что у тел, входящих в физическую систему, находящуюся в состоянии теплового равновесия, могут быть различные значения плотности, концентрации, давления и объёма. Однако температура всех тел, входящих в такую систему, всегда одинакова.
Интересно знать:
Понятия «градус» и «температура» появились задолго до изобретения термометра. Знаменитый древнеримский врач Гален (II в.) считал, что все лекарства следует различать по «градусам» (от лат. gradus — ступень) теплоты, холода, сухости и влажности. Гален учил, что одни лекарства оказывают охлаждающее действие, а другие — согревающее. При необходимости следовало смешивать лекарства, чтобы умерить излишнее тепло влажностью, а холод — сухостью. От латинского слова temperature (смешение) возник термин «температура».
Температура и средняя кинетическая энергия поступательного движения молекул газа
Определение температуры должно основываться на такой физической величине, которая характеризует состояние тел и является одинаковой для любых тел, находящихся в состоянии теплового равновесия. Необходимым свойством обладает средняя кинетическая энергия теплового движения частиц вещества. Тепловое движение частиц вещества существенно изменяется при изменении его агрегатного состояния. Максимально простым оно оказывается у одноатомного газа, атомы которого совершают только поступательное движение.
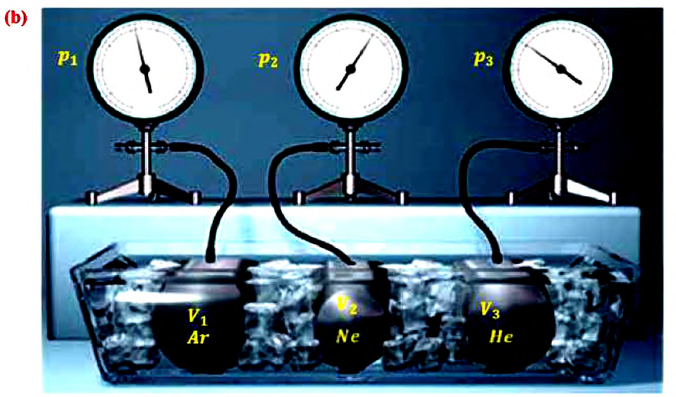
Возьмём несколько сосудов разной вместимости, снабжённых манометрами для измерения давления (рис. 16). Заполнив их различными газами, например аргоном, неоном и гелием, поместим сначала в сосуд с тающим льдом (
Опытным путём установлено, что в состоянии теплового равновесия, несмотря на различные значения давления 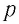
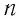
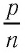
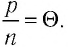
Здесь 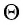
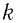
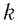
Если для измерения температуры использовать абсолютную температурную шкалу, то при определении числового значения температуры по этой шкале полагают:
Абсолютную (термодинамическую) шкалу температур предложил в 1848 г. выдающийся английский физик Уильям Томсон (1824—1907), удостоенный за работы в области физики в 1892 г. титула лорда Кельвина. Поэтому эту шкалу обычно называют шкалой Кельвина.
Шкала Кельвина совершенно не зависит от физических свойств каких бы то ни было веществ, поэтому её можно считать абсолютной и универсальной.
Нулевая точка по шкале Кельвина соответствует самой низкой теоретически возможной температуре (абсолютный нуль температуры). Температура тающего льда по этой шкале 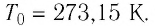
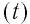
* Единица измерения температуры джоуль неудобна. Например, температура кипения воды, выраженная в джоулях: 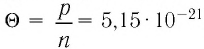
Единица температуры по абсолютной шкале один кельвин (1 К) является основной единицей температуры в СИ и совпадает с одним градусом (1 °С) по шкале Цельсия. Поэтому разность температур по шкале Кельвина и по шкале Цельсия одинакова, т. е. 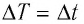
От теории к практике:
Выразите по шкале Кельвина температуру тела здорового человека.
Из основного уравнения молекулярно-кинетической теории идеального газа (3.2) следует: 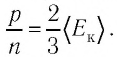
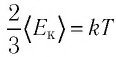
Соотношение (4.2) устанавливает связь между абсолютной температурой Т идеального газа и средней кинетической энергией 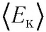
Средняя кинетическая энергия поступательного движения молекул газов, находящихся в состоянии теплового равновесия, одинакова для разных газов и не зависит от массы молекулы газа.
Этот вывод, основанный на экспериментах с разреженными газами, справедлив для жидкостей и твёрдых тел.
Уравнение (4.2) можно записать следующим образом: 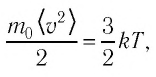
С учётом формулы (4.1) основное уравнение молекулярно-кинетической теории идеального газа может быть записано в виде:
Из уравнения (4.3) следует, что при одинаковых значениях абсолютной температуры Т и концентрации 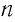
Сравните средние квадратичные скорости атомов гелия и молекул кислорода, если газы находятся в состоянии теплового равновесия.
Решение. Средняя квадратичная скорость теплового движения частиц газа 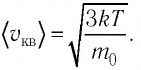
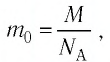
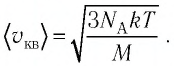
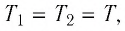
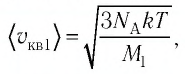
молекул кислорода 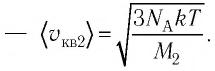
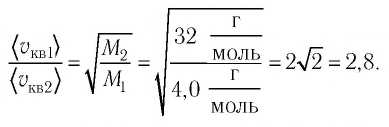
Тогда:
Ответ: в состоянии теплового равновесия средняя квадратичная скорость атомов гелия в 2,8 раза больше средней квадратичной скорости молекул кислорода.
В баллоне вместимостью 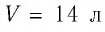
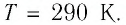
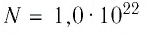
Решение. Начальное давление газа
После того как израсходовали часть газа, а его температура увеличилась до первоначального значения Т, давление газа стало
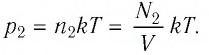
Тогда убыль давления газа:
Ответ:
Тепловое равновесие, температура
Понятие температуры занимает важное место в повседневной жизни. Так, говоря температура, мы обычно подразумеваем степень нагретости (горячее, теплое, холодное) тела. Такое рассмотрение в достаточной степени субъективно, потому что температура зависит не только от состояния рассматриваемого тела, но и от нашей чувствительности.
Тепловое равновесие:
Известно, что при соприкосновении двух тел с разными температурами между ними происходит теплообмен: тепло переходит от тела с высокой температурой к телу с более низкой температурой. Этот процесс продолжается до тех пор, пока температуры обоих тел не сравняются. Этот факт учитывается при измерении температуры тел — термометр приводится в соприкосновение с телом, но его показания снимаются не сразу, а через определенный промежуток времени, в течение которого между телом и термометром устанавливается тепловое, или так называемое термодинамическое равновесие. При термодинамическом равновесии макроскопические параметры системы остаются постоянными, то есть изменение агрегатного состояния вещества не происходит.
Состояние теплового равновесия системы характеризуется температурой.
Качественное и количественное определение температуры должно основываться на определении физической величины, которая, во-первых, должна характеризовать состояние тела, во-вторых, должна быть одинакова для всех тел, находящихся в тепловом равновесии. Такой величиной является средняя кинетическая энергия поступательного движения молекул вещества. Можно легко определить ее значения для поступательно движущихся молекул одноатомного идеального газа.
С этой целью был поставлен следующий интересный эксперимент: три баллона разного объема, снабженные манометрами (прибор для измерения давления), заполнены различными газами, например, аргоном, неоном и гелием. Баллоны помещаются сначала в тающий лед 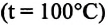
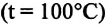
Произведенные вычисления показывают, что в обоих случаях (и при температуре 0°С, и при температуре 100°С) при достижении теплового равновесия, отношение 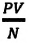
при
при
Если принять во внимание, что 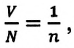
Здесь 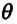
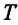
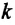
Постоянная Больцмана связывает температуру 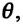
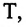
Выражение (6.9) может быть использовано для определения абсолютной температуры в Кельвинах:
Формула (6.10) дает возможность создания новой температурной шкалы. Такая температурная шкала, называемая шкалой абсолютных температур, была предложена в 1848 году английским физиком Уильямом Томсоном (1824-1907). За вклад в области физики в 1892 году он был награжден титулом лорда Кельвина.
Поэтому предложенная им шкала температур называется шкалой Кельвина. Нулевая точка шкалы Кельвина, то есть температура абсолютного нуля, это самая низкая температура, какая возможна теоретически и практически. Согласно этой шкале температура плавления льда равна 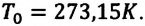
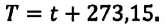
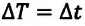
• Средняя кинетическая энергия поступательного движения молекул газа прямо пропорциональна его абсолютной температуре:
Из формулы (6.12) ясно виден физический смысл температуры:
Средняя квадратичная скорость молекул
Из формул (6.1), (6.3) и (6.5) можно вычислить среднюю квадратичную скорость молекул:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Все формулы
Все формулы по физике и математике
Темы по физике
Темы по математике
Тепловое равновесие
Сообщение от администратора:
В приложении можно учить слова, тренировать аудирование и произношение.
Попробуйте. Два урока бесплатно по моей ссылке!
Жмите СЮДА
Тепловое равновесие — состояние системы, при котором остаются неизменными по времени величины этой системы, такие как температура, давление, объем и энтропия в условиях изолированности от окружающей среды.
Состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды, называется тепловым равновесием. В таком состоянии параметры нашей системы не изменяются со временем, то есть, объем и давление не меняются, а так же не происходит теплообмена с окружающей средой. Отсутствуют превращения газов, жидкостей и твердых тел. В состоянии теплового равновесия объем, давление могут быть различными (НО ПОСТОЯННЫМИ) в разных частях термодинамической системы, и только температура во всех частях терм. системы, находящейся в состоянии теплового равновесия, является одинаковой. Микроскопические процессы внутри тела не прекращаются и при тепловом равновесии: меняются положения молекул и их скорости при столкновениях между собой.
Температура характеризует степень нагретости тела. Она является макроскопическим параметром, характеризующим тепловое равновесие систем тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру, а другие макроскопические параметры (р, V, т) могут быть различны.
Зная температуру, мы может очень легко посчитать среднюю кинетическую Энергию:
Для одноатомных молекул:
Для двухатомной молекул :
Для линейного трехатомного газа СО2 :
Для нелинейного трехатомного газа H2O :
Из выше сказанного, можно сделать вывод : Если две системы, находящиеся в тепловом равновесии с третьей системой, то они находятся в тепловом равновесии друг с другом.
В Формуле мы использовали :
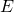

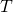
Тепловое равновесие
Тепловое равновесие (или термодинамическое равновесие) – это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными.
В состоянии термодинамического равновесия не происходит теплообмен с окружающими телами, не изменяются объём и давление тела, отсутствуют взаимные превращения жидкостей, газов и твёрдых тел.
Температура и её физический смысл
Любая термодинамическая система при неизменных внешних условиях самопроизвольно переходит в состояние термодинамического равновесия.
Температура тела – это физический параметр, одинаковый во всех частях системы тел, которая находится в состоянии термодинамического равновесия.
При тепловом равновесии микроскопические процессы внутри тела (движение частиц и взаимодействие частиц) не прекращаются. Термодинамическая система может находиться в различных состояниях теплового равновесия, каждому из которых соответствует определённое значение температуры. При теплообмене между телами происходит обмен энергией: тела с большей энергией передают свою энергию телам с меньшей энергией. Направление теплообмена между ними указывает разность температур тел. То есть энергия передаётся от более горячего тела к менее горячему.
Температура и её измерение
Для измерения температуры используется тот факт, что с изменением температуры тела изменяются почти все его физические свойства: длина, объём, плотность, электрическое сопротивление, упругие свойства и др. Основой для измерения температуры может являться изменение какого-либо свойства термометрического тела.
Термометрическое тело – это тело, для которого известна зависимость какого-либо свойства данного тела от температуры. Термометрическим телом может быть, например, жидкость или газ, для которого известна зависимость изменения его объёма от температуры.
Эмпирическая шкала – это температурная шкала, установленная с помощью термометрического тела.
Наиболее распространён способ измерения температуры с помощью жидкостного термометра, в котором используется расширение жидкости (изменение объёма) при нагревании.
При градуировке термометра отмечают опорные точки, расстояние между которыми на шкале делят на равные части, которые называются градусами.
Шкала температур Цельсия
Для практического употребления по решению IX Генеральной конференции по мерам и весам в 1948 году была принята международная стоградусная температурная шкала – шкала Цельсия.
Шведский физик и астроном Андерс Цельсий (1701 – 1744) в 1742 году предложил шкалу термометра, в которой за ноль градусов (начало отсчёта температуры) принял температуру таяния льда, а за сто градусов – температуру кипения воды при нормальном атмосферном давлении в 1,01325 * 10 5 Па. Изменение длины столба жидкости в термометре на одну сотую долю длины между отметками 0 и 100 °С соответствует изменению температуры на 1 °С. По данной шкале единица измерения температуры – градус Цельсия.
Однако, несмотря на указанную выше конференцию, в некоторых странах (например, в США) до сих пор активно используется другая шкала – шкала Фаренгейта. На шкале Фаренгейта точка таяния льда равна +32 °F, а точка кипения воды равна +212 °F. При этом один градус Фаренгейта равен 1/180 разности этих температур.
Перевести градусы из Цельсия в Фаренгейт можно так:
Перевод из Фаренгейта в Цельсий:
Здесь tF – температура по Фаренгейту, tC – температура по Цельсию
Перевести градусы по Цельсию в градусы по Фаренгейту и обратно вы можете ниже.