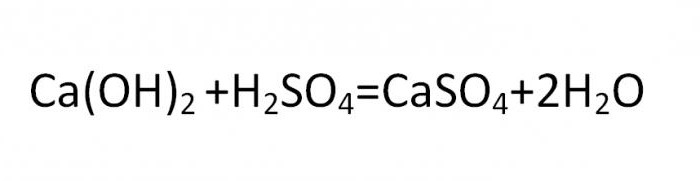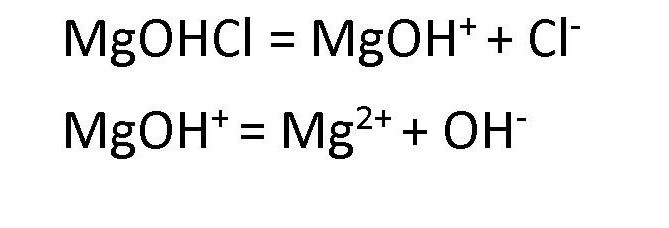Что называется солью в химии
Что называется солью в химии
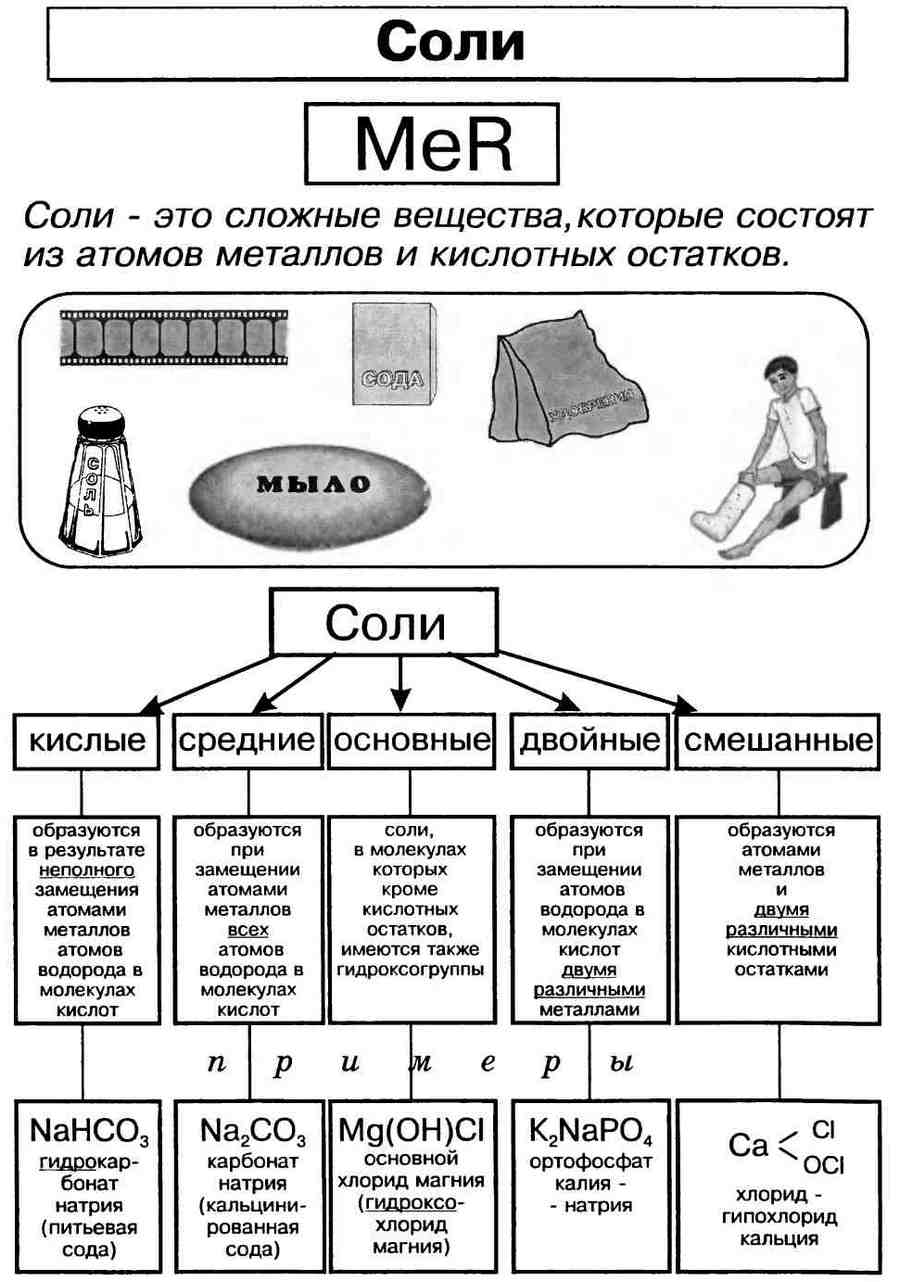
Соли – это класс химических соединений, состоящие из ионов металлов и ионов кислотных остатков.
В начале XIX века шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.

Средние, или нормальные, соли – это продукты полного замещения атомов водорода в кислоте на металл. Например: Na2SO4, K3PO4,CaCO3 и т.д.
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл. Например: Ca(HCO3)2, Mg(HSO4)2 и т.д.
Оснoвные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например: (СuOH)2CO3, AlOHCl2 и т.д.
Нормальные, кислые и основные соли являются наиболее важными типами солей. Кратко рассмотрим другие типы солей.
Смешанными солями называют такие соли, молекулы которых состоят из катионов одного металла и анионов двух различных кислотных остатков. Например: PbFCl – фторид-хлорид свинца, Ca(ClO)Cl – хлорид-гипохлорит кальция.
Двойными солями называются такие соли, в состав молекул которых входят катионы двух различных металлов (или катион металла и катион аммония) и анионы одного кислотного остатка.
Двойные соли являются продуктами совмествной кристаллизации двух разных нормальных солей, образованных одной и той же кислотой; например, сульфата калия K2SO4 и сульфата алюминия Al2(SO4)3. Поэтому их формулы записывают так:
Большинство солей — твердые вещества белого цвета: KCl, NaCl, KNO3, BaSO4 и т.д.
Некоторые соли имеют окраску. Например, дихромат калия K2Cr2O7 – оранжевого, хромат калия K2CrO4 – желтого, сульфат никеля (II) NiSO4 – зеленого, хлорид кобальта (III) CoCl3 – розового, сульфид меди (II) CuS – черного цвета.
По растворимости в воде соли делятся на растворимые (р), малорастворимые (м) и нерастворимые (н).
Растворимость в воде важнейших солей указана в данной таблице.
Химические свойства солей
а) средние соли диссоциируют на катионы металлов и анионы кислотных остатков:
б) кислые соли диссоциируют на катионы металла и сложные анионы:
в) основные соли диссоциируют на сложные катионы и анионы кислотных остатков:
Металл + соль = новый металл + новая соль
Раствор соли + раствор щелочи = новая соль + новое основание
Соль + кислота = новая соль + новая кислота
При взаимодействии соли с кислотой, образующей данную соль, получается кислая соль (это возможно в том случае, если соль образована многоосновной кислотой). Например:
Соль 1 + соль 2 = соль 3 + соль 4
Основная соль + кислота = средняя соль + вода
Кислая соль + щелочь = средняя соль + вода
Получение солей
NaOH + HCl = NaCl + H2O
Водород выделяется при взаимодействии металлов со всеми кислотами, кроме азотной кислоты и концентрированной серной кислоты.
Кроме этих общих способов получения солей возможны и некоторые частные способы:
С водными растворами щелочей реакция идет по уравнению:
Соль + кислотный оксид = соль + кислотный оксид
Cl2 + 2KOH = KCl + KClO + H2O (на холоде)
3Сl2 + 6KOH = 5KCl + KClO3 + 2H2O (при нагревании)
Соль + галоген 1 = новая соль + галоген 2(при условии, что галоген 1 более активный, чем галоген 2).

Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Что называется солью в химии
ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ
И ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка. Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
При обычных условиях все соли – твёрдые вещества. Многие соли не имеют цвета, но некоторые ионы придают солям характерную окраску:
Растворимость солей различна. Практически все нитраты, соли натрия, калия, рубидия, цезия и аммония NH4 + растворимы. Среди сульфидов и фосфатов растворимы только фосфаты и сульфиды щелочных металлов.
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ
В этом примере ионы меди Cu 2+ являются окислителем, а цинк – восстановителем.
Активность металла определяется его положением в электрохимическом ряду напряжений металлов:
Li, Cs, К, Ва, Са, Na, Mg, Al, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Ag, Pt, Au.
Щелочные (Li, Na, K, Rb, Cs) и щёлочноземельные металлы (Ca, Sr, Ва) реагируют с растворами солей иначе. Сначала щелочной или щёлочноземельный металл реагирует с водой раствора соли:
2Na + 2H2O = 2NaOH + H2↑
Образовавшаяся щёлочь реагирует с раствором соли:
Так как в ходе первой реакции выделяется достаточное количество тепла, гидроксид меди (II) разлагается (свойство нерастворимых гидроксидов):
Cu(OH)2 = CuO + H2O
Поэтому вместо меди в такой реакции образуется смесь её оксида и гидроксида.
Разложение нитратов при нагревании рассмотрено в конспекте «Нитраты».
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
MgO + H2SO4 = MgSO4 + H2O
MgO + SO3 = MgSO4
а) по реакции замещения:
б) по реакции обмена (см. взаимодействие солей друг с другом):
MgI2 + HgSO4 = MgSO4 + HgI2↓
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
2NaOH + H3РO4 = Na2HPO4 + 2H2O
(в результате неполной нейтрализации образовался гидрофосфат натрия);
NaOH + H3РO4 = NaH2PO4 + H2O
(в результате неполной нейтрализации образуется дигидрофосфат натрия).
4NaOH + Р2O5 = 2Na2HPO4 + H2O
(в результате неполной нейтрализации образовался дигидрофосфат натрия);
2NaOH + Р2O5 + H2O = 2NaH2PO4
(в результате неполной нейтрализации образовался гидрофосфат натрия).
Na2SO4 + H2SO4 = 2NaHSO4
NaCl (тв.) + H2SO4 (конц.) = NaHSO4 + HCl↑
СаСO3 + СO2 + H2O = Са(НСО3)2
(в данном примере взвесь СаСO3 постепенно исчезает, так как образуется хорошо растворимый гидрокарбонат кальция).
Кислые соли, как правило, растворимы лучше соответствующих им средних. Так, например, гидрокарбонат кальция Са(НСО3)2 растворим в воде, в то время как карбонат кальция практически нерастворим.
Образец выполнения задания ОГЭ
Задание. И сульфат меди (II), и нитрат серебра взаимодействуют
Решение. Хлорид калия, сульфат меди (II), нитрат серебра – соли. Растворимые соли взаимодействуют друг с другом, если в результате реакции один из продуктов реакции выпадает в осадок (т. е. образуется малорастворимое в воде вещество). В случае взаимодействия нитрата серебра с хлоридом калия действительно образуется осадок (белый творожистый осадок хлорида серебра):
Но сульфат меди (II) с хлоридом калия не взаимодействует, в данном случае связывания ионов в растворе не происходит. Таким образом, вариант 1 не подходит.
Соляная кислота – сильный электролит. Сильные кислоты взаимодействуют с солями слабых кислот, вытесняя их из солей. Но сульфат меди (II) – соль сильной серной кислоты, а нитрат серебра – соль сильной азотной кислоты. Серная кислота может вытеснить азотную и соляную кислоты из кристаллических солей (не в растворах), так как HNO3 и НCl – летучие кислоты, а серная – нелетучая. Соляная кислота вытеснить серную или азотную не может. Поэтому вариант 2 не подходит.
С оксидами соли взаимодействуют в редких случаях. Например, карбонаты при сплавлении взаимодействуют с оксидом кремния (IV). Средние соли при взаимодействии в растворе с кислотными оксидами соответствующих кислот превращаются в кислые соли (если такие для данных кислот существуют). В данном примере оксид магния не взаимодействует ни с сульфатом меди (II), ни с нитратом серебра. Ответ 3 не подходит.
Обе соли взаимодействуют с железом. Железо находится в электрохимическом ряду напряжений металлов до меди и до серебра:
Правильный ответ – 4 (с железом).
Конспект урока по химии в 8 классе «Соли: классификация, свойства, получение». Выберите дальнейшее действие:
Что называется солью в химии
Соли – сложные вещества, которые являются продуктом полного или неполного замещения атомов водорода кислоты на атомы металла, или замещения гидроксогрупп основания кислотным остатком.
В зависимости от состава соли делятся на средние (Na2SO4, K3PO4), кислые (NaHCO3, MgHPO4), основные (FeOHCl2, Al(OH)2Cl, (CaOH)2CO3, двойные (KAl(SO4)2), комплексные (Ag[(NH3)2]Cl, K4[Fe(CN)6]).
Средними солями называются соли, которые являются продуктом полного замещения атомов водорода соответствующей кислоты на атомы металла или ион NH4+. Например:
H2CO3 ® (NH4)2CO3; H3PO4 ® Na3PO4
Название средней соли образуется из названия аниона, за которым следует название катиона. Для солей бескислородных кислот наименование соли составляется из латинского названия неметалла с добавлением суффикса –ид, например, NaCl – хлорид натрия. Если неметалл проявляет переменную степень окисления, то после его названия в скобках римскими цифрами указывается степень окисления металла: FeS – сульфид железа (II), Fe2S3 – сульфид железа (III).
Для солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание –ат для высших степеней окисления, -ит для более низких. Например,
K2SiO3 – силикат калия, KNO2 – нитрит калия,
KNO3 – нитрат калия, K3PO4 – фосфат калия,
Fe2(SO4)3 – сульфат железа (III), Na2SO3 – сульфит натрия.
Для солей некоторых кислот используется приставка –гипо для более низких степеней окисления и –пер для высоких степеней окисления. Например,
KClO – гипохлорит калия, KClO2 – хлорит калия,
KClO3 – хлорат калия, KClO4 – перхлорат калия.
Способы получения средних солей:
— взаимодействием металлов с неметаллами, кислотами и солями:
Zn + 2HCl = ZnCl2 + H2
Fe + CuSO4 = FeSO4 + Cu
основных с кислотами BaO + 2HNO3 = Ba(NO3)2 + H2O
кислотных со щелочами 2NaOH + SiO2 = Na2SiO3 + H2O
основных оксидов с кислотными Na2O + CO2 = Na2CO3
— взаимодействием кислот с основаниями и с амфотерными гидроксидами:
KOH + HCl = KCl + H2O
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
— взаимодействием солей с кислотами, со щелочами и солями:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
FeCl3 + 3KOH = 3KCl + Fe(OH)3¯
Na2SO4 + BaCl2 = BaSO4¯ + 2NaCl
Химические свойства средних солей:
— взаимодействие с металлами
Zn + Hg(NO3)2 = Zn(NO3)2 + Hg
— взаимодействие с кислотами
AgNO3 + HCl = AgCl¯ + HNO3
— взаимодействие со щелочами
CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4
— взаимодействие с солями
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот на атомы металла.
Например: H2CO3 ® NaHCO3
H3PO4 ® NaH2PO4 ® Na2HPO4
При наименовании кислой соли к названию соответствующей средней соли добавляется приставка гидро-, которая указывает на наличие атомов водорода в кислотном остатке.
Например, NaHS – гидросульфид натрия, Na2HPO4 – гидрофосфат натрия, NaH2PO4 – дигидрофосфат натрия.
Кислые соли могут быть получены:
— действием избытка многоосновных кислот на основные оксиды, щелочи и средние соли:
K2O + 2H2S = 2KHS + H2O
NaOH + H2SO4 = NaHSO4 + H2O
K2SO4 + H2SO4 = 2KHSO4
— действием избытка кислотных оксидов на щелочи
Химические свойства кислых солей:
— взаимодействие с избытком щелочи
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
— взаимодействие с кислотами
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Основные соли – это продукты неполного замещения гидроксогруппы в молекулах многокислотных оснований на кислотные остатки.
Fe(OH)3 ®Fe(OH)2Cl ® FeOHCl2
При наименовании основной соли к названию соответствующей средней соли добавляется приставка гидроксо-, которая указывает на наличие гидроксогруппы. Например CrOHCl2 – гидроксохлорид хрома (III), Cr(OH)2Cl – дигидроксохлорид хрома (III).
Основные соли могут быть получены:
— неполной нейтрализации оснований кислотами
Mg(OH)2 + HCl = MgOHCl + H2O
— добавлением небольших количеств щелочей к средним солям
Соли: виды, свойства и применение
Соли — органические и неорганические химические вещества сложного состава. 
— состоящие из анионов и катионов;
— получаемые в результате взаимодействия кислот и оснований;
— состоящие из кислотных остатков и ионов металлов.
Кислотные остатки могут быть связаны не с атомами металлов, а с ионами аммония (NH4)+, фосфония (РН4)+, гидроксония (Н3О)+ и некоторыми другими.
Виды солей
— Кислотные, средние, оснóвные. Если в кислоте все протоны водорода заменены ионами металла, то такие соли называют средними, например, NaCl. Если водород замещен лишь частично, то такие соли — кислые, напр. KHSO4 и NaH2PO4. Если гидроксильные группы (OH)– основания замещены кислотным остатком не полностью, то тогда соль — оснóвная, напр. CuCl(OH), Аl(OH)SO4.

— Органические и неорганические.
— Комплексные соли с комплексным ионом: K2[BeF4], [Zn(NH3)4]Cl2 и другие.
— Кристаллогидраты и кристаллосольваты.
— Кристаллогидраты с молекулами кристаллизационной воды. CaSO4*2H2O.
— Кристаллосольваты с молекулами растворителя. Например, LiCl в жидком аммиаке NH3 дает сольват LiCl*5NH3.
— Кислородосодержащие и не содержащие кислород.
— Внутренние, иначе называемые биполярными ионами.
Свойства
Большинство солей — твердые вещества с высокой температурой плавления, не проводящие ток. Растворимость в воде — важная характеристика, на ее основании реактивы делят на водорастворимые, малорастворимые и не растворимые. Многие соли растворяются в органических растворителях.
Соли реагируют:
— с более активными металлами;
— с кислотами, основаниями, другими солями, если в ходе взаимодействия получаются вещества, в дальнейшей реакции не участвующие, например, газ, нерастворимый осадок, вода. Разлагаются при нагревании, гидролизируются в воде.
В природе соли широко распространены в виде минералов, рассолов, залежей солей. Их добывают также из морской воды, горных руд.
Соли необходимы человеческому организму. Соли железа нужны для пополнения гемоглобина, кальция — участвуют в образовании скелета, магния — регулируют деятельность желудочно-кишечного тракта.
Применение солей
Соли активно используются в производстве, быту, сельском хозяйстве, медицине, пищепроме, химическом синтезе и анализе, в лабораторной практике. Вот лишь некоторые сферы их применения:
— Нитраты натрия, калия, кальция и аммония (селитры); кальций фосфорнокислый, 
— Хлорид натрия необходим для получения пищевой поваренной соли, применяется в химпроме для производства хлора, соды, едкого натра.
— Гипохлорит натрия — популярный отбеливатель и средство для обеззараживания воды.
— Соли уксусной кислоты (ацетаты) используются в пищевой индустрии как консерванты (калий и кальций уксуснокислый); в медицине для изготовления лекарств, в косметической отрасли (натрий уксуснокислый), для многих других целей.
— Алюмокалиевые и хромокалиевые квасцы востребованы в медицине, пищепроме; для окрашивания тканей, кож, мехов.
— Многие соли используются в качестве фиксаналов для определения химического состава веществ, качества воды, уровня кислотности и пр.
В нашем магазине в широком ассортименте представлены соли, как органические так и неорганические.
Что такое соль? Формула, свойства соли (химия)
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.
Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
Me n m Кислотный остаток m n.
Физические свойства соли
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200 о С.
По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.
Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Свойства солей в электролитах
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.
Растворы основных солей
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.