Что называется химическим элементом
Химический элемент
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные) [3]
Содержание
История становления понятия
Слово «элемент» (лат. elementum ) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»). [4]
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает на атомный вес как важнейшее свойство элементов, определяющее его химическую природу. Благодаря усилиям Йенса Берцелиуса и его последователей были весьма точно определены атомные веса (атомные массы) известных элементов. Середина XIX в. ознаменовалась целым рядом открытий новых элементов. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Ko времени открытия Периодического закона Д. И. Менделеевым (1869) было известно 63 элемента. Именно атомный вес был выделен им как свойство атомов, определяющее периодический характер изменения свойств химических элементов, а также образуемых ими простых и сложных веществ. Менделеев определял химические элементы как «материальные части простых или сложных тел, к-рые придают им известную совокупность физических и химических свойств». Oткрытие Mенделеева позволило предвидеть существование, a также свойства ряда неизвестных в то время элементов и послужило научной основой для их классификации.
Однако с открытием изотопов стало ясно, что различные совокупности атомов одного и того же элемента могут иметь различающиеся атомные массы; так, радиогенный гелий, выделенный из урановых минералов, в связи с преобладанием изотопа 4 He имеет атомную массу больше, чем гелий космических лучей.
Известные химические элементы
Право предложить название новому химическому элементу предоставляется первооткрывателям. Сообщение о новом открытии проверяется в течение нескольких лет независимыми лабораториями, и, в случае подтверждения, Международный союз теоретической и прикладной химии (ИЮПАК, IUPAC, en:International Union for Pure and Applied Chemistry) официально утверждает название нового элемента.
Не все из известных на сегодня 118 элементов имеют утвержденные ИЮПАК постоянные названия. Самым тяжёлым из официально признанных элементов, имеющих официальные постоянные названия, является 116-й, получивший в мае 2012 года имя ливерморий вместе со 114-м элементом флеровием.
Названия сверхтяжёлых элементов с номерами 113, 115, 117, 118, полученные в 2002—2010 годах в России и США, официально пока не утверждены. Они имеют временные систематические названия.
Символы химических элементов
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1811 г. шведским химиком Я. Берцелиусом.
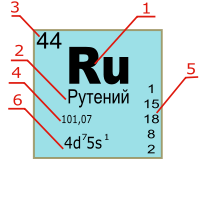
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле [7] :
| атомная масса | заряд иона |
| Символ элемента | |
|---|---|
| порядковый номер | число атомов в молекуле |
Временные символы элементов состоят из трёх букв, представляющих аббревиатуру их атомного номера на латыни.
В Периодической таблице карточка химического элемента обычно включает следующие характеристики:
Распространённость химических элементов в природе
Из всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 %. В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Массовое содержание элемента в земной коре называется кларковым числом или кларком элемента.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсоставы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
Классификация химических элементов
Химические элементы как составная часть химических веществ
Химические вещества могут состоять как из одного химического элемента (простое вещество), так и из разных (сложное вещество или химическое соединение).
В обычных условиях 11 элементов существуют в виде газообразных простых веществ (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2 — жидкости (Br и Hg), остальные элементы образуют твёрдые тела.
См. также
Ссылки
Примечания
 | Химический портал — мир химии, веществ и превращений на страницах Википедии. |
Полезное
Смотреть что такое «Химический элемент» в других словарях:
химический элемент — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN chemical element A substance made up of atoms with the same atomic number; common examples are hydrogen, gold, and iron. (Source: MGH)… … Справочник технического переводчика
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — совокупность атомов, имеющих одинаковый заряд ядра и, следовательно, одинаковое число электронов в электронной оболочке. Многие из них имеют несколько (см.). Хим. элементы обозначают знаками химическими (см. (9)), а их закономерную взаимосвязь… … Большая политехническая энциклопедия
химический элемент — совокупность атомов с одинаковым зарядом ядра Z (одинаковым порядковым, или атомным, номером в периодической системе химических элементов). В таблицу химических элементов, издаваемую ИЮПАК, на 1998 внесено 109 элементов, имеющих названия (имеются … Энциклопедический словарь
химический элемент — ▲ атом ↑ с, определенный, заряд, атомное ядро элемент, химический элемент вид атомов, обладающих одинаковым зарядом ядра (железо #). атомный [порядковый] номер равен числу протонов в атомном ядре. атомный вес. ▼ водород, гидроген. кислород,… … Идеографический словарь русского языка
химический элемент — cheminis elementas statusas T sritis chemija apibrėžtis Atomų rūšis, turinti vienodą branduolio krūvį. atitikmenys: angl. chemical element; element rus. химический элемент; элемент ryšiai: sinonimas – elementas … Chemijos terminų aiškinamasis žodynas
химический элемент — cheminis elementas statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų rūšis, turinti vienodą branduolio krūvį. atitikmenys: angl. chemical element vok. chemisches Element, n rus. химический элемент, m pranc. élément chimique, m … Penkiakalbis aiškinamasis metrologijos terminų žodynas
химический элемент — cheminis elementas statusas T sritis chemija apibrėžtis Elektrocheminio elemento tipas. atitikmenys: angl. chemical element rus. химический элемент … Chemijos terminų aiškinamasis žodynas
химический элемент — cheminis elementas statusas T sritis fizika atitikmenys: angl. chemical element vok. chemisches Element, n rus. химический элемент, m pranc. élément chimique, m … Fizikos terminų žodynas
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — вид атомов, обладающих одинаковым зарядом ядра. X. э. в свободном состоянии являются простыми (не разложимыми хим. методами на более простые) в вами. Мн. X. э. состоят из неск. изотопов. Взаимосвязь X. э. отражает периодическая система элементов… … Большой энциклопедический политехнический словарь
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — совокупность атомов с одинаковым зарядом ядра Z (одинаковым порядковым, или атомным, номером в периодической системе химических элементов). В таблицу X. э., издаваемую ИЮПАК, на 1998 внесено 109 элементов, имеющих названия (есть сведения о… … Естествознание. Энциклопедический словарь
Урок 1. Атомы и химические элементы
В уроке 1 «Атомы и химические элементы» из курса «Химия для чайников» рассмотрим, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выясним, что из себя представляет химический элемент и каким образом обозначается.
Все, что нас окружает, мы сами, Земля, на которой мы живем, состоит из самых разнообразных веществ. А из чего состоят сами вещества? Ведь их можно дробить на более мелкие части, а те, в свою очередь, на еще более мелкие. Где предел такого деления? Что представляют собой частицы, которые дальше уже нельзя раздробить обычными способами? Над этими вопросами задумывались ученые еще в глубокой древности.
Атомное строение веществ
Первые представления об атомах как мельчайших, далее неделимых частицах веществ появились у философов Древней Греции еще за 400 лет до н. э. Они считали, что каждое вещество составлено из присущих только ему атомов, т. е. существуют атомы, например, мяса, песка, дерева, воды и т. д. Другими словами, сколько есть веществ, столько и видов атомов.
Доказательств существования атомов в то время, конечно, не было, и это учение было забыто почти на две тысячи лет. И только в самом начале XIX в. идея атомного строения веществ была возрождена английским ученым Дж. Дальтоном.
Согласно его теории все вещества состоят из очень маленьких частиц — атомов. В процессе химических превращений атомы не разрушаются и не возникают вновь, а только переходят из одних веществ в другие. Они являются как бы деталями конструктора, из которых можно собирать всевозможные изделия.
Атомы — мельчайшие, химически неделимые частицы.
Химические элементы
Общее число атомов во Вселенной невообразимо велико. Однако видов атомов сравнительно немного. Каждый такой определенный вид атомов называется химическим элементом.
Химический элемент — определенный вид атомов.
Позже, после изучения строения атома, вы узнаете более точное определение этого понятия.
Всего в настоящее время известно 118 химических элементов. Атомы одного и того же элемента имеют одинаковые размеры, практически одинаковое строение и массу. Атомы разных элементов различаются между собой, прежде всего, строением, размерами, массой и целым рядом других характеристик.
На заметку: Из 118 химических элементов в природе встречается только 92, а остальные 26 получены искусственно с помощью специальных физических методов.
Из атомов такого небольшого числа химических элементов построены все вещества, существующие в природе и полученные химиками в лабораториях. А это более 60 млн веществ. Все они представляют собой самые различные сочетания атомов тех или иных элементов. Так же, как из 33 букв алфавита составлены все слова русского языка, из атомов относительно небольшого числа элементов состоят все известные вещества.
Символы химических элементов
Каждый элемент имеет свое название и условное обозначение — химический символ (знак).
Химический символ (знак) — условное обозначение химического элемента с помощью букв его латинского названия.
Символы химических элементов состоят из одной или двух букв их латинских названий. Понятно, что вторая буква нужна, чтобы различать элементы, в названиях которых первая буква одинакова. Например, элемент углерод обозначается первой буквой С его латинского названия — Carboneum (карбонеум), а элемент медь — двумя первыми буквами Cu его латинского названия — Cuprum (купрум).
Современные символы и названия наиболее распространенных элементов, необходимые вам на начальном этапе изучения химии, приведены в таблице под спойлером.
| Название химического элемента | Химический знак элемента | Относительная атомная масса (округленная) |
| Азот | N | 14 |
| Алюминий | Al | 27 |
| Водород | H | 1 |
| Железо | Fe | 56 |
| Золото | Au | 197 |
| Калий | K | 39 |
| Кальций | Ca | 40 |
| Кислород | O | 16 |
| Кремний | Si | 28 |
| Магний | Mg | 24 |
| Медь | Cu | 64 |
| Натрий | Na | 23 |
| Ртуть | Hg | 201 |
| Свинец | Pb | 207 |
| Сера | S | 32 |
| Серебро | Ag | 108 |
| Углерод | C | 12 |
| Фосфор | P | 31 |
| Хлор | Cl | 35,5 |
| Цинк | Zn | 65 |
Если вы хотите познакомиться с названиями и символами всех химических элементов, загляните сюда. Там представлена периодическая система элементов, о которой вы узнаете позже.
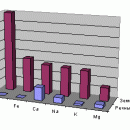
Распространенность химических элементов в природе крайне неравномерна. Самый распространенный элемент в земной коре (слое толщиной 16 км) — кислород О. Его содержание составляет 49,13 % от общего числа атомов всех элементов. Доли остальных элементов показаны на рис. 28.
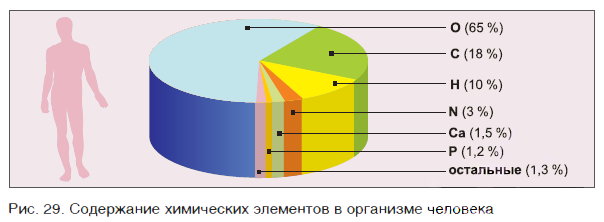
В организме человека на долю атомов кислорода приходится 65 % от массы тела, в то время как доля атомов углерода — 18 %, водорода — 10 %, азота — 3 % (см. рис. 29).
Во всей нашей Галактике почти 92 % от общего числа всех атомов приходится на долю водорода Н, 7,9 % — на долю гелия He и только 0,10 % — на атомы всех остальных элементов. Именно эти два самых легких элемента составляют основу звездной материи.
Краткие выводы урока:
Надеюсь урок 1 «Атомы и химические элементы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Автор текста Анисимова Е.С. Из курса лекций по химии.
Типы атомов. Химические элементы.
Что такое химический элемент.
Теперь обсудим вопрос о количестве протонов в атомах.
В природе есть атомы с одним протоном, с двумя, с тремя и т.д. – примерно до ста протонов. (114).
Атомы с одним протоном в каждом – это одна группа атомов, один тип атомов.
Атомы с двумя протонами в каждом – другая группа атомов, другой тип атомов.
Атомы с одинаковым числом протонов в каждом считаются атомами одного ТИПА.
Атомы с разным числом протонов в каждом считаются атомами разных типов.
Разные типы атомов (атомы разных типов) отличаются числом протонов.
Химический элемент
Ещё раз. Элемент водород – это не один атом водорода,
а все атомы с одним протоном в каждом,
то есть весь элемент, вся группа атомов с одним протоном.
Правильное название атома из группы атомов с одним протоном –
«атом химического элемента «водород»».
Или короче – «атом водорода».
Хотя часто атом водорода называют просто водородом, имея в виду «атом элемента водород».
Но вообще-то это неточное название, а самое главное –
оно может запутать тех, кто не знает разницы между атомом и элементом.
Более того, атомы водорода могут соединяться между собой по два:
такие соединения из двух атомов водорода называют молекулами водорода.
Но часто молекулы водорода называют просто водородом, то есть так же, как элемент. Что может запутывать ещё больше.
Читая про элемент водород, люди могут думать, что речь про молекулу водорода или наоборот.
Поэтому очень важно не путать названия элементов
с точно такими же названиями молекул (подробнее далее) или атомов.
Нужно понимать разницу между атомами и элементами и всегда сообщать слушателям (чтобы не запутать их),
какой водород имеется в виду – элемент, атом или молекула.
Говоря не просто «водород», а «элемент водород», «атом водорода» или «молекула водорода».
Даже если это как бы понятно из контекста.
«Просто водородом» допустимо называть разве что элемент водород –
например, во фразах типа «водород относится к неметаллам».
Но называть атом водорода просто водородом – всё равно что яблоко называть фруктами. Именно – не фруктом, а фруктами.
Также, встречая слово «водород», нужно самим задаться вопросом –
о каком водороде идёт речь – о молекуле, атоме или элементе.
Иначе понимание текста может быть ошибочным.
Теперь увеличим таблицу, добавив элементы и примеры веществ из их атомов.
А ещё – заряд ядра, который всегда равен числу протонов, так как ими и создаётся, а заряд одного протона равен единице.
Таблица «Первые 10 элементов»:
Число протонов
в атоме этого типа Заряд
ядра
атома Номер
элемента Число электронов
в атомах элемента Названия
элементов Символ
элемента
или его атома Вещества
из
атомов
элемента
Один +1 №1 (первый) 1 Элемент
Водород Н Молекула из двух атомов водорода
Н2
Два +2 №2 (второй) 2 Элемент
Гелий Не Атом гелия Не
Три +3 №3 (третий) 3 Элемент
Литий Li Атом лития
Li
Четыре +4 №4 (четвёртый) 4 Элемент
Бериллий Ве Атом
бериллия
Пять +5 №5 (пятый) 5 Элемент
Бор В Атом
бора
Шесть +6 №6 6 Элемент
Углерод С Атом углерода
С
Семь +7 №7 7 Элемент
Азот N Молекула из двух атомов азота
N2
Восемь +8 №8 8 Элемент
кислород O Молекула из двух атомов кислорода
О2
Девять +9 №9 9 Элемент
Фтор F Молекула из двух атомов фтора
F2
Десять +10 №10 10 Элемент
Неон Ne Атомы неона
11 +11 №11 11 Элемент
Натрий Na Атомы
натрия
Сотня химических элементов расставлены в специальной таблице,
которую называют периодической системой химических элементов Менделеева
или просто таблицей Менделеева (ТМ).
О ней см. отдельный файл.
ХИМИЯ
ХИМИЯ, наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей в организме; почему раствор соли проводит электрический ток, а раствор сахара – нет; почему одни химические изменения происходят быстро, а другие – медленно. Главная задача химии – выяснение природы вещества, главный подход к решению этой задачи – разложение вещества на более простые компоненты и синтез новых веществ. Используя этот подход, химики научились воспроизводить множество природных химических субстанций и создавать материалы, не существующие в природе. На химических предприятиях уголь, нефть, руды, вода, кислород воздуха превращаются в моющие средства и красители, пластики и полимеры, лекарства и металлические сплавы, удобрения, гербициды и инсектициды и т.д. Живой организм тоже можно рассматривать как сложнейший химический завод, на котором тысячи веществ вступают в точно отрегулированные химические реакции.
ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ
Элементы
Исследование сложного вещества начинается с попыток разложить его на более простые. Простейшая форма материи, в которой сохраняется определенная совокупность физических и химических свойств, называется химическим элементом. Химические элементы – это частицы вещества, представляющие собой совокупность атомов с одинаковым зарядом ядра. Водород, кислород, хлор, натрий, железо – все это элементы. Элемент нельзя разложить на более простые составляющие обычными методами: с помощью тепла, света, электричества или под действием другого вещества. Для этого нужны колоссальное количество энергии, специальное оборудование (например, ускоритель частиц) или высокие температуры, сравнимые с температурами в недрах Солнца. Из 109 известных элементов в природе существует девяносто два элемента, остальные получены искусственно. Все они систематизированы в периодической таблице элементов, где каждому элементу соответствует свой порядковый номер, называемый атомным номером (см. ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). В табл. 1 перечислены первые 103 элемента в алфавитном порядке. Из этого ограниченного набора элементов и состоят миллионы химических веществ.
| Элемент | Символ | Атомный номер | Атомная масса |
| Азот | N | 7 | 14,0067 |
| Актиний | Ac | 89 | (227) |
| Алюминий | Al | 13 | 26,98154 |
| Америций | Am | 95 | (243) |
| Аргон | Ar | 18 | 39,948 |
| Астат | At | 85 | (210) |
| Барий | Ba | 56 | 137,33 |
| Бериллий | Be | 4 | 9,01218 |
| Берклий | Bk | 97 | (247) |
| Бор | B | 5 | 10,811 |
| Бром | Br | 35 | 79,904 |
| Ванадий | V | 23 | 50,9415 |
| Висмут | Bi | 83 | 208,9804 |
| Водород | H | 1 | 1,0079 |
| Вольфрам | W | 74 | 183,85 |
| Гадолиний | Gd | 64 | 157,25 |
| Галлий | Ga | 31 | 69,723 |
| Гафний | Hf | 72 | 178,49 |
| Гелий | He | 2 | 4,0026 |
| Германий | Ge | 32 | 72,59 |
| Гольмий | Ho | 67 | 164,9304 |
| Диспрозий | Dy | 66 | 162,50 |
| Европий | Eu | 63 | 151,96 |
| Железо | Fe | 26 | 55,847 |
| Золото | Au | 79 | 196,9665 |
| Индий | In | 49 | 114,82 |
| Иод | I | 53 | 126,9045 |
| Иридий | Ir | 77 | 192,22 |
| Иттербий | Yb | 70 | 173,04 |
| Иттрий | Y | 39 | 88,9059 |
| Кадмий | Cd | 48 | 112,41 |
| Калий | K | 19 | 39,0983 |
| Калифорний | Сf | 98 | (251) |
| Кальций | Ca | 20 | 40,078 |
| Кислород | O | 8 | 15,9994 |
| Кобальт | Co | 27 | 58,9332 |
| Кремний | Si | 14 | 28,0855 |
| Криптон | Kr | 36 | 83,80 |
| Ксенон | Xe | 54 | 131,29 |
| Кюрий | Cm | 96 | (247) |
| Лантан | La | 57 | 138,9055 |
| Лоуренсий | Lr | 103 | (260) |
| Литий | Li | 3 | 6,941 |
| Лютеций | Lu | 71 | 174,967 |
| Магний | Mg | 12 | 24,305 |
| Марганец | Mn | 25 | 54,9380 |
| Медь | Cu | 29 | 63,546 |
| Менделевий | Md | 101 | (258) |
| Молибден | Mo | 42 | 95,94 |
| Мышьяк | As | 33 | 74,9216 |
| Натрий | Na | 11 | 22,98977 |
| Неодим | Nd | 60 | 144,24 |
| Неон | Ne | 10 | 20,179 |
| Нептуний | Np | 93 | 237,0482 |
| Никель | Ni | 28 | 58,69 |
| Ниобий | Nb | 41 | 92,9064 |
| Нобелий | No | 102 | (259) |
| Олово | Sn | 50 | 118,710 |
| Осмий | Os | 76 | 190,2 |
| Палладий | Pd | 46 | 106,42 |
| Платина | Pt | 78 | 195,08 |
| Плутоний | Pu | 94 | (244) |
| Полоний | Po | 84 | (209) |
| Празеодим | Pr | 59 | 140,9077 |
| Прометий | Pm | 61 | (145) |
| Протактиний | Pa | 91 | 231,0359 |
| Радий | Ra | 88 | 226,0254 |
| Радон | Rn | 86 | (222) |
| Рений | Re | 75 | 186,207 |
| Родий | Rh | 45 | 102,9055 |
| Ртуть | Hg | 80 | 200,59 |
| Рубидий | Rb | 37 | 85,4678 |
| Рутений | Ru | 44 | 101,07 |
| Самарий | Sm | 62 | 150,36 |
| Свинец | Pb | 82 | 207,2 |
| Селен | Se | 34 | 78,96 |
| Сера | S | 16 | 32,066 |
| Серебро 2) | Ag | 47 | 107,8682 |
| Скандий | Sc | 21 | 44,9559 |
| Стронций | Sr | 38 | 87,62 |
| Сурьма | Sb | 51 | 121,75 |
| Таллий | Tl | 81 | 204,383 |
| Тантал | Ta | 73 | 180,9479 |
| Теллур | Te | 52 | 127,60 |
| Тербий | Tb | 65 | 158,9254 |
| Технеций | Tc | 43 | [97] |
| Титан | Ti | 22 | 47,88 |
| Торий | Th | 90 | 232,0381 |
| Тулий | Tm | 69 | 168,9342 |
| Углерод | C | 6 | 12,011 |
| Уран | U | 92 | 238,0289 |
| Фермий | Fm | 100 | (257) |
| Фосфор | P | 15 | 30,97376 |
| Франций | Fr | 87 | (223) |
| Фтор | F | 9 | 18,998403 |
| Хлор | Cl | 17 | 35,453 |
| Хром | Cr | 24 | 51,9961 |
| Цезий | Cs | 55 | 132,9054 |
| Церий | Ce | 58 | 140,12 |
| Цинк | Zn | 30 | 65,39 |
| Цирконий | Zr | 40 | 91,224 |
| Эйнштейний | Es | 99 | (252) |
| Эрбий | Er | 68 | 167,26 |
| 1) В расчете на атомную массу изотопа углерода 12 С, равную 12,0000. В круглых скобках указано массовое число наиболее долгоживущего нуклида. 2) См. также АТОМНАЯ МАССА. | |||
Соединения
Элементы, соединяясь друг с другом, образуют сложные вещества – химические соединения. Соль, вода, ржавчина, каучук – это примеры соединений. Соединение состоит из элементов, но обычно по своим свойствам и внешнему виду не напоминает ни один из них. Так, ржавчина образуется при взаимодействии газа – кислорода с металлом – железом, а сырьем для получения многих волокон служат уголь, вода и воздух. Именно индивидуальность свойств – одна из черт, отличающих соединение от простой смеси. Другая, и наиболее важная, характеристика соединения заключается в том, что элементы всегда соединяются между собой в определенных массовых соотношениях. Например, вода состоит из 2,016 массовых частей водорода и 16,000 массовых частей кислорода. Массовое соотношение между водородом и кислородом в водах Волги и льдах Антарктики одинаково и равно 1:8. Иными словами, каждое химическое соединение имеет вполне определенный состав, т.е. всегда содержит одни и те же элементы в одних и тех же массовых соотношениях. Это один из основных химических законов – закон постоянства состава.
Многие элементы образуют несколько соединений. Так, помимо воды известно еще одно соединение водорода и кислорода – пероксид водорода, который состоит из 2,016 частей водорода и 32 частей кислорода. Здесь водород и кислород находятся в массовом соотношении 1:16, что ровно вдвое отличается от их соотношения в воде. Этот пример иллюстрирует закон кратных соотношений: если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количеством другого, относятся между собой как небольшие целые числа.
Атомы и молекулы
Понятия атомов и молекул – основные в химии. Атом – это мельчайшая частица элемента, обладающая всеми его свойствами, а молекула – мельчайшая частица соединения, обладающая его свойствами и способная к самостоятельному существованию. Атомистическая идея восходит к 6–5 вв. до н.э. и принадлежит древнегреческим философам Левкиппу и его ученику Демокриту. По их представлениям, вещество состоит из мельчайших неделимых частиц – атомов, созданных из одного и того же первичного материала. Правда, ни один из этих философов не определил, что это за материал. Впоследствии атомную теорию развил другой греческий философ, Эпикур (4–3 вв. до н.э.). Он утверждал, что атомы обладают весом и перемещаются в горизонтальном и вертикальном направлениях, взаимодействуя друг с другом. Аналогичные идеи высказывал римский поэт Лукреций в 1 в. до н.э., наблюдавший за пылинками, которые танцуют в солнечном луче. Наконец, в 1804–1810 английский химик и физик Дж.Дальтон разработал атомную теорию, которая включала законы кратных соотношений и постоянства состава. Однако убедительные доказательства существования атомов были получены только в 20 в. Когда Лукреций утверждал, что пылинки подталкиваются невидимыми потоками движущихся атомов, он был не так уж далек от истины: их танец действительно могут вызывать воздушные течения, но даже в неподвижном воздухе частички пыли или дыма находятся в постоянном движении. Этот эффект называют броуновским движением (см. также БРОУНОВСКОЕ ДВИЖЕНИЕ). Спустя два тысячелетия после Лукреция французский ученый Ж.Перрен, вооруженный микроскопом и математической теорией, изучил случайные блуждания суспендированных частичек краски и рассчитал число невидимых молекул, чьи удары заставляли их двигаться. После того, как атомы и молекулы удалось сосчитать, само их существование стало гораздо более убедительным.
Строение атома
Согласно современным представлениям, атом содержит центральное ядро, размеры которого очень малы по сравнению с атомом в целом. Ядро несет положительный электрический заряд и окружено диффузной оболочкой (облаком) из отрицательно заряженных электронов, которая и определяет размер атома. Диаметр атома – ок. 10 –8 см, диаметр ядра в 10 000 раз меньше и равен примерно 10 –12 см. У простейшего из атомов – атома водорода – в ядре всего одна частица – протон. Ядро атомов других элементов содержит более одного протона, а также нейтроны – частицы, близкие к протонам по массе, но не имеющие электрического заряда. Заряд ядра называют его атомным (или порядковым) номером. Атомный номер равен числу протонов в ядре и определяет химическую природу элемента. Так, атом с зарядом ядра +26 содержит 26 протонов в ядре и представляет собой элемент железо. Ядро атома железа окружают 26 электронов, поэтому атом в целом электронейтрален.
Суммарное число протонов и нейтронов в ядре называют массовым числом, поскольку в этих частицах сосредоточена практически вся масса атома. Число нейтронов, содержащихся в ядрах атомов данного элемента, в отличие от числа протонов, может варьировать. Атомы одного элемента, ядра которых содержат разное число нейтронов, называют изотопами. Слово «изотоп» греческого происхождения; оно означает «одно и то же место» – разные изотопы элемента занимают одну и ту же позицию в периодической таблице Менделеева (см. также ИЗОТОПЫ) и обладают очень близкими химическими свойствами. Так, у водорода (массовое число 1) есть изотоп дейтерий, в ядре которого один протон и один нейтрон (массовое число соответственно равно 2). Оба изотопа вступают в одни и те же химические реакции, но не всегда одинаково легко.
Термин «атомная масса» означает массу атома элемента, выраженную в единицах массы атома изотопа углерода 12 С, которую принято считать равной его массовому числу – 12,0000 (атомная масса изотопа близка к его массовому числу, но не равна ему, поскольку при образовании атомного ядра часть массы теряется в виде энергии). До 1961 атомные массы элементов определяли относительно среднего массового числа для смеси изотопов кислорода, равного 16,0000. Атомная масса элемента, существующего в природе в виде смеси изотопов, – это средняя величина атомных масс всех изотопов с учетом их распространенности в природе (см. также АТОМНАЯ МАССА). Молекулярная масса равна сумме масс атомов элементов, составляющих молекулу. Например, мол. масса воды равна сумме 2 · 1,008 (два атома водорода) + 16,0000 (один атом кислорода), т.е. 18,016.
Электронное облако
Физические и химические свойства атомов, а следовательно, и вещества в целом во многом определяются особенностями электронного облака вокруг атомного ядра. Положительно заряженное ядро притягивает отрицательно заряженные электроны. Электроны вращаются вокруг ядра так быстро, что точно определить их местонахождение не представляется возможным. Движущиеся вокруг ядра электроны можно сравнить с облаком или туманом, в одних местах более или менее плотным, в других – совсем разреженным. Форму электронного облака, а также вероятность нахождения электрона в любой его точке можно определить, решив соответствующие уравнения квантовой механики (см. также КВАНТОВАЯ МЕХАНИКА). Области наиболее вероятного нахождения электронов называют орбиталями. Каждая орбиталь характеризуется определенной энергией, и на ней может находиться не более двух электронов. Обычно вначале заполняются ближайшие к ядру самые низкоэнергетические орбитали, затем орбитали с более высокой энергией и т.д.
Существует четыре типа орбиталей, их обозначают s, p, d и f. На каждом уровне (слое) имеется одна s-орбиталь, которая содержит наиболее прочно связанные с ядром электроны. За ней следуют три p-орбитали, пять d-орбиталей и, наконец, семь f-орбиталей.