Что находится в костном мозге
Что находится в костном мозге
К системе реактивности организма человека принадлежат органы, осуществляющие восприятие всех внешних и внутренних сигналов, их анализ и адекватную конкретной обстановке регуляцию жизнедеятельности, а также интеграцию функций органов и систем организма. Систему реактивности представляют органы иммунной защиты, эндокринные железы, нервная система с ее периферическим сенсорным аппаратом. Эти три части организма объединяются в единую нейро-эндокринно-иммунную систему, поскольку их деятельность взаимно согласована и зависима. Так, нейропептиды, синтезируемые эндокринными нейронами, влияют на активность иммунокомпетентных клеток, а биологические активные вещества иммунокомпетентных клеток оказывают влияние на клетки и ткани, сходные с таковыми для гормонов эндокриноцитов и пептидов нейронов.
Иммунный комплекс органов
Иммунный комплекс органов включает вилочковую железу (тимус), лимфатические узлы, селезенку, лимфоидные образования в стенке пищеварительного тракта и в других органах и красный костный мозг, где развиваются все клетки крови, в том числе осуществляющие иммунный надзор.
Несмотря на топографическую разобщенность, эти органы вместе с кровью и лимфой образуют единую в функциональном отношении систему, обеспечивающую поддержание процессов кроветворения и иммунной защиты. Органы кроветворения представляют собой открытую систему с постоянным перемещением клеток крови.
Различают центральные и периферические органы кроветворения и иммуногенеза. К центральным органам относят красный костный мозг и вилочковую железу. К периферическим кроветворным и иммунным органам принадлежат лимфатические узлы, селезенка, миндалины и другие лимфоидные образования в составе слизистных оболочек органов.
Красный костный мозг
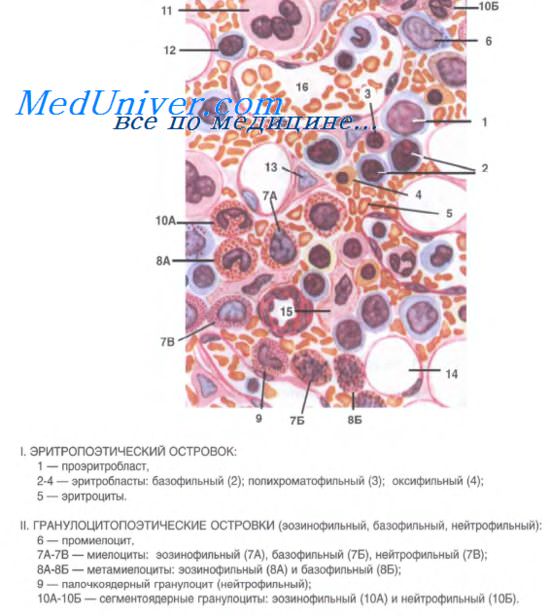
Красный костный мозг — центральный гемопоэтический орган. В нем находится основная часть стволовых кроветворных клеток и происходит развитие клеток миелоидного и лимфоидного рядов, осуществляется антигеннезависимая дифференцировка В-лимфоцитов (рис. 108).
В эмбриогенезе человека костный мозг появляется впервые на 2-3-м месяцах в плоских костях и позвонках, на 4-м месяце — в трубчатых костях конечностей. Различают красный костный мозг и желтый костный мозг. Красный костный мозг находится в эпифизах трубчатых костей, в губчатом веществе плоских костей, в лопатках, грудине, позвонках, костях черепа. Несмотря на такое рассредоточение, функционально он тесно взаимосвязан благодаря постоянной миграции клеток и наличию общих механизмов регуляции процессов кроветворения.
Масса костного мозга 1,6-3,7 кг, что составляет 3-6% от массы тела. Красный костный мозг имеет темно-красный цвет. Консистенция его полужидкая. Это позволяет делать из него тонкие мазки, изучение которых имеет большое диагностическое значение в клинике.
Строма красного костного мозга образована костными перекладинами, идущими от эндоста. Между ними располагается ретикулярная ткань. Последняя состоит из трехмерной сети гетероморфных ретикулярных клеток фибробластического вида (фибробласты костного мозга). Они вырабатывают межклеточное вещество, включающее ретикулярные волокна и амфорный компонент с большим содержанием гликозаминогликанов, ростовые факторы (интерлейкины). Кроме ретикулярных клеток к стромальным клеточным элементам относятся остеобласты, входящие в состав эндоста и способные влиять на пролиферацию гемопоэтических клеток, адвентициальные — малодифференцированные клетки, сопровождающие кровеносные сосуды, жировые клетки. Все эти клетки развиваются в результате дивергентной дифференцировки стромальной стволовой клетки и играют роль микроокружения для развивающихся клеток крови.
Строма красного костного мозга пронизана кровеносными сосудами микроциркуляторного русла. В основном это капилляры синусоидного типа с диаметром около 30 мкм.
В петлях ретикулярной ткани красного костного мозга расположено множество кроветворных клеток (в том числе стволовых кроветворных, клеток-предшественников миело- и лимфопоэза, клеток гранулоцитарного, эритроцитарного, лимфоцитарного, моноцитарного и тромбоцитарного рядов на различных стадиях дифференцировки).
Количество стволовых кроветворных клеток в красном костном мозге наибольшее по сравнению с другими кроветворными органами (50 на 105 клеток). Концентрация стволовых кроветворных клеток вблизи эндоста в 3 раза больше, чем в других участках костного мозга. Именно здесь наиболее интенсивно идет кроветворение, что связывается с выработкой остеобластами интерлейкинов и повышенным содержанием кальция.
Развивающиеся клетки крови располагаются в красном костном мозге группами (островками, «гнездами»), представляющими собой диффероны, или гистогенетические ряды клеточной дифференцировки. Эритробласты находятся вблизи макрофагов, содержащих железо фагоцитированных эритроцитов, и получают от них железо, необходимое для построения гемоглобина. Созревающие гранулоциты образуют островки, подобно эритроидным клеткам, с тем, однако, отличием, что они не имеют связи с макрофагами.
Клетки тромбоцитарного ряда (мегакариобласты и мегакариоциты) локализуются преимущественно вблизи кровеносных синусоидов. Отростки цитоплазмы мегакариоцитов при этом проникают через поры в стенке синусоидов внутрь сосудов, и от них отделяются фрагменты цитоплазмы в виде кровяных пластинок (тромбоцитов). Последние тут же поступают в кровоток.
В красном костном мозге обычно вокруг кровеносных сосудов встречаются небольшие группы лимфоцитов и моноцитов. Среди множества кровяных клеток в красном костном мозге больше всего зрелых клеточных форм или близких к состоянию зрелости (эритробластов, метамиелоцитов и др.). В случае необходимости, например, при кровопотере, они могут быстро завершить дифференцировку и перейти в кровоток. В нормальных условиях через стенку синусоидных капилляров могут проникать лишь зрелые формы клеточных дифферонов.
Желтый костный мозг расположен в диафизах трубчатых костей. Он представлен преимущественно жировой тканью. В жировых клетках содержится пигмент липохром, имеющий желтый цвет. Желтый костный мозг рассматривается как кроветворный резерв, и в случае больших кровопотерь он начинает функционировать как кроветворный орган. Желтый и красный костный мозг — это два функциональных состояния одного кроветворного органа.
Красный костный мозг очень чувствителен к действию радиации, интоксикаций бензолом, толуолом и другими ядами. Особенно уязвимы при этом «бластные» клеточные формы. Происходит опустошение костного мозга и в результате остается лишь ретикулярная строма. Отмечаются выраженные изменения костного мозга, связанные с превращением миелоидной ткани в жировую, а в старческом возрасте — в слизистую, желатинозную ткани.
Регенерация. Костный мозг обладает высокой регенерационной способностью. После удаления части костного мозга или после облучения ионизирующей радиацией происходит его восстановление за счет заселения костного мозга циркулирующими в крови стволовыми клетками. Необходимым условием при этом является сохранение жизнеспособности стро-мальных клеток. В клинике широко применяют различные методы трансплантации костного мозга.
Омолаживающий орган
Одно из главных устремлений медицины как науки – это сделать так, чтобы человек омолодился. Существует много различных теорий относительно того, как стать моложе, но к этому вопросу нужно подходить с научной точки зрения.
Чем старше человек становится, тем медленнее протекает процесс регенерации клеток в его организме. Этот процесс обновления осуществляется благодаря определённому органу. Можно ли в таком случае назвать этот орган «омолаживающим»? Давайте разберёмся.
Секрет омоложения
Сразу же приоткроем завесу тайны относительно этого «волшебного органа» – это костный мозг. Это тот орган, который буквально позволяет нам омолаживаться. Основная его функция – это регенерация клеток организма, а основная особенность, способствующая этому – наличие стволовых клеток. Костный мозг напрямую влияет на продолжительность жизни человека и его уязвимость к заболеваниям.
Все знают про этот орган, но не всем известны его безграничные возможности. И когда речь заходит об омоложении, мало кто обращает внимания на костный мозг в данном контексте.
Важно понимать, что все регенераторные способности нашего организма начинаются с костного мозга. Наш организм постоянно обновляет за счёт клеток, которые продуцируются костным мозгом, и именно о костном мозге мы должны заботиться, если хотим поддерживать свой организм в оптимальном состоянии и не болеть.
Стволовые клетки
Кровь человека состоит из эритроцитов, лейкоцитов и тромбоцитов. Они в свою очередь вырастают из родительских клеток, которые именуются стволовыми клетками. Они делятся на два вида:
Стволовая клетка способна генерировать около миллиона клеток-потомков. Когда кровяные клетки созревают в костном мозге, они становятся частью кровеносной системы. Кроме лимфоцитов – они после созревания становятся полностью рабочими клетками и уходят в лимфатическую систему (селезёнка, миндалины и т. д.).
Созревшие клетки крови имеют непродолжительный период жизни – около 8-12 дней. Исключение составляют лишь эритроциты, чей срок жизни достигает 4 месяцев. Из-за этого организм потребляет невероятно большое количество крови. В течение дня в человеческом организме погибает несколько миллиардов клеток.
Поэтому задача костного мозга в целом и стволовых клеток в частности – создавать новые клетки на смену погибшим, чтобы организм мог питаться ими и выполнять свои естественные функции.
Строение костного мозга
Костный мозг – это питательная губчатая ткань, которая располагается в полостях костей и составляет около 4.6% всей массы тела человека. Он состоит из двух частей:
Давайте рассмотрим детальнее каждую из этих составляющих.
Красный костный мозг
Красный (он же кроветворный) костный мозг – это та часть костного мозга, которая отвечает за то, чтобы в нашем теле постоянно образовывались новые клетки, вследствие чего внутренние органы будут обновляться. С течением возраста скорость этого обновления, и, соответственно, производства новых стволовых клеток, снижается. В итоге красный костный мозг уменьшается в объёме и его замещает жёлтый костный мозг.
Красный костный мозг расположен у человека внутри следующих костей:
Состоит он из двух тканей:
Красный костный мозг развивается на начальных периодах развития эмбриона, когда хрящевой скелет только начинает образовываться (происходит это примерно на седьмой неделе). В это время в его костях образуется полость, которую заполняет костный мозг. Он состоит из следующих частей:
Затем начинают появляться специальные гемопоэтические клетки и формироваться вокруг сосудов. Когда человек рождается, его костные полости заполнены красным костным мозгов (который с возрастом вытесняет жёлтый костный мозг).
Такое вытеснение не является вырождением костного мозга или какой-то аномалией – это естественный процесс, который протекает с возрастом. Однако это не значит, что данный процесс нельзя повернуть в обратную сторону и сделать так, чтобы жёлтый костный мозг постепенно заменялся красным.
Жёлтый костный мозг
Жёлтый (он же недеятельный) костный мозг – это скопление жировой ткани в костях человека, в состав которой входит множество адипоцитов (жировых клеток). Он выполняет следующие функции:
Субстанция, именуемая жёлтым костным мозгом, получила своё название благодаря жёлтому цвету, обеспеченному липохромами.
Чем моложе человек, тем больше баланс красного и жёлтого костного мозга у него склоняется к первому. У ребёнка до трёх лет жёлтого костного мозга почти нет, у человека к 25-ти годам этот баланс составляет примерно 50/50, а далее, с течением возраста, жёлтый костный мозг начинает постепенно вытеснять красный.
Травматизация
Интересной особенностью организма является то, что когда он получает травмы, в процессе которых происходит потеря крови, жёлтый костный мозг даёт возможность красному костному мозгу увеличить свою продуктивность (то есть увеличиться в объёме). Поэтому постоянная микротравматизация способствует тому, что наш красный костный мозг поддерживается за счёт ресурсов, которые производит жёлтый костный мозг, причём поддерживается в хорошем функциональном состоянии.
Но вы вряд ли захотите периодически пускать кровь и подвергать себя травмам, чтобы обеспечить более продуктивную работу красного костного мозга за счёт жёлтого. Делать это не обязательно, ведь существует множество других методов стимуляции нужного участка костного мозга.
Смотрите в видео совет от доктора Шишонина:
Подписывайтесь на доктора Шишонина в инстаграм и получайте больше полезных советов по здоровью:
«. Сообразно с моими силами и моим разумением» — донорство костного мозга — вклад в здоровое будущее
«. Сообразно с моими силами и моим разумением» — донорство костного мозга — вклад в здоровое будущее
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Представленная статья посвящена трансплантации костного мозга. В результате проведенного опроса (около 150 респондентов) мы выявили среднюю осведомленность по данному вопросу и решили осветить тонкости процесса, разобрать биологические механизмы, лежащие в его основе, и продемонстрировать некоторые современные тенденции.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Что собой представляет костный мозг?
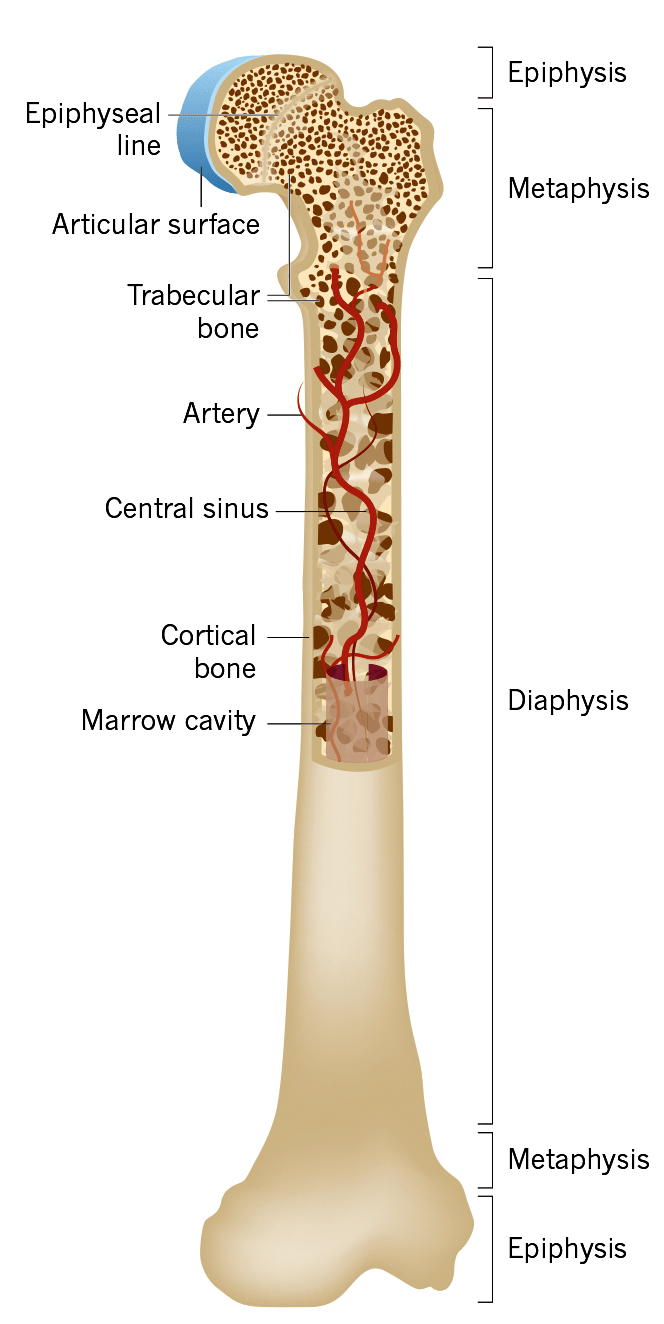
Рисунок 1. Общая анатомия кости
Сочетание слов «костный» и «мозг» может сбивать с толку и навевать стереотипные образы. Под мозгом мы привыкли представлять «рыхлую массу» в форме грецкого ореха, располагающуюся в голове. Костный мозг интуитивно можем путать со спинным, ошибочно предполагая, что он располагается в позвоночном столбе.
На самом же деле, костный мозг (КМ) — это гемо- и лимфопоэтический орган, располагающийся в полостях губчатой части и костномозговых каналах костей (рис. 1).
Выделяют две разновидности КМ — красный, цвет которого обусловлен обилием крови и гемопоэтичеких клеток, и желтый, окраска которого связана с наличием большого количества жировых клеток (адипоцитов), замещающих большинство кроветворных клеток [1].
Первоначально у человека имеется только красная разновидность, которая по мере взросления частично переходит в желтую.
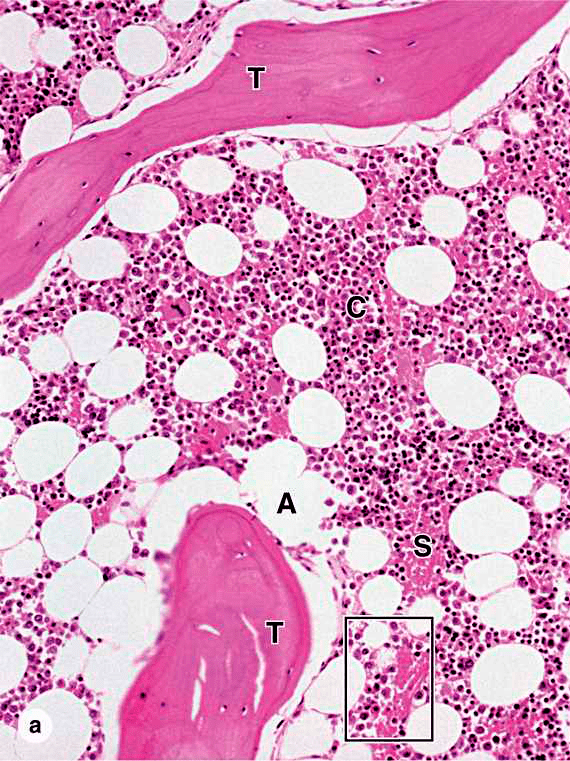
Красный костный мозг (рис. 2) состоит из ретикулярной стромы соединительной ткани, кровяных тяжей или островков клеток и синусоидальных капилляров. Строма представлена фибробластическими (стромальными = ретикулярными = адвентициальными) клетками, макрофагами и тонкими ретикулярными волокнами, состоящими из коллагена I типа, протеогликанов, фибронектинов и ламинина. Желтый костный мозг представляет собой подобную структуру, отличающуюся большим числом адипоцитов и меньшим количеством сосудов, гемопоэтических клеток [2].
Рисунок 2. Гистологический срез красного костного мозга. Т — трабекулы губчатой кости; А — адипоциты; S — синусоиды, заполненные кровью; C — кроветворные тяжи.
Какие функции выполняет кровеносная система?
Стабильное кровообращение необходимо каждому организму. Кровь выполняет множество разнообразных функций:
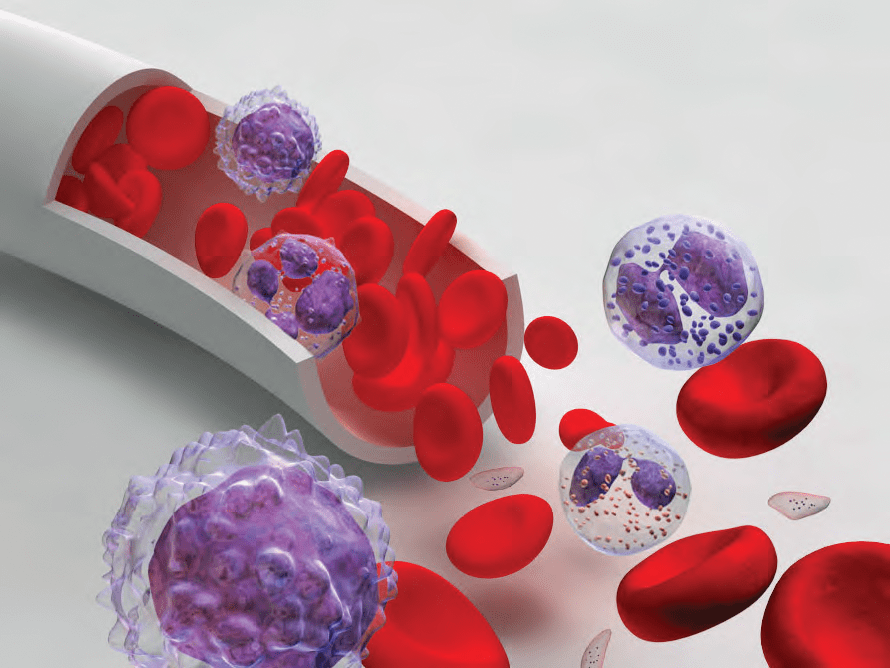
Столь большое разнообразие функций кровь может выполнять благодаря необычности своего гистологического строения: (1) форменные элементы (эритроциты, лейкоциты и тромбоциты) и (2) плазма (рис. 3). Источником форменных элементов является костный мозг. Бóльшая часть пула клеток формируется красным костным мозгом, остальная — желтым. [4].
Рисунок 3. Схема кровеносного сосуда с форменными элементами
Почему люди нуждаются в костном мозге?
Костный мозг является одним из центральных органов как кровеносной, так и иммунной систем [5]. Как отмечалось ранее, в нем находятся гемопоэтических стволовые клетки, способные дифференцироваться в различные клетки крови, например, в эритроциты, макрофаги или Т-лимфоциты.
Возникновение патологий этого органа приводит к снижению эффективности его деятельности, что ведет к ухудшению работоспособности иммунной и кровеносной систем. Организм человека становится более уязвимым. Возникает потребность в трансплантации донорского материала.
Нарушение целостности костного мозга может, произойти, например, при лечении онкозаболеваний. Вследствие применения химио- и лучевой терапии уничтожаются раковые, но вместе с ними и другие активно делящиеся клетки организма, в том числе, компоненты костного мозга. Организм теряет возможность производить форменные элементы крови.
Без трансплантации костного мозга подобное лечение нередко может принести больше вреда, нежели пользы, поскольку в итоге приводит к серьезным нарушениям в работе всего организма. В трансплантации нуждаются люди, больные лейкозом, апластической анемией, злокачественными лимфомами, аутоиммунными заболеваниями и пр.
Информированность о трансплантации костного мозга
Мы провели опрос группы потенциальных доноров (141 человека) из разных городов России (Санкт-Петербург, Москва, Орел, Казань и др.). Опросник состоял из 17 вопросов, 7 из которых были построены по методу семантического потенциала Ч. Осгуда.
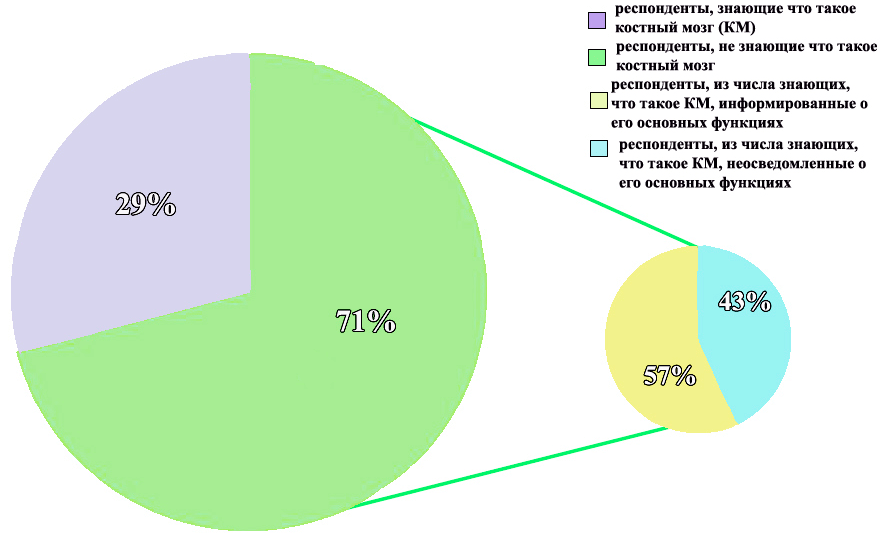
В результате проведения опроса была установлена средняя осведомленность граждан по вопросу устройства костного мозга и его функций: более половины опрошенных (71%, то есть 100 человек) дали верное определение костному мозгу, из них наиболее полно и верно перечислили его функции 43% респондентов (рис. 4).
Рисунок 4. Диаграмма анализа информированности о костном мозге и его функциях
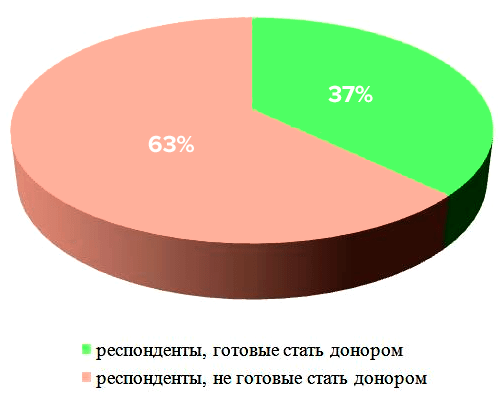
Большинство опрошенных (95,3%) знают о наличии донорства костного мозга в разной степени (от информированности о самом факте подобной операции, до сведений о многих деталях процесса). Люди осведомлены о проблеме благодаря СМИ (43,4% опрошенных), социальным сетям (50,4%) и близкому кругу (друзьям, родственникам) — 24%. Меньше половины респондентов задумывалось о том, что, став донором, смогли бы спасти жизнь (48,3%). Больше половины опрошенных (62,4%) (рис. 5) не стали бы совершать донацию костного мозга и не знают о наличии регистра доноров (65,4%). Респонденты в большинстве случаев не согласились бы сдавать костный мозг в связи со страхом получить болевые ощущения (47%) и необратимые травматичные изменения собственного здоровья (56,7%).
Рисунок 5. Диаграмма анализа количества потенциальных доноров костного мозга
Трансплантация
Трансплантация КМ состоит из четырех этапов:
Трансплантация гемопоэтических клеток костного мозга бывает двух видов: аутологичная и аллогенная.
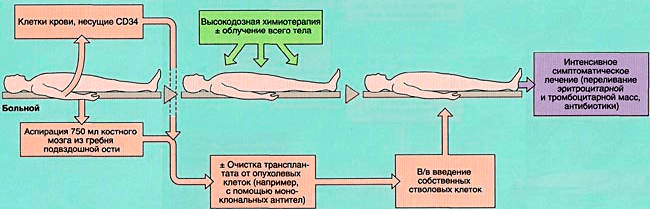
При аутологичной пересадке (рис. 6а) используются собственные стволовые клетки пациента. До жесткой химиотерапии отбираются и замораживаются клетки костного мозга. Далее, после проведения процедуры, они вводятся обратно в организм.
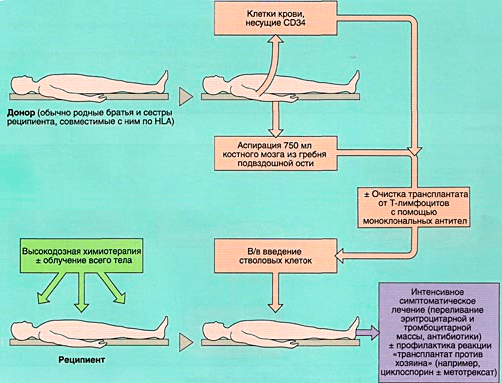
Аллогенная трансплантация (рис. 6б) представляет собой пересадку гемопоэтической ткани от здорового подходящего донора. Выделяют три вида подобной трансплантации (в зависимости от источника материала): совместимого родственного, совместимого неродственного и не полностью совместимого родственного происхождения.
Рисунок 6а. Схема аутологичной трансплантации костного мозга
Рисунок 6б. Схема аллогенной трансплантации костного мозга
Выделение нескольких типов обусловлено различием главного комплекса гистосовместимости (МНС) у разных людей и разной вероятностью возникновения осложнений при трансплантации.
Прежде чем обсудить непосредственно аллогенную трансплантацию, разберемся в том, что же такое МНС, откуда он берется и зачем нужен.
Главный комплекс гистосовместимости (МНС) — это несколько групп генов, кодирующих специфический мембранный белок — лейкоцитарный антиген человека (HLA), который осуществляет презентацию антигенов. Благодаря этому процессу происходит распознавание чужеродных антигенов и формирование адаптивного иммунного ответа. Основа последнего заключается в активации В-лимфоцитов, ответственных за формирование антител, и Т-лимфоцитов с макрофагами, обеспечивающих клеточный иммунитет (физическое удаление инородного агента). Поскольку комплекс гистосовместимости является тонкой структурой и направлен на защиту собственного организма, то у разных людей данный фактор может быть различен, следовательно, при смешивании биологических тканей, будь то кровь или костный мозг, есть шанс возникновения реакции «трансплантат против хозяина» (РТПХ). Проявление такой реакции может привести к полному неприживлению материала (иммунный ответ реципиента на клетки донора). Во избежание возникновения РТПХ до пересадки у донора и рецепиента определяют степень гистосовместимости путем HLA-типирования. По тому, насколько высока совместимость, и выделяют типы аллогенной трансплантации:
Как происходит процедура типирования и донации стволовых клеток?
Для типирования и определения HLA-генотипа у потенциального донора берут образец крови до 10 мл [9]. Проводят лабораторные исследования и вносят полученную информацию в общероссийскую базу — Национальный регистр доноров.
Если потенциальный донор подходит больному, начинается процесс изъятия стволовых клеток. Его возможно осуществить двумя путями: шприцом из тазовой кости, или с помощью препаратов, которые способствуют выходу недифференцированных стволовых клеток в кровь. В первом случае, донора госпитализируют в больницу и под общим наркозом производят забор. В тазовой кости делают несколько маленьких разрезов, через которые специальными иглами извлекают около литра жидкого костного мозга (такой объем составляет не более 5% от общего количества и компенсируется организмом в течение двух недель).
Побочные эффекты для донора при данном способе забора могут быть следующими: болевые ощущения в тазовых костях, снижение уровня гемоглобина, тошнота, сонливость, слабость (последствия наркоза).
Во втором случае донор проходит подготовительный период (около пяти дней). В течение этого времени человеку подкожно вводится препарат (рекомбинантные факторы роста = гранулоцит-колониестимулирующий фактор = гранулоцит-макрофаг-колониестимулирующий фактор) для стимуляции пролиферации и мобилизации стволовых клеток. На пятый день донору проводят процедуру афереза (получение отдельных компонентов костного мозга путем центрифугирования) длительностью 3–5 часов. Кровь забирается из вены, проходит клеточный сепаратор (установку с несколькими камерами и системой подвода/вывода жидкости и клеточной культуры, предназначенную для разделения пула на группы по размеру, удельному весу и другим характеристикам) и возвращается донору. После прохождения через аппарат, из крови выделяют небольшое количество стволовых клеток. Процедура повторяется несколько раз для отбора необходимого количества материала. Суммарно через аппарат может проходить до 15 литров крови, из которых в сепараторе остается до 200 мл (остальное отправляется обратно донору).
Побочные эффекты для донора могут быть различны: ломота в костях, связанная с активным делением клеток костного мозга; обострение аутоиммунных заболеваний (например, артрита, красной волчанки).
Риски, связанные с серьезными последствиями для организма донора в обоих случая минимален, однако при применении перфузионного катетера есть шанс возникновения кровотечения, появления абсцесса или иной местной инфекции [6]. Как правило, спустя 2–3 недели все неприятные ощущения и последствия донации проходят.
В мировой практике существует регламент, по которому донор и реципиент не должны знать друг о друге. Максимум предоставляемой информации — возраст и пол. Знакомство может произойти лишь спустя два года после трансплантации. Донорам также не сообщают: помог ли их костный мозг вылечить больного. Это не тайна, а вынужденная анонимность. Регламент соблюдается в целях предосторожности и в силу психологических и этических причин.
История от реального донора костного мозга
«Я заключила некую сделку с небесами», — говорит Алла Багирянц, которая стала реальным донором костного мозга. В 2015 году маме девушки поставили диагноз: множественная миелома (рак плазматических клеток крови). Это подвигло девушку изучить данную тему. Так она узнала, что при этом типе заболеваний может понадобиться пересадка костного мозга. Лечение миеломы проходило с помощью трансплантации аутологичных стволовых клеток. Это помогло матери Аллы, теперь она в ремиссии. Болезнь близкого человека послужила толчком, и девушка вступила в регистр доноров костного мозга в Центре гематологии.
В 2019 году Алла узнала, что есть совпадение со сторонним реципиентом и необходимо приехать в клинику для расширенного типирования. Следовало провести дополнительные анализы, чтобы удостовериться, что ни одно заболевание не осталось незамеченным. Пересаживать стволовые клетки от не совсем здорового человека может быть опасно для реципиента, ведь на момент трансплантации иммунитет пациента полностью подавлен.
«Когда наступил непосредственный момент донации, — говорит Алла, — меня проконсультировали о двух способах извлечения стволовых клеток: из тазобедренной кости и из периферической крови. Я выбрала второй вариант, доверясь врачам. Мне сделали укол лейкостима. Он стимулирует выход гемопоэтических клеток в кровь. Затем в обе руки вставили катетеры. Из одной забирали кровь, которая проходила через центрифугу, в которой сепарировались гемопоэтические клетки. А во вторую возвращали оставшуюся кровь, не содержащую стволовых клеток. По прошествии некоторого времени после начала донации у меня стали неметь конечности и лицо, но я быстро сообщила медсестрам, и они сделали мне укол, который помог. Весь процесс занял около четырех часов. После процедуры я чувствовала себя хорошо, единственной проблемой была небольшая ломота в костях. Стволовые клетки сдавала в два захода, так как с первого раза не получилось взять нужное количество. Вся донация не страшнее, чем обычная сдача крови».
Расширение базы регистра позволит быстрее находить «генетического близнеца» нуждающемуся, тем самым увеличивая его шанс на выздоровление.
Что происходит при трансплантации с больным?
Перед тем как приступить к введению гемопоэтических клеток, врачи проводят процедуру кондиционирования (химиотерапию или лучевую терапию). Это делается с целью уничтожения раковых клеток (если лечение касается онкозаболеваний) или подавления иммунной системы, чтобы увеличить шанс приживления донорских клеток. Такой процесс имеет свои негативные последствия: тошнота и рвота, выпадение волос, кровотечения, сердечная и почечная недостаточности.
Затем наступает следующий этап. После того как врачи сделали пункцию (прокол стенки сосуда, полости или какого-либо органа с лечебной или диагностической целью) у донора, начинается непосредственное переливание реципиенту. Стволовые клетки попадают в организм больного и начинают свою работу. Донорские клетки с течением времени компенсируют недостаток клеток костного мозга реципиента, налаживая кроветворение и иммунную систему. Процесс приживления обычно требует нескольких недель, после чего показатели крови начинают нормализовываться.
Риск развития патологических реакций существует на всех стадиях адаптации организма после трансплантации. Реакция может начаться в течение первых месяцев после пересадки или развиться куда позже. Это происходит вследствие того, что донорские клетки подвергаются иммунному ответу организма реципиента.
Лечение спинного мозга с применением костного
Центральная нервная система имеет ограниченные способности к восстановлению, на которые негативно влияют различные факторы, в том числе связанные с повреждениями спинного мозга. Нарушения нервных структур и воспалительные процессы в них могут привести к инвалидности.
Однако исследования в области восстановления нейронов ЦНС дали почву для развития регенеративных методов лечения. Одним из многообещающих направлений в исследовании является метод введения стволовых клеток костного мозга совместно с плазмой крови, обогащенной тромбоцитами. Такой метод стимулирует регенерацию нейронов, поддерживая рост аксонов. Предполагалось, что данный вид лечения, с использованием концентрата клеток костного мозга, предпочтительнее из-за низкой способности на иммунный ответ и их большой распространенности.
На базе института Cedar Stem Cell Institute (штат Огайо, США) проводились процедуры ввода PRP (плазмы крови, обогащенной тромбоцитами) совместно с BMAC (концентратом стволовых клеток костного мозга) пациентам, имеющим повреждения в спинном мозге. Целью исследования было оценить изменения в состоянии пациентов, имеющих любой тип SCI (повреждение спинного мозга), а также отследить изменения индекса инвалидности ODI (показателя инвалидности, где более высокие значения эквивалентны более высокой инвалидности: от 0% до 100%).
Первый этап — выделение PRP и BMAC
Для получения PRP у пациентов отбирают по 60 мл периферической крови, добавляют 10 мл антикоагулянта цитратдекстрозы и центрифугируют полученную смесь с последующим концентрированием. В результате этого в среднем получается 7–8 мл плазмы, обогащенной тромбоцитами.
Получения BMAC проводят с помощью иглы для биопсии, которая через кожу и подкожные ткани вводится в правый гребень подвздошной кости. При помощи медленной аспирации отбирается 2 шприца по 25 мл, в которые добавляется по 1000 ед\мл гепарина. Полученную смесь фильтруют и центрифугируют в течение 10 минут, получая в итоге 17 мл BMAC.
После отбора PRP и BMAC смешивают в соотношении 1:2. Последним этапом данного метода является введение полученного препарата пациенту.
В эксперименте принимали участие семь человек с различными повреждениями спинного мозга, средний возраст пациентов составил 43,7 ± 2,33 года. После получения травмы пациенты перенесли минимум два вмешательства (физиотерапию и хирургическое вмешательство), а в период от 2,4 месяцев до 6,2 лет после травмы получили лечение смесью PRP и BMAC.
Показатели ODI отслеживали с помощью опроса по категориям: интенсивность боли, уход за собой, подъем, ходьба, положения сидя и стоя, сон, сексуальная жизнь, социальная жизнь и путешествия. Пациенты должны были оценить свое состояние от 0 (нет дискомфорта из-за травмы) до 5 (максимальный дискомфорт) в каждой категории. Все оценки складывались и делились на 50, чтобы получить процент функциональной инвалидности.
У 6 из 7 пациентов на момент начала эксперимента имелась значительная функциональная инвалидность. Один пациент после процедуры прекратил свои наблюдения, а динамика остальных пяти была отображена в исследовании. У двух пациентов наблюдались изменения от «тяжелой инвалидности» до «минимальной инвалидности», они вернули способность выполнять все бытовые дела самостоятельно. Показатели третьего пациента улучшились на 40% за год, а у четвертого улучшилось состояние на 28% за два месяца наблюдения.
Побочные эффекты наблюдались у одного из семи подопечных. Он не мог получать внутривенное введение препарата. Пациент сообщил о головной боли и трудностях, связанных с памятью.
Данный метод лечения помогает избежать дополнительного травмирования, которое возникает при введении инъекций в пораженный участок спинного мозга. Он безопасен и эффективен для восстановления после травм. У пациентов наблюдается положительная динамика и минимальное количество побочных эффектов. Потенциал такого лечения велик, и оно претендует занять передовое место при борьбе с повреждениями спинного мозга.
Как сегодня ищут донора костного мозга?
Мировая практика показала, что данные о донорах, протипированных по HLA, лучше хранить в виде единой информационной базы. Регистр Всемирной ассоциации доноров костного мозга содержит данные 37 млн добровольцев из 55 стран.
Формирование РДКМ (регистр доноров костного мозга) в России только начинает набирать обороты. Например, Русфонд совместно с Первым Санкт-Петербургским государственным медицинским университетом им. академика Павлова создал базу доноров костного мозга. Регистр был назван в честь Васи Перевощикова — больного, умершего от лейкоза в девять лет из-за отсутствия донора. Сегодня в регистре числится 40 258 потенциальных доноров. Однако регистра, объединяющего все города России, — нет, что усложняет поиск донора по всей стране. База разрознена по городам и учреждениям, поэтому шанс встретить генетически подходящего донора составляет 1:10 000.
Обращение к зарубежным регистрам возможно не всегда, поскольку процедура донации от иностранного гражданина может стоить порядка 20–50 тысяч долларов. Помимо этого, из-за многовариантности генотипов (связанной, например, с многонациональностью России) поиски донора могут закончиться провалом, т.к. не будет обнаружен подходящий по HLA-типу человека.
Вследствие этого в 20–40% случаев поиск в европейских регистрах заканчивается неудачей.
«В России нет обобщенной базы доноров костного мозга, — комментирует Виктор Андронов, заслуженный донор России, основатель движения “Энергия жизни”. — Они сообщаются между собой, обмениваясь данными, но дружат не все. Проблема заключается в том, что у нас до сих пор отсутствует законодательная база — нет закона о донорстве костного мозга. Организация Русфонд создала большую базу доноров, которая сейчас является самой перспективной в стране.
Помимо отсутствия общероссийского регистра проблемой является недостаточная информированность людей. Многие путают костный со спинным мозгом, считают, что процедура является болезненной, а иногда и вовсе не знают о донорстве.
В идеале, в регистре должен быть каждый. Нам стоило бы жить под лозунгом: “Все помогают всем”. В условиях коронавируса это крайне важно, т.к. нам с иностранными донорами очень сложно в этот период.
Количество доноров в регистре — вопрос национальной безопасности и индекса человеческой отзывчивости».
Создание единого регистра является решением проблем с трансплантацией, поскольку это снизит затраты на поиск и активацию донора, что увеличит шансы на жизнь нуждающихся в пересадке.
Людей спасет отзывчивость и причастность к общему делу. Донорство способно объединять против общей проблемы, связанной с серьезными заболеваниями. Трансплантация костного мозга — шанс на жизнь.