Что можно сказать о молекулах разных веществ
Из чего состоит все вокруг или что такое молекула?
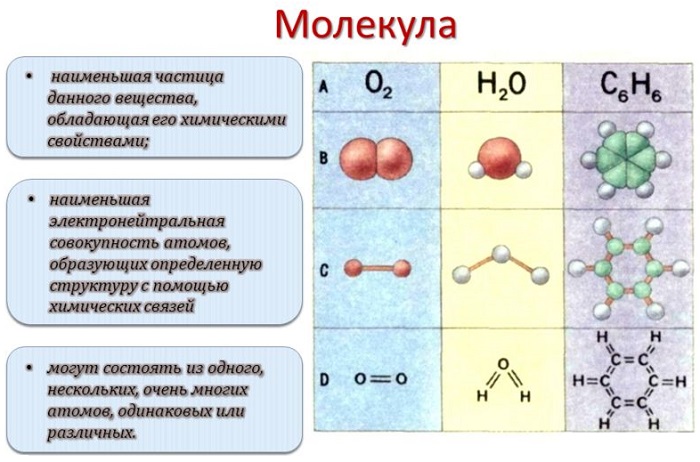
Каждый раз, когда два атома соединяются вместе, они образуют молекулу. На самом деле все, что нас окружает – да и мы сами – состоит из триллионов различных типов молекул. Понятие молекулы было принято в 1860 году на международном съезде химиков в Карлсруэ. Согласно принятому определению молекула – это наименьшая частица химического вещества, которая обладает всеми его химическими свойствами (растворимость, вкус, способность вступать в соединения и пр). Введение понятия молекулы подтолкнуло развитие физики, химии и других естественных наук. В более общем понимании молекулой называют частицу, образованную из двух или более атомов, соединенных между собой ковалентными связями.
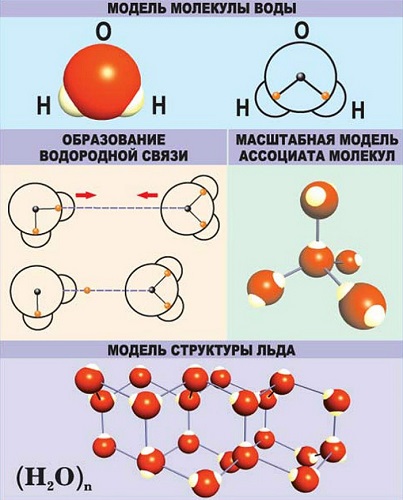
Молекула воды содержит 1 атом кислорода и 2 атома водорода
Атом – мельчайшая частица вещества, которая обладает всеми его физическими свойствами (цвет, твердость, плотность и пр.)
Когда атомы различных типов элементов соединяются вместе, они образуют молекулы, называемые соединениями. Так, вода состоит из сложных молекул, состоящих из 2 атомов водорода и 1 атома кислорода. Вот почему она называется H2O: у молекулы воды всегда будет в 2 раза больше атомов водорода, чем атомов кислорода. Существует чуть более 100 типов атомов, но типов различных веществ миллионы. Причина такого неравенства кроется в том, что они состоят из различных типов молекул.
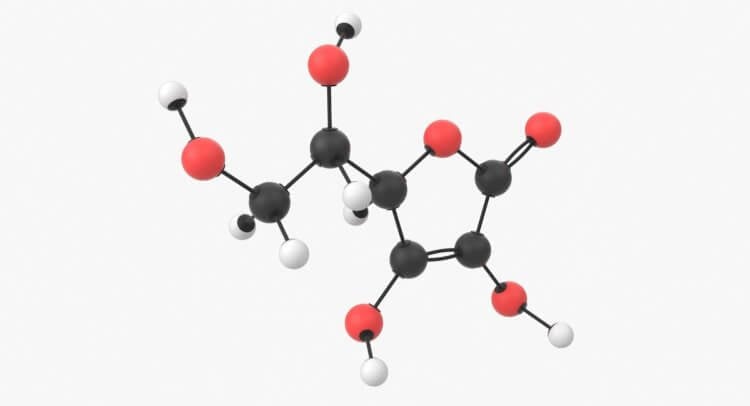
Важно понимать, что молекулы состоят не только из различных типов атомов, но и из различных соотношений. Как и в приведенном выше примере с водой, молекула воды состоит из двух атома водорода и одного атома кислорода, что записывается как H2O. Другими примерами являются углекислый газ (C02), аммиак (NH3) и сахар или глюкоза (C6H12O6). Некоторые молекулярные формулы могут получиться довольно длинными и сложными. Давайте посмотрим на молекулу сахара:
Чтобы она получилась, нужны определенные атомы в определенном количестве. Но молекулы могут быть гораздо больше. Одна молекула витамина С состоит из 20 атомов (6 атомов углерода, 8 атомов водорода и 6 атомов кислорода – C6H8O6). Если взять эти 20 атомов витамина С и смешать, соединяя их вместе в другом порядке, то получится совершенно другая молекула, которая не только выглядит по-другому, но и действует иначе.
Молекула витамина С выглядит так
Некоторые молекулы, особенно некоторые белки, содержат сотни или даже тысячи атомов, которые соединяются вместе в цепи, которые могут достигать значительной длины. Жидкости, содержащие такие молекулы, иногда ведут себя странно. Например, жидкость может продолжать вытекать из колбы, из которой была вылита некоторая ее часть, даже после того, как колба будет возвращена в вертикальное положение.
Факты о молекулах
Чтобы всегда быть в курсе последних научных открытий, подписывайтесь на наш новостной канал в Telegram
Химические связи
Молекулы и соединения удерживаются вместе силами, называемыми химическими связями. Существует четыре типа химических связей, которые удерживают большинство соединений вместе: ковалентные связи, ионные связи, водородные и металлические, однако в качестве основных выделяют ковалентные и ионные, так как они связаны с электронами. Как известно, электроны вращаются вокруг атомов в оболочках. Эти оболочки хотят быть «полными» электронов. Когда они не заполнены, то будут пытаться соединиться с другими атомами, чтобы получить нужное количество электронов и заполнить их оболочки.
Ковалентные связи делят электроны между атомами. Это происходит, когда получается, что атомы делятся своими электронами, чтобы заполнить свои внешние оболочки. В свою очередь ионные связи образуются, когда один электрон передается другому. Это происходит, когда один атом отдает электрон другому, чтобы сформировать баланс и, следовательно, молекулу или соединение.
Еще больше увлекательных статей о том, как ученые дробят реальность на атомы, читайте на нашем канале в Яндекс.Дзен. Там выходят статьи, которых нет на сайте!
Знания о свойствах и строении молекул легли в основу современной науки и нашего понимания Вселенной
Немаловажным также является тот факт, что молекулы всегда находятся в движении. В твердых телах и жидкостях они находятся очень близко друг к другу, а их движение можно сравнить с быстрой вибрацией. В жидкостях молекулы могут свободно перемещаться между собой, как бы скользя. В газе плотность молекул обычно меньше, чем в жидкости или твердом теле того же химического соединения, а потому молекулы движутся даже более свободно, чем в жидкости. Для конкретного соединения в данном состоянии (твердом, жидком или газообразном) скорость молекулярного движения возрастает с увеличением абсолютной температуры.
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.
Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
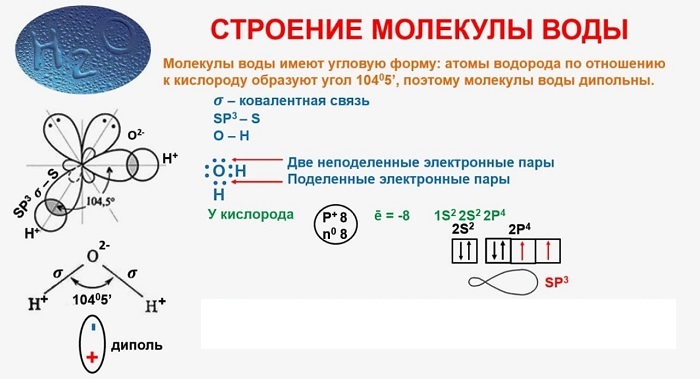
В качестве примера рассмотрим строение наименьшей частицы воды.
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.
В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы
Современная наука выделяет следующие свойства молекул:
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Атомы и молекулы: что о них известно
Атомы и молекулы: Freepick
С изучения атомов и молекул начинается знакомство с химией. Современной науке известны миллионы молекул. Разобраться с их строением и свойствами помогут особенности мельчайшей частицы — атома.
Что такое атомы
С древних времен люди стремились изучить природу вещей, которые их окружали. Постепенно пришли к мысли о том, что все вокруг состоит из мельчайших частиц.
По мере развития науки появилось понятие об атомах и молекулах. Эти частички чрезвычайно малы, и невооруженным глазом их не разглядеть. Любое крошечное количество вещества, например, пылинка, содержит невероятно большое количество атомов и молекул.
Что же такое атом? Так называют мельчайшую химически неделимую частицу вещества, а также наименьшую часть химического элемента, которая отражает его свойства. Атомы очень маленькие: их размеры находятся в диапазоне от 1 до 5 ангстрем (обозначается — Å.). Один ангстрем — это 10⁻¹⁰ м.
Когда атомы только открыли, их считали самыми маленькими из возможных частиц. Но сегодня нам известна их внутренняя структура:
Например, в атоме гелия есть ядро с двумя протонами и двумя нейтронами, а вокруг него двигаются по своим орбитам два электрона.
Мир атомов: Freepick
Элементарные или субатомные частицы во всех атомах одинаковы, отличается только их количество:
Ядра атомов заряжены положительно, так как в них находятся положительно заряженные протоны и нейтральные нейтроны. По величине заряд соответствует количеству протонов в ядре и равен порядковому номеру элемента в периодической системе.
Заряды протонов и электронов одинаковые по величине, но имеют противоположные знаки. В любом атоме число протонов и электронов равно. Поэтому заряд ядра и суммарный заряд всех электронов также равны, но имеют противоположные знаки. Следовательно, атом — электронейтральная частица.
Каждый известный атом обозначен специальным символом — латинской буквой. Все они представлены в периодической системе Д. И. Менделеева.
На современном этапе развития науки ученые стремятся разрушить атом, чтобы получить еще более мелкие частички. Однако они очень неустойчивы, и добиться их долговременного существования пока не получается.
Что известно о молекулах
Атомы различным образом соединяются друг с другом. Как из букв алфавита составляются тысячи слов, так одни и те же атомы образуют молекулы большого количества разных веществ, которые видим в окружающем мире.
Молекулой называют наименьшую частицу вещества, которая определяет его свойства и способна к самостоятельному существованию. Каждая молекула строится из атомов, которые составляют ее массу:
Таким образом, вещества не вечны, так как их молекулы не могут быть вечными. Однако их атомы практически вечны. В тех веществах и предметах, которые окружают нас сегодня, находятся атомы, которые существовали еще во времена динозавров, походов Александра Македонского и открытия Колумбом Америки.
Что такое молекулы: Freepick
Хоть молекулы и очень малы, их устройство определяют с помощью различных физических и химических методов. Чистые вещества состоят из молекул одного вида.
Если в физическом теле есть молекулы разных видов, то речь идет о смеси веществ. Когда в быту говорим о чистом воздухе, то называем так сложную смесь различных газообразных веществ. Химику придется серьезно поработать, чтобы выделить из нее отдельные чистые вещества.
Все вещества делят на простые и сложные:
Часто физические тела состоят из молекул нескольких веществ. Их называют смесями. Важно не путать сложные вещества и смеси. Если в сложном веществе содержатся молекулы одного вида, то это не смесь.
Благодаря свойству атомов объединяться в разных вариациях количество веществ, как и видов молекул, бесконечно. Никто не сможет точно назвать число веществ, которые сегодня известны людям. Ориентировочно их количество исчисляется миллионами, а химики каждый день создают новые молекулы.
Таким образом все вещества, которые мы видим вокруг нас, состоят из молекул, а те, в свою очередь, построены из атомов. Ученым удалось исследовать мельчайшие частички — атомы — и подробно описать их структуру. Эти знания стали ключом к пониманию природы молекул и даже дали возможность создавать новые молекулы.
Узнавайте обо всем первыми
Подпишитесь и узнавайте о свежих новостях Казахстана, фото, видео и других эксклюзивах.
Элементы и соединения
Элементы это простые вещества например водород, сера, уран и т.д., а соединения это вещества в состав которого входят простые вещества, например вода, сахар, кислоты и т.д.
Разница между между элементом и соединением в том, что в состав элемента входят только одни атомы определенного вещества, а в состав соединения входят атомы разных веществ.
Что такое элементы и соединения
Молекулы состоят из атомов. Возможны два вида молекул: молекулы, содержащие одинаковые атомы, и молекулы, содержащие два или более различных атома. Эти два вида молекул имеют разные названия.
Элемент, или элементарное вещество, состоит из атомов только одного вида.
Соединение, или сложное вещество, состоит из двух или более различных атомов.
Как правило, до изучения свойств вещества исследователи стремятся получить его в чистом состоянии. Даже в этом случае необходимо затратить много усилий, чтобы с уверенностью сказать, является данное вещество элементом или соединением.
Возьмем, к примеру, воду. Вероятно, вода — наиболее часто встречающееся в окружающем нас мире вещество. Свойства воды хорошо известны: внешний вид, вкус, плотность (вес единицы объема), механизм испарения, температура замерзания и температура кипения, а также механизм растворения сахара и соли в воде.
Поскольку вода характеризуется постоянными и строго определенными свойствами, она считается чистым веществом. В дальнейшем вы узнаете, как из чистого вещества — воды — можно получить два других вещества — газообразные водород и кислород.
Эти газы образуются в определенных количествах. Поскольку воду можно разложить на два других вещества, она должна состоять по крайней мере из двух видов атомов. Поэтому вода является соединением.
Сделаем два замечания. Во-первых, мы установили характерные свойства воды, что привело к определению воды как чистого вещества. Во-вторых, мы обнаружили, что из воды образуются в определенных количествах два новых вещества. Это показывает, что молекула воды содержит больше одного вида атомов, и, следовательно, вода является соединением.
Пример соединений
Обычный сахар — другой пример вещества. Большинство сортов сахара, имеющихся в продаже, довольно чистые. Это значит, что другие вещества присутствуют в сахаре лишь в очень небольших количествах. Характерным свойством сахара является его сладкий вкус.
Другое характерное свойство — растворимость в воде. Еще одно характерное свойство — поведение при нагревании. При определенной температуре сахар не только начинает расплавляться, но и разлагаться.
Расплавленный сахар темнеет и начинает пузыриться вследствие образования паров воды. В конечном счете в чашке остается черное твердое вещество — уголь. Мы определяем это вещество как разновидность углерода.
Таким образом, чистый сахар, обладающий характерными свойствами, можно подвергнуть разложению; при этом образуются вода и уголь в определенных количествах. Сахар представляет собой соединение.
Вода и сахар — соединения. А как обстоит дело с водородом и кислородом? Например, водород в нормальных условиях является газом.
Водород это соединение или элемент
Путем охлаждения до определенной температуры водород можно перевести в жидкое состояние.
При дальнейшем охлаждении до определенной температуры водород затвердевает. Водород представляет собой чистое вещество.
Нет такого метода, с помощью которого удалось бы получить из водорода два других вещества. Водород должен состоять только из одинаковых атомов. Следовательно, он является элементом.
Эти ато мы мы называем атомами водорода. Кислород также обладает характерными свойствами, но и из него нельзя получить два других вещества.
Кислород является элементом: он содержит атомы одного вида, называемые атомами кислорода.
Из чего состоит вода
Воду можно разложить на водород и кислород. Поскольку ни водород, ни кислород не могут разлагаться на другие вещества, молекулы воды должны состоять только из атомов водорода и кислорода.
Это одна из наиболее важных проблем химии: определить, из каких атомов состоит данное вещество. Насколько важна эта проблема, видно из сравнения трех веществ: воды, кислорода и водорода.
Как вода, так и кислород содержат атомы кислорода, но свойства этих веществ совершенно различны.
Вода и водород содержат атомы водорода, но их свойства не более сходны, чем свойства воды и кислорода. Свойства воды, определяемые сочетанием двух видов атомов, весьма специфичны.
Элементы
Элемент — это чистое вещество, состоящее из атомов одного вида. В настоящее время известно 118 элемента и, следовательно, столько же видов химически различных атомов.
Некоторые из этих элементов встречаются в природе в свободном состоянии и поэтому были известны уже несколько тысяч лет назад.
Такие элементы, как железо, серебро, золото, ртуть и сера, описанные очень давно, получили свои латинские названия от алхимиков. Например, железо было названо ferrum, серебро — argentum, золото — aurum.
История открытия элементов
В XIX в. число открытых элементов возросло, так как ученые начали применять количественные методы исследования.
Если в начале XIX в. был известен лишь 31 элемент, то к концу века их число возросло до 81. За это время было открыто вдвое больше новых элементов, чем за все предшествующие века.
Каждый элемент, помимо названия, для удобства получил условное обозначение из одной или нескольких букв. Так, элемент углерод обозначается буквой С, элемент неон — буквами Ne.
Символы были приняты международным соглашением химиков. Одиннадцать элементов получили свои символы в виде первой буквы их латинского названия или в слу чае необходимости первой и одной из последующих букв.
Семь из этих элементов — хорошо известные еще с древних времен металлы (см. табл.).
Символы элементов состоящие из одной или двух букв латинского названия
| Элемент | Символ | Латинское название |
| Сурьма | Sb | Stibium |
| Ртуть | Hg | Hydrargyrum |
| Свинец | Pb | Plumbum |
| Вольфрам | W | Wolfram |
| Железо | Fe | Ferrum |
| Олово | Sn | Stannum |
| Золото | Аu | Aurum |
| Натрий | Na | Natrium |
| Медь | Cu | Cuprum |
| Серебро | Ag | Argentum |
| Калий | K | Kalium |
Позднее открытые элементы получили, также по международному соглашению, одинаковые названия на всех языках.
За исключением одиннадцати элементов, приведенных в табл., все элементы имеют символы, которые можно произвести от их английских названий.
Например, символы водорода (Н), гелия (Не), углерода (С), азота (N), кислорода (О), кальция (Са) и хлора (Сl) легко получить из их названий.
Отметим, что гелий получил свой символ (Не) для удобства отличия его от водорода (Н). Аналогичным образом, поскольку С — символ углерода, символы кальция (Са) и хлора (Сl) состоят из двух букв.
Периодическая таблица элементов содержит полный перечень химических символов.
Химические формулы

Опыты показали, что эта модель должна состоять из двух атомов водорода и одного атома кислорода. Преимущество такой модели состоит в том, что она показывает также пространственное расположение атомов.
В молекуле воды каждый из двух атомов водорода расположен по отношению к атому кислорода в вершине треугольника.
Число и вид атомов в молекуле могут быть охарактеризованы также с помощью молекулярной формулы.
Пример химической формулы воды
Например, молекула воды может быть обозначена Н2O. В этой молекулярной формуле Н — атом водорода, О — атом кислорода, а цифра 2 после Н показывает, что в молекуле воды два атома водорода связаны с одним атомом кислорода.
Молекулярная формула аммиака NH3 показывает, что одна молекула аммиака состоит из одного атома азота N и трех атомов водорода Н.
Опыты показали, что кислород двухатомный газ (каждая молекула состоит из двух атомов). Поэтому он имеет молекулярную формулу О2. Водород также двухатомный; его формула Н2.
Число и расположение атомов в молекуле можно видеть из структурной формулы. Структурные формулы, подобно рассмотренным моделям, показывают взаимосвязь атомов.
Так, Н2О имеет структурную формулу
В структурной формуле Н—О—Н черточки обозначают связи между атомами. Связь между атомами называется химической связью. Мы видим, что каждый из двух атомов водорода связан с атомом кислорода.
тоже согласуются с молекулярной формулой Н2О, но свойства воды показывают, что атомы в ее молекуле связаны между собой иначе.
Никакая написанная формула не может так наглядно дать представление о строении молекулы, как молекулярная модель. Поскольку химики обнаружили, что от строения молекулы зависят ее химические свойства, создание схем и моделей молекул является важной задачей.
Обычно используют несколько типов моделей в зависимости от того, на что обращается основное внимание.
С помощью пространственных сферических моделей можно наглядно представить связи между атомами и их взаимное расположение.
Любой исследуемый образец вещества содержит очень большое число атомов. Мы всегда имеем дело не с отдельными атомами или молекулами, а с совокупностью этих частиц.
Поэтому для сравнения количеств различных веществ выбрали единицу измерения, большую, чем один атом или одна молекула.
1 моль молекул кислорода О2 содержит 2 моля атомов кислорода (2•6,02•10 23 атомов), так как молекула кислорода двухатомна. 1 моль молекул фосфора Р4 содержит 4 моля атомов фосфора и т. д.
Для удобства ведут счет на моли, причем число 6,02•10 23 на первый взгляд кажется выбранным произвольно. Почему же за единицу измерения не взято более простое число, скажем, миллиард молекул? На это есть своя причина.
Химики предпочитают определять величину, которую можно измерить легко и с большой точностью. Взвешивание — более легкая операция, чем счет, когда число частиц, которое надо пересчитать, очень велико.
Поэтому основывают определение моля на выбранном весе, а не на выбранном числе частиц. В прошлом веке химики договорились между собой принять число молекул в 32,0 г кислорода за стандартную величину.
При таком определении моль — число молекул кислорода, которое содержится точно в 32,0 г этого элемента. Понятие моля чаще связано с числом частиц, чем с весом.
Атомные и молекулярные веса
Это количество вещества, которое можно измерить на обычных весах. Вес 1 моля атомов имеет очень большое практическое значение. Этот вес называется атомным весом.
Атомный вес элемента — вес авогадрова числа его атомов, выраженный в граммах.
Теперь рассмотрим соединения. Этот вес называется молекулярным весом. Молекулярный вес соединения — вес авогадрова числа его молекул, выраженный в граммах.
Пример определения молекулярного веса
В качестве примера рассмотрим хлористый водород. Это соединение имеет молекулярную формулу НСl. При работе с с хлористым водородом, часто нужно знать его молекулярный вес.
Этот вес легко вычислить по атомным весам атомов Н и Сl, входящих в состав молекулы:
Аналогичным образом можно вычислить вес 1 моля молекул воды Н2O.
Молекулярный вес Н2О = 2 (атомный вес Н) + 1 (атомный вес О) = 2 (1,01) + 16.00 г =18,02 г
Атомные веса очень важны, поэтому их значения всегда должны быть под рукой. Атомные веса элементов указаны в периодической таблице и в таблице атомных весов.
Упражнение
Какие различия между водой, кислородом и водородом вы можете отметить, основываясь на ваших знаниях? Например, можно рассмотреть:
а) температуру кипения и температуру плавления,
б) роль в процессе горения,
в) роль в поддержании жизни.
Сахар — другое вещество, которое содержит атомы кислорода и водорода. Но, помимо них, в состав молекул сахара входят еще и атомы углерода. По своим свойствам сахар не похож на воду, кислород или водород.
Наличие в молекуле различных видов атомов и их расположение определяют свойства, характерные только для сахара. Свойства любого вещества определяются входящими в его состав атомами, их числом и расположением.
Похожие страницы:
Понравилась статья поделись ей