Что находится в узлах кристаллической решетки алмаза
Какая кристаллическая решетка у алмаза и в чем ее уникальность
Кристаллической решеткой алмаза ученые заинтересовались давно. Благодаря ее характеристикам, камень имеет особые свойства и ценность. Существуют аллотропные модификации, используемые в промышленности, электронике, медицине, космонавтике, авиации. В настоящее время развивается отрасль по созданию искусственных алмазов, но она требует больших затрат.
Строение кристалла и способ образования
Камень алмаз – кубическая аллотропная форма углерода, шестого элемента таблицы Менделеева. Образуется после сверхбыстрого охлаждения под действием сильного давления. Добывается в кимберлитовых трубках – вертикальных образованиях, возникших при прорыве магмы сквозь кору земли.
Под фразой «кристаллическая решетка алмаза» понимают пространственное расположение и соединения атомов углерода, обусловливающие твердость минерала.
По сути алмаз – это модификация углерода.
К какому типу относится кристаллическая решетка алмаза
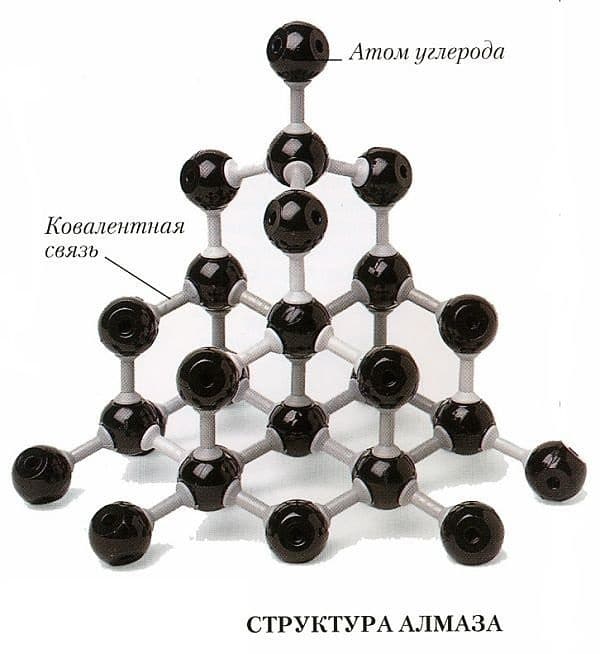
Минерал имеет атомную кристаллическую решетку, т. е. в узлах расположены атомы углероды.
Особенности строения кристаллической решетки алмаза обусловливают его прочность, т. к. каждый атом находится в центре тетраэдра (треугольная или трехгранная пирамида) и связан ковалентными связями. При этом каждый атом плотно связан с четырьмя соседними атомами.
Для алмаза характерна кубическая сингония, т. е. элементарная ячейка представлена в форме куба.
Строение кристаллической решетки алмаза:
Атомы, расположенные в центре граней – общие для двух ячеек. Атомы, расположенные на вершинах – общие для восьми ячеек. Между собой они соединены наиболее прочным подвидом ковалентной связи – сигма-связью.
Всего химики выделяют 4 типа связи атомов между собой:
Последний тип связи, формирующий кристаллическую решетку у алмаза, считается самым прочным.
Не все алмазы состоят исключительно из углерода. Иногда в составе встречаются посторонние примеси (кальций, алюминий, бор, магний, кремний, гранит, газы). Если примеси расположены поверхностно, то их можно удалить при огранке. Если же внутри камня, то такие алмазы не представляют ювелирной ценности и используются в промышленности.
Пример кристаллической решетки камня в видео:
Физические и химические свойства
Химическая формула минерала – C. Кристалл хорошо проводит тепло, но не проводит (или слабо проводит) электрический ток. Имеет хорошие преломляющие и отражающие свойства.
Плавится при температуре свыше 3700 градусов. Горит в сочетании с кислородом при температуре более 721 градуса. Устойчив к кислотам и щелочам.
Аллотропные модификации
Некоторые другие химические элементы имеют схожую с алмазом структуру, но несколько отличную молекулярную кристаллическую решетку. Различие – в расположении атомов.
У алмаза атомы углерода располагаются близко друг другу. А у других элементов с большей атомной массой – расстояние между атомами больше, что снижает их прочность.
Из аллотропных модификаций известны:
Аллотропные модификации способны к трансформации: под действием температуры 1800 градусов они преобразуются в графит.
Дополнительно смотрите видеоматериал об аллотропных формах углерода — алмазе и графите:
Способы применения вещества
Обработанные и ограненные камни высокого качества – бриллианты с идеальной кристаллической решеткой и составом (без примесей и дефектов) – используют для производства ювелирных украшений. Это наиболее прибыльная сфера применения минерала.
Дефектные камни идут на другие нужды:
Получение искусственных минералов
В настоящее время разработаны методики получения алмаза из графита.
По HPHT методу, формирование искусственного камня достигается воздействием 3000-градусной температуры при давлении более 1000 Па и добавлением металлов. Это приводит к изменению ковалентных связей в кристаллической решетке и образованию пористых мутных камней.
Но считается, что лучший способ получения искусственных самоцветов – это выращивание при температуре 1500 градусов. Но это затратный метод, как и создание алмазов с помощью ультразвука. Поэтому принято получать камни из паров метана. Метод основан на пленочном осаждении графита.
Технологии неуклонно развиваются, и возможно в скором будущем, ученые научатся синтезировать искусственные алмазы при минимальных затратах.
Может быть, вам известны еще какие-то особенности строения или получения алмазов? Поделитесь своими знаниями в комментариях. Делайте репост в соцсети.
Кристаллическая решетка алмаза
Кремированное тело человека массой 80 кг превращается в 2,5 кг пепла. Некий Риналдо Уилли из Швейцарии, еще учась в университете, увлекся изучением вопроса превращения углерода в искусственный алмаз. Ему пришла необычная идея – превращать пепел умерших людей в алмазы. А как происходит образование в природе?
Способ образования
Алмаз – один из самых дорогих драгоценных камней уже много столетий. Вопросы о генезисе до недавнего времени были спорными. Ещё в 50-х годах прошлого столетия утверждалось об их растительном происхождении, причем монография Гепперта об этом была удостоена высших наград и признаний со стороны голландского ученого сообщества. Продолжалось такое положение дел совсем недолго, а именно, открытие воронок в Африке и метеоритов с алмазными вкраплениями изменило устоявшее суждения о происхождении этого камня.
Основной тип месторождений – трубки, образованные взрывом, их еще называют диатремы. Эти диатремы в основном сложены кимберлитами – брекчиевидными изверженными породами. Кимберлиты в своем составе содержат также и древние глубинные породы – ксенолиты. Существует предположение, что именно они слагают верхнюю мантию Земли.
Глубинные породы с алмазами, вынесенные взрывом на поверхность, а также минеральные включения, указывают образование последних под действием высокого давления и температуры. Эти два показателя говорят об определенной фации глубинности (110-135 км) при давлениях 4-4,3 Гпа. Если перевести в привычные «атмосферы» или «бары», то получится приблизительно 40 тыс. атмосфер. На сегодня считается, что алмаз в трубках образовался на глубине 100-200 км при температурах 1300-1700oC и более высоких давлениях.
Несмотря на условия образования, алмаз на земной поверхности – неустойчивая стабильная углеродная модификация. По нашим представлениям он должен был преобразоваться в графит, но этого не произошло.
Физические и химические свойства
Алмаз не является на 100% чистым углеродом, как и в других относительно чистых минералах присутствуют различные примеси. Главной примесью, оказывающей влияние на свойства камня, является азот. Кристаллы, которые непрозрачны к УФ излучению, относят к 1 типу, а все остальные – 2 тип. В 1 типе камней азотная составляющая достигает 0,25%, тогда как во втором азот не превышал 0,001%. На этом примере мы видим корреляцию различных свойств камня, что позволяет делать предварительные выводы внутреннем составе без детального изучения о принадлежности к типам.
Алмаз не вступает в реакцию с растворами кислот и щелочей и только при температуре 800 ºС довольно легко реагирует с расплавленными щелочами, солями кислородных кислот и некоторыми металлами.
Сгорает на воздухе при температуре 850-1200 ºС, выделяя углекислый газ. Окисление происходит при 600 ºС, а при нагревании до 1600 ºС в вакууме частично превращается в графит.
Алмаз – самый твердый минерал на Земле. По шкале Мооса – 10. При этом очень хрупкий. Твердость на различных гранях кристалла не одинакова, самая прочная – октаэдрическая грань. Плотность 3515 кг/м3 у прозрачных образцов, у непрозрачных немного ниже. Отталкивает воду, но прилипает к жирам. На свойствах основан метод отбора камней из руды, иногда применяемых в комплексе.
Строение кристалла
Графит же представлен слоистой структурой. Химические связи между атомами существуют внутри слоя и образ кристаллическая решетка алмазауют гексагональную сетку (гекса – кратно шести), связи же между слоями (межмолекулярные) слабые, слои как бы скользят относительно друг друга. На этом свойстве основаны графитовые смазки.
Тип кристаллической решетки алмаза
Вспоминая курс химии за 11 класс, мы знаем, что существуют 4 типа кристаллических решеток:
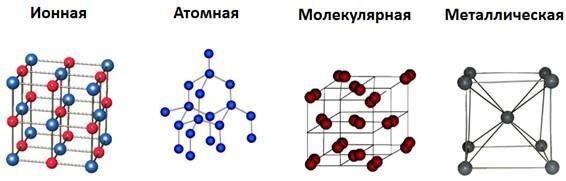
Химическая связь в углеродных минералах
По химическому составу алмаз – углерод в чистом виде, но из углерода состоят много других минералов, веществ на Земле, и они все совсем непохожи друг на друга. Давайте разберемся в модификациях и ответим на этот вопрос.
По мнению ученых углерод изначально содержался в газовом облаке, из которого образовывались планеты. В каждой планете присутствует этот элемент, более того, это один из 4 макроэлементов, являющийся «строительным материалом» нашего тела. Имея различные химические связи и расположения атомов относительно друг друга углерод составляет разные вещества. Это свойство называется аллотропией. Если условно назвать их модификациями углерода (аллотропными модификациями), то применительно к геологии, известны следующие:
Все эти вещества в основе своей имеют углерод, но как мы видим они отличаются друг от друга. Такое сочетание возможно благодаря химическим связям между атомами этого элемента и их расположению.
Для тех, кто заинтересовался этой темой, может быть полезен научный фильм, который легко разыскать на просторах интернета, а называется он «Углерод и его аллотропные формы – алмаз и графит» (Киевнаучфильм, 1981 год).
Применение в промышленности
Алмаз не царапается ни одним из существующих элементов на Земле. Это замечательное свойство получило широкое распространение в области народного хозяйства. Два аллотропных состояния одного химического элемента углерода – графит и алмаз, а имеют столь разное применение. Графит наименьшей твердостью используется в качестве сухой смазки в механизмах трения, тогда как алмаз с наивысшей твердостью по шкале Мооса, применяется в качестве абразивного материала. Буровые коронки с алмазным напылением, шлифовальные круги – это малая часть орудий производства по обработке материалов.
Алмаз нашел своё применение и в изучении космоса в качестве теплоотводящего материала при экстремальных температурах.
Cтанция «Пионер», запущенная к Венере в 1978 году, была покрыта материалом из алмазной крошки.
Широкое применение технических образцов (искусственно полученных) известно в радиоэлектронике, оптических приборах, при производстве медицинских инструментов. Для нужд техники производится 500 млн карат искусственных алмазов, это 100 тонн ежегодно.
Как получить драгоценный камень из графита
Для получения синтетических аналогов необходима высокая температура и давление в специальных установках. Конечно, давление, созданное геологическими преобразованиями, не сравнимо по длительности действия. Считалось, что драгоценные камни из графита получить практически невозможно из-за технических сложностей. Первые искусственные драгоценные камни были получены весом меньше одного карата (1 карат = 0,2 г) и даже были огранены, но получение более весомых экземпляров наталкивалось на определенные трудности. Дело в том, что сложные установки не в состоянии выдержать долгое время высокую температуру и давление, а для выращивания полукаратных образцов нужно время.
С развитием технического прогресса известны две распространенные технологии получения синтетических образцов: HPHT (high pressure high temperature) и CVD (chemical vapor deposition). Первый расшифровывается – «высокое давление высокая температура», а второй метод – «химическое парофазное осаждение».
Самый крупный по технологии HPHT получен в России (32,26 карата) и был огранен. Масса бриллианта составила 10,02 карата.
Позже в Китае был создан самый крупный искусственный аналог CVD в мире массой 46,2 карата (ограненный бриллиант – 12,75 карат). Оба экземпляра подтверждены сертификатом Международного Геммологического Института (IGI) в Гонконге.
Кристаллическая решетка алмаза: что это и на что влияет
Алмаз — удивительный минерал, тверже, чем гранит, базальт и другие известные науке вещества. Его уникальные характеристики нашли свое применение в различных сферах хозяйственной деятельности: от приборостроения до ювелирного дела. Кристаллическая решетка алмаза имеет удивительное строение, благодаря которому этот минерал и стал одним из самых дорогих и востребованных в мире.
Ученые выяснили, из чего состоит удивительный минерал, и как объясняется удивительная твердость минерала, лишь в конце 18-го века. С тех пор предпринимались многочисленные попытки повторить это чудо природы и получить этот уникальный кристалл природного алмаза в лабораторных условиях. Парадокс состоял в том, что процесс возникновения минерала его структуры и решетки, был уже понят и описан, не хватало лишь технических условий определенного типа. Прогресс науки и изобретение новых лабораторных устройств, привели к тому, что в начале 50 г. 20-го века три страны СССР, ЮАР и США объявили о синтезе искусственных драгоценных камней.
Строение
Удивительный камень состоит из атомов углерода, соединенных между собой в пространстве в особом порядке. Порядок расположения атомов вещества называется кристаллической решеткой. Особое расположение частиц, тип решетки и задают плотность алмаза. Любая из ячеек имеет форму куба, поэтому и кристаллическая решетка этого камня названа кубической.
В каждой ячейке атомы углерода расположены в тетраэдрическом порядке. Прочные ковалентные связи между атомами углерода, образованы с помощью перекрывания sp3 гибридных орбиталей этих атомов. Каждый атом связан таким образом с четырьмя другими. Поскольку наивысшая валентность углерода равна четырем, то все возможные связи оказываются занятыми, и стороннее взаимодействие попросту невозможно. Именно тип кристаллической решетки и объясняет удивительный парадокс — необычайная твердость алмаза, крепче которого не существует в природе.
Разновидности углеродных соединений
Известны еще две разновидности кристаллического вещества, состоящие из атомного углерода, это лонсдейлит и графит. Кристалл минерала алмаза значительно тверже своих собратьев. Лонсдейлит встречается лишь в останках метеоритов, а графит можно увидеть на каждом шагу. Парадокс, но мягкость графита, который легко слоится, и абсолютная твердость алмаза, объясняется лишь разным строением кристаллической решетки. Тип атомов у этих веществ абсолютно одинаков. Все дело в том, что кристаллическая решетка алмаза и графита и различны.
У графита решетка имеет гексагональный характер, частицы углерода расположены слоями, дистанция между которыми превышает расстояние между атомами в одном слое. Этим объясняется и электропроводность графита, и его высокий показатель поглощения света. Алмаз обладает кубической оксагональной решеткой, которая отвечает за его высокую прозрачность и низкий уровень электропроводности. Расстояние между атомами кристаллической решетки везде имеет одинаковое значение, поэтому прочность этого минерала особенно высока. В связи с этим кристалл алмаза является хорошим диэлектриком, практически не пропускающим электрический ток.
Состав
Кристалл алмаза содержит примеси таких веществ, как алюминий, магний, кремний, кальций, гранит. Часто встречается тип кристаллов с включениями воды, углекислоты и газообразных веществ. Распределение примесей обычно неравномерно, больше всего посторонних включений наблюдается на периферии кристалла.
Тип кристаллической структуры такой, как алмаз, встречается в строении других элементов 4-ой группы. Однако с увеличением атомной массы расстояние между атомами растет, и прочность ковалентных связей падает. Твердость алмаза объясняется тем, что атомы углерода расположены очень близко друг от друга.
Свойства
Плотность алмаза составляет 3511 кг на куб. м. Этот минерал — эталон твердости по шкале Мооса, значение его твердости составляет 10 баллов. Гранит, например, имеет плотность 8-9, мрамор — еще меньше. Парадокс алмаза заключается и в том, что при абсолютных значениях твердости, прочность алмаза невелика, он превращается в пыль от резкого удара обычного молотка.
Спайность. Плотность алмаза неравномерна, камень раскалывается по системе плоскостей, параллельных граням кристалла. Такая способность в минералогии называется спайностью. Правильно выбранный тип плоскости спайности важен при ювелирной обработке, которой подвергается кристалл алмаза — точно выбранные угла раскола отделяют ненужные примеси, дефекты и вкрапления воды и твердых веществ, понижающие стоимость драгоценного камня.
Прозрачность. Структура алмаза позволяет предположить, что это камень должен быть абсолютно прозрачным для видимого света. Парадокс, но алмаз чистой воды не существует, реальные алмазы содержат от 2 до 5% примесей, которые искажают строение кристаллической решетки, делая ее неидеальной.
В последнее время открыта особенность алмаза изменять свой цвет под действием рентгеновского излучения. Облучение заставляет кристалл алмаза излучать свет в синей и зеленой части спектра. Кристаллическая решетка минерала под действием радиоактивности становится рыхлой, ковалентные связи между атомами нарушаются. Алмаз теряет свои показатели прочности и прозрачности.
Парадокс алмаза распространяется так же на его химические показатели. Этот минерал необычайно стоек к воздействию различных кислот, вне зависимости от их температуры. В атмосфере этот кристалл алмаза сгорает при температурах около 1000°С. При более высоких температурах, порядка 1400°С, в вакуумной среде структура алмаза разрушается, начинается процесс превращения алмаза в графит. Точный расчет давления и температуры позволяет избежать образования графита и из углеродной заготовки ученые получают искусственный алмаз.
Природный кристалл алмаза
Добытый в природе алмаз имеет плоскогранную кристаллографическую форму. Часто встречаются и сложные, комбинированные разновидности. Грани найденных кристаллов обычно покрыты различными наростами и углублениями. Мнение о том, что алмаз чистой воды всегда бесцветен, ошибочно: в природе встречаются различные цвета этого минерала — красные, желтые, зеленоватые. Существует и парадокс — камни черных или темно-серых тонов. Окраска камня также может быть неравномерной. Тон окраски и степень ее однородности зависит от различных вкраплений инородных веществ, таких, как гранит, например.
Искусственный алмаз чистой воды высоко ценится в науке, технике, различных сферах производственной деятельности в ювелирном деле. Поэтому доскональное знание особенностей этого минерала, изучение кристаллической решетки алмаза привело к тому, что производство технических алмазов стало новой отраслью промышленности ведущих стран мира.
Кристаллическая решетка и свойства алмаза
Алмаз — минерал, который является не чем иным, как модификацией углерода. Чистый алмаз имеет формулу, состоящую всего из одного элемента. Камень обладает уникальными свойствами в природе, поэтому кристаллическая решетка алмаза заинтересовала ученых, и структура вещества продолжает изучаться.
Идеальный алмаз можно представить как гигантскую молекулу углерода. Состав минерала ученые изучили только в конце XVIII века. С того момента начались попытки искусственного синтеза алмаза в лабораториях, но они были бессмысленными, поскольку отстроить кристаллическую решетку с нуля не получалось.
А еще техника не была на таком уровне, чтоб создать условия для образования алмаза. Только в пятидесятых годах ХХ века ученые смогли синтезировать алмаз самостоятельно. Этим занимались такие страны, как СССР, США и ЮАР.
Строение вещества
Вся загвоздка и сложность производства заключалась в уникальной структуре алмаза. Между атомами в химии может сформироваться четыре типа связи:
Самая прочная из них — ковалентная связь. Она также имеет свои подвиды: сигма-связи и пи-связи. Второй подвид менее прочный. В алмазе есть несколько миллионов атомов углерода, которые соединены между собой с помощью ковалентных связей.
Пространственное расположение атомов и их соединения называются кристаллической решеткой. Именно ее строение и обусловливает такую характеристику, как твердость вещества. Элементарная ячейка структуры алмаза выглядит как куб. То есть алмаз кристаллизуется в кубической сингонии, если пользоваться научной терминологией.
На вершинах этого куба находится по атому углерода. По одному атому располагается в каждой грани, а еще четыре — внутри куба. Центральные атомы в гранях являются общими для двух ячеек, а те, что находятся в вершинах куба, — общие для восьми ячеек. Между собой атомы соединены ковалентными сигма-связями.
Такая структура и упаковка считается наиболее плотной. Каждый атом углерода располагается в центре тетраэдра и связан по всем сторонам. Поскольку валентность углерода равняется четырем, то все связи оказываются перекрытыми, и взаимодействие с веществом со стороны невозможно.
Расстояние между атомами одинаковое, свободных электронов нет, поэтому минерал является хорошим диэлектриком. Твердость алмаза достигается именно благодаря такому строению. Эти характеристики, в свою очередь, и стали причиной широкого использования камней. Они применяются не только в ювелирном деле, но и в качестве абразива, а также покрытия для инструментов.
Но не все в природе идеально. Даже в алмазах часто встречаются примеси. Такая структура позволяет минералу выглядеть абсолютно прозрачным, без включений. Но добываемые камни не всегда обладают ювелирными свойствами из-за большого количества дефектов и примесей.
Кристалл алмаза может содержать такие вещества:
Иногда в составе встречается вода, углекислота или другие газы. Примеси в кристалле располагаются неравномерно и несколько нарушают кристаллическую структуру. Если дефекты располагаются на периферии, что происходит чаще, тогда с ними можно бороться с помощью огранки.
Аллотропные модификации
Не только алмаз имеет подобный тип строения кристаллической решетки. Другие элементы из четвертой группы также имеют похожую структуру. Но все дело в атомной массе. Атомы углерода располагаются на близком расстоянии друг от друга, что делает связи прочнее. А вот с увеличением атомной массы элементы располагаются дальше и прочность соединений между ними падает.
А также у углерода есть в природе аллотропные модификации, куда, кроме алмаза, входят и другие вещества:
Ученых интересовала возможность превращения графита в алмаз. Сделать это можно только под действиями очень высокого давления и температуры.
Все дело в том, что графит отличается по пространственному расположению атомов и связям между ними. Если у алмаза все связи ковалентные-сигма, то пространственные связи графита — пи-соединения. А также в решетке графита остается несколько свободных электронов у атомов, которые перемещаясь, создают эффект электропроводности. Такая форма решетки называется гексагональной. Поэтому графит по шкале твердости имеет показатель единицу.
Лонсдейлиты еще не изучены окончательно, поскольку их добывают либо искусственно, либо из метеоритов, упавших на землю.
А вот фуллерены имеют кристаллическую решетку, напоминающую мяч, сложенный из восьмиугольников. По углам фигур расположены не атомы, а молекулы углерода. Эти вещества также продолжают исследовать.
Химический состав алмаза записывается формулой или элементом С.
Кроме показателя твердости — 10 из 10 по шкале Мооса — алмаз обладает такими характеристиками:
В природе добытый минерал имеет форму кристалла с разным количеством граней. Иногда добывают не полные камни, а только сколы от больших алмазов. Определить скол это или полноценный минерал можно, изучив строение кристаллической решётки. Грани минералов часто покрыты наростами и углублениями.
Цвет алмаза также отличается разнообразием. Встречаются желтые, красноватые или даже черные оттенки алмазов. Конечно, кристаллическая решетка у камней изменена. Но свойства от этого страдают не сильно. Такие минералы называют фантазийными. Их окраска может быть неравномерной и зависеть от примесей в структуре.
Идеальное строение существует только у искусственных алмазов. Производство этих камней требует затравки в виде натурального кристалла, а также большого количества денежных вложений и аппаратуры. Но именно изучение кристаллической решетки и повлияло на развитие этой отрасли.







