Что изучает механизм сокращения мышц
Биомеханика мышечного сокращения
В. Н. Селуянов, В. А. Рыбаков, М. П. Шестаков
Глава 1. Модели систем организма
1.1.5. Биомеханика мышечного сокращения
Сила — векторная величина, являющаяся мерой механического воздействия на материальную точку или тело со стороны других тел или полей (Б. М. Яворский, А. А. Детлаф, 1974). Сила полностью задана, если указаны ее численное значение, направление и точка приложения.
В теории и методике физического воспитания рассматривают физическое качество силу как способность человека напряжением мышц преодолевать механические и биомеханические силы, препятствующие действию (Зациорский В. М., 1972; Л. П. Матвеев, 1991).
Мышцы могут проявлять силу: без изменения своей длины (изометрический режим), при уменьшении длины (изотонический режим), при удлинении (эксцентрический режим), при использовании специальной аппаратуры возможно соблюдение изокинетического режима (в ходе сокращения мышц соблюдается либо постоянная скорость, либо сила).
Силовое проявление мышцы зависит от:
— интенсивности активации мотнейронного пула спинного мозга данной мышцы;
— количества активированных двигательных единиц и мышечных волокон;
— количества миофибрилл в каждом мышечном волокне;
— скорости сокращения миофибрилл, которая зависти от активности миозиновой АТФ-азы и величины внешнего сопротивления;
— законов механики мышечного сокращения (сила — длина мышцы, сила — скорость сокращения);
— начального состояния исполнительного аппарата (утомленные мышечные волокна демонстрируют меньшую силу).
Спортсмен при желании сократить какую-либо мышцу активизирует соответствующий двигательный нейрон в коре головного мозга, который посылает импульсы в спинной мозг к мотонейронному пулу, обслуживающему данную мышцу. Поскольку в мотонейронном пуле размеры мотонейронов различаются, то при низкой частоте импульсации из ЦНС могут активироваться только низкопороговые мотонейроны. Каждый мотонейрон иннервирует свои мышечные волокна. Поэтому активация мотонейрона приводит к рекрутированию или возбуждению соответствующих мышечных волокон. Каждое активное мышечное волокно под влиянием электрических импульсов выпускает из СПР ионы кальция, которые снимают ингибитор с активных центров актина. Это обеспечивает образование актин-миозиновых мостиков и начало их поворота и мышечного сокращения. На поворот мостиков и отсоединение актина от миозина тратится энергия одной молекулы АТФ. Продолжительность работы мостика составляет 1 мс. Вероятность образования мостиков зависит от взаимного расположения между собой нитей актина и миозина, отсюда возникает зависимость сила — длина активной мышца, а также от скорости взаимного перемещения (скольжения) их одной по отношению к другой, соответственно, имеем зависимость «сила-скорость».
Зависимость «сила — длина активного мышечного волокна» определяется, как правило, относительным расположением между собой головок миозина и активных центров актина. Максимальное количество мостиков возникает при некоторой средней длине мышцы. Отклонение от этой длины в большую или меньшую сторону ведет к снижению силовых проявлений мышечного волокна (мышцы). Однако, в случае растяжения некоторых мышц, еще не в активном состоянии, могут возникать значительные силы сопротивления растяжению, например, в мышцах сгибателях голеностопного или лучезапястного сустава. Эти силы связаны с растяжением соединительных тканей, например, перемезиума. В биомеханике в таком случае говорят о параллельном упругом компоненте мышцы. Упругостью обладают сухожилия, зет-пластинки саркомеров и нити миозина, к которым прикреплены головки. Такую упругость называют последовательной упругой компонентой.
Растягивание активной мышцы приводит не только к накоплению энергии упругой деформации в последовательной упругой компоненте, но и к прекращению работы мостиков, а именно, они перестают отцепляться за счет энергии молекул АТФ. Разрыв мостиков происходит благодаря действию внешней — механической силы. В итоге отрицательная работа мышц выполняется с очень высоким коэффициентов полезного действия, с минимальными затратами АТФ, а значит и кислорода.
Механизм мышечного сокращения
Содержание
Нервно-мышечная реакция на силовую тренировку [ править | править код ]
Источник: «Программы тренировок», научное изд.
Автор: профессор, доктор наук Тудор Бомпа, 2016 г.
Структура мышц [ править | править код ]
Помимо этого, способность мышцы сокращаться и прилагать силу зависит конкретно от ее вида, площади поперечного сечения, а также длины и количества волокон внутри мышцы. Число волокон определяется генетикой, и на него невозможно повлиять с помощью тренировок; однако тренировки в состоянии изменить другие переменные. Например, число и толщина миозиновых нитей увеличивается посредством упорных тренировок с максимальной силовой нагрузкой. Увеличение толщины мышечных нитей увеличивает размер мышцы и силу сокращений.
Разные двигательные единицы реагируют на разные нагрузки при тренировках. Например, выполнение жима лежа с 60% повторного максимума задействует определенную совокупность двигательных единиц, тогда как более крупные двигательные единицы ожидают более высокой нагрузки. Поскольку последовательное задействование двигательных единиц зависит от нагрузки, необходимо разрабатывать специальные программы, чтобы активизировать и адаптировать основные группы двигательных единиц и мышечных волокон, играющих доминирующую роль в избранном виде спорта. К примеру, в тренировках для спринта на короткую дистанцию и легкоатлетических дисциплин (таких как толкание ядра) следует использовать тяжелые нагрузки, чтобы способствовать развитию силы, необходимой для оптимизации скорости и взрывных действий.
Мышечные волокна выполняют разные биохимические (метаболические) функции; выражаясь конкретнее, одни лучше приспособлены с физиологической точки зрения к работе в анаэробных условиях, а другие лучше работают в аэробных условиях. Волокна, которые используют кислород для выработки энергии, называются аэробными, тип I, красными или медленными. Волокна, которым кислород не требуется, называются анаэробными, тип II, белыми или быстрыми. Быстрые мышечные волокна, в свою очередь, делятся на подтипы IIА и IIХ (иногда называемые IIВ, хотя у людей тип IIВ практически не встречается [1] ).
Медленные и быстрые волокна существуют примерно в равной пропорции. Однако в зависимости от их функций, в некоторых группах мышц (например, подколенные сухожилия, бицепсы) содержится больше быстрых волокон, тогда как в других (например, в камбаловидной мышце) содержится больше медленных волокон. В таблице 2.1 мы сравниваем характеристики быстрых и медленных волокон.
Сравнение быстрых и медленных волокон
Красные, тип I, аэробные
Белые, тип II, анаэробные
• Развивают долгие, продолжительные сокращения
• Применяются для развития выносливости
• Активизируются во время низко- и высокоинтенсивной деятельности
от 300 до 500 (или более) мышечных волокон
• Развивают короткие, сильные сокращения
• Применяются для развития скорости и силы
• Активизируются только во время высокоинтенсивной деятельности
Сокращение быстрой двигательной единицы более быстрое и мощное, чем сокращение медленной двигательной единицы. В результате пропорция быстрых волокон, как правило, выше в организме успешных спортсменов, занимающихся скоростно-силовыми видами спорта, но они также быстрее утомляются. Спортсмены с более высоким скоплением медленных волокон, напротив, обычно преуспевают в видах спорта на выносливость, поскольку они могут выполнять нагрузки низкой интенсивности в течение более продолжительного времени.
В распределении типов мышечных волокон у спортсменов, занимающихся разными видами спорта, могут наблюдаться различия. Это иллюстрируют рис. 2 и 2.3, представляющие общий процент содержания быстрых и медленных мышечных волокон у спортсменов в избранных видах спорта. Например, существенная разница между спринтерами и марафонцами четко дает понять, что успех в некоторых видах спорта хотя бы частично определяется генетическим составом мышечных волокон спортсмена.
Механизм мышечных сокращений [ править | править код ]
Первичные мышцы в первую очередь отвечают за суставное действие, которое является частью объемного силового движения или технической способности. Например, во время флексии локтя (сгибание бицепса) первичной мышцей является двуглавая мышца, тогда как трехглавая мышца (трицепс) выступает в роли антагониста и должна быть расслаблена, чтобы обеспечить беспрепятственное действие. В дополнение к этому стабилизаторы, или фиксаторы (обычно это меньшие мышцы), сокращаются изометрически, чтобы закрепить кость так, чтобы у первичных мышц была прочная база, откуда начинать натяжение. Мышцы других конечностей также могут принимать в этом участие, выступая в роли стабилизаторов, позволяющих первичным мышцам выполнять необходимые движения. Например, когда дзюдоист тянет соперника на себя, удерживая его за дзюдоги, мышцы его спины, ног и живота сокращаются изометрически, чтобы обеспечить стабильное основание для действия локтевых сгибателей (бицепсов), плечевых разгибателей (задние дельты) и лопаточных аддукторов и депрессоров (трапециевидная мышца и широчайшая мышца спины).
Механика мышечных сокращений [ править | править код ]
Если мышцу стимулировать коротким электрическим импульсом, спустя небольшой латентный период происходит ее сокращение. Такое сокращение называется «одиночное сокращение мышцы». Одиночное мышечное сокращение длится около 10-50 мс, причем оно достигает максимальной силы через 5-30 мс.
Каждое отдельное мышечное волокно подчиняется закону «все или ничего», т. е. при силе раздражения выше порогового уровня происходит полное сокращение с максимальной для данного волокна силой, а ступенчатое повышение силы сокращения по мере увеличения силы раздражения невозможно. Поскольку смешанная мышца состоит из множества волокон с различным уровнем чувствительности к возбуждению, сокращение всей мышцы может быть ступенчатым в зависимости от силы раздражения, при этом при сильных раздражениях происходит активация глубжележащих мышечных волокон.
Механизм скольжения филаментов [ править | править код ]
Укорочение мышцы происходит за счет укорочения образующих ее саркомеров, которые, в свою очередь, укорачиваются за счет скольжения относительно друг друга актиновых и миозиновых филаментов (а не укорочения самих белков). Теория скольжения филаментов была предложена учеными Huxley и Hanson (Huxley, 1974; рис. 1). (В 1954 г. две группы исследователей — X. Хаксли с Дж. Хэнсон и А. Хаксли с Р. Нидергерке — сформулировали теорию, объясняющую мышечное сокращение скольжением нитей. Независимо друг от друга они обнаружили, что длина диска А оставалась постоянной в расслабленном и укороченном саркомере. Это позволило предположить, что есть два набора нитей — актиновые и миозиновые, причем одни входят в промежутки между другими, и при изменении длины саркомера эти нити каким-то образом скользят друг по другу. Сейчас эта гипотеза принята почти всеми.)
Актин и миозин — два сократительных белка, которые способны вступать в химическое взаимодействие, приводящее к изменению их взаимного расположения в мышечной клетке. При этом цепочка миозина прикрепляется к актиновой нити с помощью целого ряда особых «головок», каждая из которых сидит на длинной пружинистой «шее». Когда происходит сцепление между миозиновой головкой и актиновой нитью, конформация комплекса этих двух белков изменяется, миозиновые цепочки продвигаются между актиновыми нитями и мышца в целом укорачивается (сокращается). Однако, чтобы химическая связь между головкой миозина и активной нитью образовалась, необходимо подготовить этот процесс, поскольку в спокойном (расслабленном) состоянии мышцы активные зоны белка актина заняты другим белком — тропохмиозином, который не позволяет актину вступить во взаимодействие с миозином. Именно для того, чтобы убрать тропомиозиновый «чехол» с актиновой нити, требуется быстрое выливание ионов кальция из цистерн саркоплазматического ретикулума, что происходит в результате прохождения через мембрану мышечной клетки потенциала действия. Кальций изменяет конформацию молекулы тропомиозина, в результате чего активные зоны молекулы актина открываются для присоединения головок миозина. Само это присоединение осуществляется с помощью так называемых водородных мостиков, которые очень прочно связывают две белковые молекулы — актин и миозин — и способны в таком связанном виде находиться очень долго.
Для отсоединения миозиновой головки от актина необходимо затратить энергию аденозинтрифосфа-та (АТФ), при этом миозин выступает в роли АТФазы (фермента, расщепляющего АТФ). Расщепление АТФ на аденозиндифосфат (АДФ) и неорганический фосфат (Ф) высвобождает энергию, разрушает связь между актином и миозином и возвращает головку миозина в исходное положение. В дальнейшем между актином и миозином могут снова образовываться поперечные связи.
При отсутствии АТФ актин-миозиновые связи не разрушаются. Это и является причиной трупного окоченения (rigor mortis) после смерти, т. к. останавливается выработка АТФ в организме — АТФ предотвращает мышечную ригидность.
Даже при мышечных сокращениях без видимого укорочения (изометрические сокращения, см. выше) активируется цикл формирования поперечных связей, мышца потребляет АТФ и выделяет тепло. Головка миозина многократно присоединяется на одно и то же место связывания актина, и вся система миофиламентов остается неподвижной.
Внимание: Сократительные элементы мышц актин и миозин сами по себе не способны к укорочению. Мышечное укорочение является следствием взаимного скольжения миофиламентов относительно друг друга (механизм скольжения филаментов).
Как же образование поперечных связей (водородных мостиков) переходит в движение? Одиночный саркомер за один цикл укорачивается приблизительно на 5-10 нм, т.е. примерно на 1 % своей общей длины. За счет быстрого повторения цикла поперечных связей возможно укорочение на 0,4 мкм, или 20% своей длины. Поскольку каждая миофибрилла состоит из множества саркомеров и во всех них одновременно (но не синхронно) образуются поперечные связи, суммарно их работа приводит к видимому укорочению всей мышцы. Передача силы этого укорочения происходит через Z-линии миофибрилл, а также концы сухожилий, прикрепленных к костям, в результате чего и возникает движение в суставах, через которые мышцы реализуют перемещение в пространстве частей тела или продвижение всего тела.
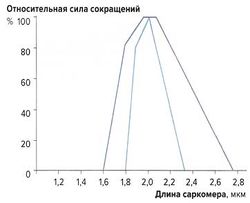
Связь между длиной саркомера и силой мышечных сокращений [ править | править код ]
Наибольшую силу сокращений мышечные волокна развивают при длине 2-2,2 мкм. При сильном растяжении или укорочении саркомеров сила сокращений снижается (рис. 2). Эту зависимость можно объяснить механизмом скольжения филаментов: при указанной длине саркомеров наложение миозиновых и актиновых волокон оптимально; при большем укорочении миофиламенты перекрываются слишком сильно, а при растяжении наложение миофиламентов недостаточно для развития достаточной силы сокращений.
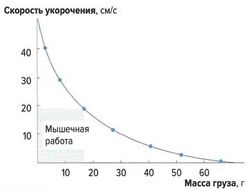
Скорость укорочения мышечных волокон [ править | править код ]
Скорость укорочения мышцы зависит от нагрузки на эту мышцу (закон Хилла, рис. 3). Она максимальна без нагрузки, а при максимальной нагрузке практически равна нулю, что соответствует изометрическому сокращению, при котором мышца развивает силу, не изменяя своей длины.
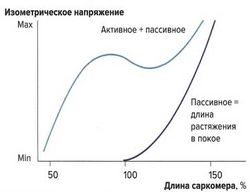
Влияние растяжения на силу сокращений: кривая растяжения в покое [ править | править код ]
Важным фактором, влияющим на силу сокращений, является величина растяжения мышцы. Тяга за конец мышцы и натяжение мышечных волокон называются пассивным растяжением. Мышца обладает эластическими свойствами, однако в отличие от стальной пружины зависимость напряжения от растяжения не линейна, а образует дугообразную кривую. С увеличением растяжения повышается и напряжение мышцы, но до определенного максимума. Кривая, описывающая эти взаимоотношения, называется кривой растяжения в покое.
Данный физиологический механизм объясняется эластическими элементами мышцы — эластичностью сарколеммы и соединительной ткани, располагающимися параллельно сократительным мышечным волокнам.
Также при растяжении изменяется и наложение друг на друга миофиламентов, однако это не оказывает влияния на кривую растяжения, т. к. в покое не образуются поперечные связи между актином и миозином. Предварительное растяжение (пассивное растяжение) суммируется с силой изометрических сокращений (активная сила сокращений).
Что изучает механизм сокращения мышц
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
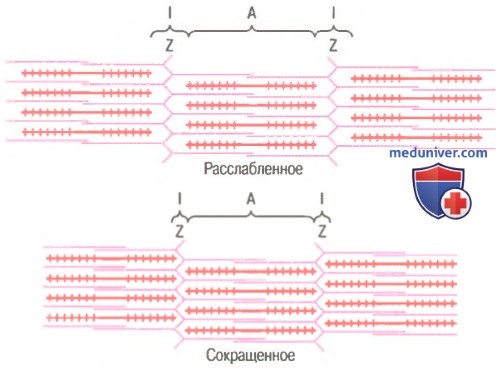
Молекулярные механизмы мышечного сокращения
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
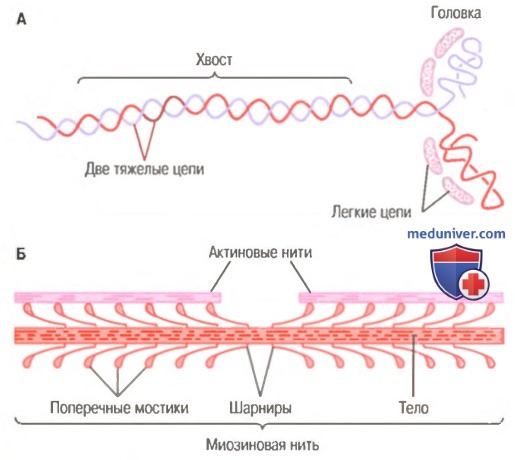
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
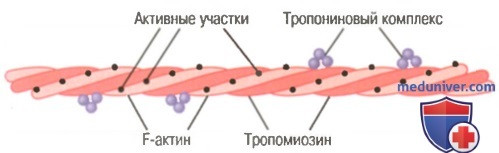
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»