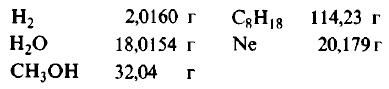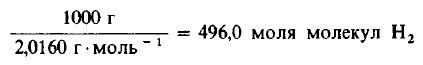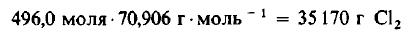Что измеряется в молях физика
Молекулярная физика. Моль. Постоянная Авогадро. Количество вещества.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12 С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NA:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в 1 моле вещества:

Количество вещества. Моль. Молярная Масса. Формула
Количество вещества применяться для измерения макроскопических количеств веществ во многих естественных науках таких как, физика, химия, при изучении электролиза, в термодинамика, описывающая состояние идеального газа. Так как молекулы взаимодействуют независимо от их массы в количествах, кратным целым числам, то при описании химических реакций, использовать количества вещества удобнее, чем массу. Для того, чтобы понять, что такое количества вещества в химии, отметим, что у величины есть своя единица измерения.
Определение, единицы измерения, обозначение
Число аналогичных структурных единиц, содержащих в веществе (атомов, электронов, молекул, ионов и других частиц) и есть физическая величина — количество вещества. По международной системе единиц (СИ) измеряется количество вещества в [моль], [кмоль], [ммоль], при использовании в расчетах, обозначается как n (эн).
Применение, значение
В химии при написании химических уравнений, после знакомства законом постоянства массы веществ, становится понятно как использовать величину количества вещества и понятно ее значение. Например, в реакции горения водорода, его требуется 2 к 1 значению кислорода. Зная массу водорода, можно получить количества вещества кислорода, участвующего в реакции горения.
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса, т.е отношение массы вещества к количеству к количеству молей этого вещества:
где m — масса вещества, M — молярная масса вещества.
Молярная масса измерятся в [ г/моль].
Также молярная масса может быть найдена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро.
Количество вещества газообразного определяют на основе его объема:
где где V — объём газа при нормальных условиях, а Vm — молярный объем газа при тех же условиях, равный 22,4 л/моль по закону Авогадро.
Подводя итоги всех расчетов, можно вывести общую формулу для количества вещества:
Вычисления
Чтобы точнее понять, что такое количество вещества, решим простейшие задачи: какое количество вещества содержится в алюминиевой отливке, массой m = 5,4 кг?
При решении это задачи следует помнить, что молярная масса численно равна относительной молекулярной массе, для нахождения которой понадобится таблица Менделеева, округляя значения: μ = 2,7 ⋅ 10-2 кг/моль.
Таким образом, количество вещества находим путем простых вычислений:
n = m/μ = 5,4 кг/ 2,7 ⋅ 10-2 кг/моль = 2⋅ 10-2 моль.
В физике также используется данная величина. Она нужна в молекулярной физике, где проводятся вычисления давления, объема газообразных веществ по уравнению Менделеева-Клапейрона:
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
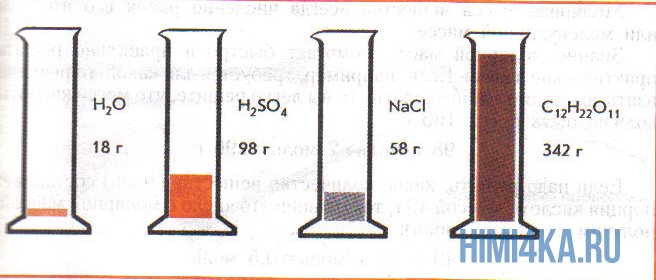
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Моль (единица)
Моль (обозначение — моль, mol) — единица измерения количества вещества. Соответствует количеству вещества, содержащему столько специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц), сколько содержится атомов в 12 граммах нуклида углерода 12 C.
Количество частиц в одном моле любого вещества постоянно и носит название числа Авогадро (NA).
Кратные и дольные единицы
Десятичные кратные и дольные единицы образуют с помощью стандартных приставок СИ.
| Кратные | Дольные | ||||||
|---|---|---|---|---|---|---|---|
| величина | название | обозначение | величина | название | обозначение | ||
| 10 1 моль | декамоль | дамоль | damol | 10 −1 моль | децимоль | дмоль | dmol |
| 10 2 моль | гектомоль | гмоль | hmol | 10 −2 моль | сантимоль | смоль | cmol |
| 10 3 моль | киломоль | кмоль | kmol | 10 −3 моль | миллимоль | ммоль | mmol |
| 10 6 моль | мегамоль | Ммоль | Mmol | 10 −6 моль | микромоль | мкмоль | µmol |
| 10 9 моль | гигамоль | Гмоль | Gmol | 10 −9 моль | наномоль | нмоль | nmol |
| 10 12 моль | терамоль | Тмоль | Tmol | 10 −12 моль | пикомоль | пмоль | pmol |
| 10 15 моль | петамоль | Пмоль | Pmol | 10 −15 моль | фемтомоль | фмоль | fmol |
| 10 18 моль | эксамоль | Эмоль | Emol | 10 −18 моль | аттомоль | амоль | amol |
| 10 21 моль | зеттамоль | Змоль | Zmol | 10 −21 моль | зептомоль | змоль | zmol |
| 10 24 моль | йоттамоль | Имоль | Ymol | 10 −24 моль | йоктомоль | имоль | ymol |
| применять не рекомендуется | |||||||
Примечание: единица измерения йоктомоль может использоваться лишь формально, так как столь малые количества вещества должны измеряться отдельными частицами (1 имоль формально равен 0,602 частицы).
| Единицы СИ |
|---|
| Основные: метр | килограмм | секунда | ампер | кельвин | кандела | моль |
| Производные: радиан | стерадиан | герц | градус Цельсия | катал | ньютон | джоуль | ватт | паскаль | кулон | вольт | ом | сименс | фарад | вебер | тесла | генри | люмен | люкс | беккерель | грэй | зиверт |
Полезное
Смотреть что такое «Моль (единица)» в других словарях:
Моль (единица кол-ва вещ-ва) — Моль, единица количества вещества, т. е. величины, оцениваемой количеством содержащихся в физической системе тождественных структурных элементов (атомов, молекул, ионов и других частиц или их специфических групп). М. равен количеству вещества… … Большая советская энциклопедия
Моль (единица кол-ва вещ-ва) — Эта статья посвящена единице измерения. См. также: насекомые моли. Моль (обозначение моль, mol) единица измерения количества вещества. Соответствует количеству вещества, содержащему столько специфицированных структурных единиц (атомов, молекул,… … Википедия
моль — 1. МОЛЬ, и; ж. Небольшая бабочка, гусеница которой является вредителем шерстяных вещей, хлебных зёрен и растений. 2. МОЛЬ, и; ж.; МОЛЬ, я; м. Спец. Лес, сплавляемый по реке брёвнами, не связанными в плот. По реке плыла м. Пробираться на лодке… … Энциклопедический словарь
Моль (значения) — Моль многозначное слово: Моль единица измерения количества вещества, Моль представитель молей (под названием «моли» объединяют в нетаксономическую группу мелких насекомых из отряда чешуекрылых). Населённые пункты Моль … … Википедия
МОЛЬ — единица количества вещества в СИ, определяемая как количество вещества, содержащее столько же формульных (структурных) единиц этого вещества (атомов, молекул, ионов, электронов и др.), сколько содержится атомов в 12 г изотопа углерода 12 (12С);… … Большая политехническая энциклопедия
МОЛЬ — • МОЛЬ (Mohl) Хуго фон (1805 1872), немецкий ботаник, пионер в исследовании анатомии и физиологии КЛЕТОК растений. Сформулировал гипотезу о том, что ядро клетки окружено гранулированным коллоидным веществом, которое в 1846 г. он назвал… … Научно-технический энциклопедический словарь
МОЛЬ — МОЛЬ, единица количества вещества в СИ. Обозначение моль. В 1 моле содержится столько молекул (атомов, ионов или каких либо других структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода с атомной массой 12). число… … Современная энциклопедия
МОЛЬ — единица количества вещества СИ, обозначается моль. В 1 моле содержится столько молекул (атомов, ионов или каких либо др. структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода с атомной массой 12), т. е. 6,022.1023… … Большой Энциклопедический словарь
Моль — МОЛЬ, единица количества вещества в СИ. Обозначение моль. В 1 моле содержится столько молекул (атомов, ионов или каких либо других структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода с атомной массой 12). Число… … Иллюстрированный энциклопедический словарь
Моль — Эта статья посвящена единице измерения. У слова «Моль» есть и другие значения: см. Моль (значения). Моль (русское обозначение: моль; международное: mol) единица измерения количества вещества в Международной системе единиц (СИ), одна из семи … Википедия
Физика. 10 класс
§ 2. Масса и размеры молекул. Количество вещества
В 1,0 см 3 любого газа, находящегося при нормальных условиях (температура t0 = 0,0 °С, давление р0 = 1,0 · 10 5 Па), содержится 2,7 · 10 19 молекул. Чтобы представить, насколько велико это число, предположим, что из отверстия в ампуле вместимостью V = 1,0 см 3 ежесекундно вылетает 100 молекул. Тогда, для того чтобы все молекулы вылетели из ампулы, потребуется 8,6 млрд лет, т. е. промежуток времени, сравнимый с возрастом Вселенной (12–15 млрд лет). Такое огромное число молекул в веществе свидетельствует о том, что их размеры очень малы. Каковы же размеры и масса частиц вещества? Как определить число атомов в любом макроскопическом теле?
Молекулярно-кинетическая теория предоставляет возможность оценить массу и размеры частиц, образующих макроскопические тела. Молекулы, как и атомы, не имеют чётких границ. Если представить молекулу в виде шарика, то её радиус имеет значение от 0,1 нм у простейших до 100 нм у сложных молекул, состоящих из нескольких тысяч атомов. Например, оценочный диаметр молекулы водорода составляет 0,2 нм, а диаметр молекулы воды — 0,3 нм. При таких размерах число частиц в веществе очень велико. Например, в одном грамме воды содержится 3,3 · 10 22 молекул.
Размеры и масса молекулы возрастают с увеличением числа атомов, которые входят в её состав. Атомы и молекулы (кроме многоатомных молекул органических веществ) имеют массу порядка 10 –26 кг. Из-за малых значений выражать массы атомов и молекул в килограммах (кг) неудобно. Поэтому для измерения масс атомов и молекул в химии и физике используют атомную единицу массы (а. е. м.). Атомную единицу массы выражают через массу изотопа углерода :
Массу молекулы (или атома), выраженную в атомных единицах массы, называют относительной молекулярной массой Mr (или относительной атомной массой Ar). Относительная молекулярная (или атомная) масса Mr показывает, во сколько раз масса m0 молекулы (или атома) больше атомной единицы массы:
В периодической системе химических элементов Д. И. Менделеева (см. форзац 2) возле символов элементов указаны и их относительные атомные массы. В большинстве случаев при проведении расчётов значение относительной атомной массы округляют до целого числа, используя правила приближённых вычислений. Так, например, относительная атомная масса водорода равна 1, кислорода — 16, азота — 14.
Количество вещества, содержащегося в макроскопическом теле, определяют числом частиц в нём. Приведённые выше примеры показывают, насколько велико это число. Поэтому при расчётах принято использовать не абсолютное число частиц вещества, а относительное:
т. е. количество вещества ν определяют отношением числа частиц N этого вещества к постоянной Авогадро NA.
В молекулярно-кинетической теории наряду с относительной молекулярной (или атомной) массой используют м олярную массу M — массу вещества, взятого в количестве ν = 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству ν:
Молярную массу вещества также можно вычислить по формуле
1. Во сколько раз число молекул водорода, взятого в количестве νв = 8 моль, больше числа молекул азота, количество вещества которого νа = 4 моль?
| Формула | Физические величины, входящие в формулу | Единицы физических величин |
| ν — количество вещества N — число частиц вещества NA — постоянная Авогадро | моль — моль –1 | |
| М — молярная масса | ||
| m — масса вещества m0 — масса молекулы вещества | кг кг | |
| NA = 6,022·10 23 моль –1 |
1. В каких единицах измеряют массы атомов и молекул?
2. Что такое количество вещества? Назовите единицу этой физической величины.
3. Что такое постоянная Авогадро?
4. Что называют молярной массой вещества?