Что измеряется в литрах в химии
Молярный объем

Всего получено оценок: 194.
Всего получено оценок: 194.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
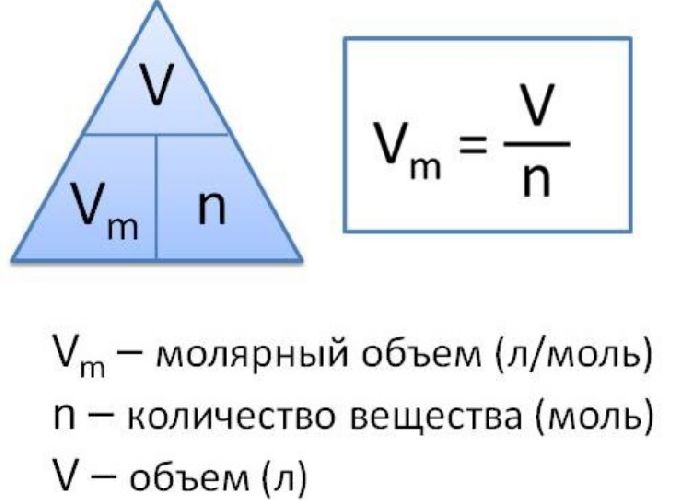
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Определение молярного объема при химических реакциях
Молярный объем — что это такое в химии
Молярный объем V m — является отношением объема вещества к его количеству, численно равен объему одного моля вещества.
Термин «молярный объем» применим по отношению к простым веществам, химическим соединениям и смесям. Величина зависит от следующих факторов:
Молярный объем вычисляют по формуле:
Молярный объем является характеристикой плотности упаковки молекул в рассматриваемом веществе. В случае простых веществ в некоторых ситуациях допустимо использовать понятие атомного объема.
Исходя из того, что объем газа определяется температурой и давлением, в процессе расчетов принято использовать объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимают:
Молярный объем какого-либо газа при нормальных условиях:
Молярный объем смеси
Молярный объем смеси:
Молярный объем газов
Закон Авогадро: одинаковые количества газов при одинаковых условиях занимают одинаковый объем.
Молярный объем идеального газа вычисляют с помощью формулы, которая является выводом из уравнения состояния идеального газа.
Молярный объем идеального газа:
где T — является термодинамической температурой;
R — универсальная газовая постоянная.
Молярный объем кристаллов
Объем V я элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Значения молярного объема химических элементов
Вычисление химического количества газа по его объему
Объем газа можно рассчитать по его химическому количеству. В этом случае необходимо преобразовать формулу молярного объема путем выражения из нее V :
Таким образом, объем газа равен произведению его химического количества на молярный объем. Продемонстрировать данное утверждение можно на примере. Допустим, что необходимо определить объем (н. у.) метана с химическим количеством 1,5 моль. Используя уравнение, записанное ранее, проведем вычисления:
При известном объеме газообразного вещества можно определить химическое количество рассматриваемого газа. В этом случае следует выразить из уравнения молярного объема n:
Определение объема веществ при химических реакциях
Перед тем, как приступить к расчетам объема веществ, следует ввести понятие плотности. Данный показатель определяется отношением массы вещества к его объему. Плотность измеряют в к г / м 3 (или г/л, г/мл). В случае газообразных веществ плотность принимает очень маленькие значения. Упростить расчеты химических реакций можно, если рассматривать отношение плотностей газов.
Относительной плотностью газа В по газу А называют величину, равную отношению плотностей рассматриваемых веществ или отношению молярных масс этих газов.
Данный параметр обозначают D A ( B ) и определяют по формуле:
В связи с тем, что в расчете относительной плотности используют величины одинаковой размерности, данный параметр является безразмерной величиной. Определить относительную плотность газообразных веществ по некому газу можно с помощью отношения молярных масс этих газов. Например, относительная плотность кислорода по водороду составляет:
Согласно закону Авогадро, в равных объемах различных газов, которые существуют при одинаковых температурах и давлениях, содержится одно и то же количество молекул. Данная гипотеза была представлена в 1811 году в Турине профессором физики Амедео Авогадро.
Подтверждение теория нашла во множестве экспериментальных опытах. Закон получил название закона Авогадро и стал в дальнейшем количественной основой современной химии. Закон Авогадро в точности реализуем в случае идеального газа. С увеличением разреженности газообразного вещества повышается точность расчетов по этому закону применительно к данному реальному газу.
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых условиях занимает одинаковый объем.
Исходя из закона Авогадро, одинаковое число молекул какого-либо газа занимает при одинаковых условиях один и тот же объем. Наряду с тем, 1 моль какого-то вещества включает в себя (согласно определению) одинаковое количество частиц (к примеру, молекул). Таким образом, при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Если условия соответствуют нормальным, то есть температура равна 0 °C (273,15 К), и давление составляет 101,325 кПа, объем 1 моль газа соответствует 22,413 962(13) л. Данная физическая константа является молярным объемом идеального газа и обозначается Vm.
Вычислить молярный объем при температуре и давлении, отличных от нормальных условий, можно с помощью уравнения Клапейрона:
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Как найти объемные отношения газов в смеси
В процессе вычисления объемных отношений газов, участвующих в химических реакциях, используют закон Гей-Люссака (химический закон объемных отношений). В англоязычной литературе данный закон можно встретить под названием закона Шарля.
Закон Гей-Люссака — закон, демонстрирующий пропорциональную зависимость между объемом газообразного вещества и абсолютной температурой при постоянном давлении (то есть в изобарном процессе).
Закон получил название в честь французского физика и химика Жозефа Луи Гей-Люссака.
Математическое выражение закона Гей-Люссака:
В том случае, когда известно состояние газа при постоянном давлении и двух разных температурах, закон допустимо записывать таким образом:
По итогам химических реакций атомы не исчезают и не возникают. В результате таких процессов происходит их перегруппировка. Количество атомов до реакции и после ее протекания не меняется, что отличает их от молекул. Данное условие учитывают, расставляя стехиометрические коэффициенты в уравнениях химических реакций.
Коэффициенты в уравнениях реакций демонстрируют числа объемов газов, которые реагируют и образовываются. К примеру, 2 объема водорода и 1 объем кислорода дают 2 объема пара воды:
2 H 2 + O 2 = 2 H 2 O
V ( Н 2 ) : V ( N 2 ) : V ( N H 3 ) = 3 : 2 : 1
С другой стороны, данные соотношения справедливы лишь в случае веществ, которые участвуют в одной и той же химической реакции. Когда реагент принимает участие в двух параллельных реакциях, его химические количества в данных процессах не связаны и могут принимать любые значения.
n — количество газа.
Выразить молярный объем газов можно в л/моль:
В данной таблице использованы следующие обозначения:
Что измеряется в литрах в химии
Что такое литр?
Оригинальная французская метрическая система использовала литр в качестве базовой единицы. Слово «литр» происходит от более старой французской единицы «литрон» (фр. litron), название которой пришло через латынь из греческого, где она была единицей веса, а не объема, и была равна приблизительно 0,831 литров. Литр также был использован в нескольких последующих версиях метрической системы и принят к использованию СИ, хотя и не является официальной единицей СИ, т.к. единицей СИ для объема является кубический метр (м 3). Международное бюро мер и веса использует написание «litre», которое разделяют почти все англоязычные страны. Реже используется написание «liter», и преимущественно в американском варианте английского языка.
Один литр жидкой воды имеет массу почти ровно один килограмм, потому что килограмм был первоначально определен в 1795 году как один кубический дециметр воды при температуре таяния льда. Последующие переопределения метра и килограмма означают, что эти соотношения уже не точны.
Величина литра
Литр определяется как специальное обозначение кубического дециметра или 10 см × 10 см × 10 см, (1 л ≡ 1 дм3 ≡ 1000 см3). Следовательно, 1 л ≡ 0,001 м3 ≡ 1000 см3, а 1 м3 (т.е. кубический метр, который является единицей СИ для объема) составляет ровно 1000 л.
С 1901 по 1964 г. литр был определен как объем одного килограмма чистой воды при максимальной плотности и нормальном давлении. Килограмм, в свою очередь, был указан в качестве массы цилиндра из платино-иридиевого сплава и принят в Севре во Франции, но предназначался для обозначения той же массы, что и вышеописанный 1 л воды. Впоследствии было обнаружено, что масса цилиндра была на 0,028 г больше массы 1 дм³ воды, и, таким образом, в течение этого времени, литр составлял около 1,000028 дм3. Кроме того, массовое соотношение объема воды (как с любой жидкостью) зависит от температуры, давления, чистоты и изотопной однородности. В 1964 году определение, связывающее литр с массой было оставлено в пользу нынешнего. Несмотря на то, что литр не является официальной единицей СИ, он принят ГКМВ (организация, которая стандартизирует определения СИ) для использования СИ. ГКМВ определяет литр и его допустимые символы.
Что измеряется в литрах
Литры наиболее часто используются для веществ (например, жидкостей и твердых веществ, которые можно переливать), которые измеряются по емкости или размеру своего сосуда, в то время как кубические метры (и производные единицы) наиболее часто используются для веществ, измеряемых либо по их размерам, либо по их водоизмещению. Литр также часто используется в некоторых вычисляемых мерах, таких как плотность (кг/л), что позволяет легкое сравнение с плотностью воды.
Один литр воды при температуре ее наибольшей плотности, которая наблюдается при температуре около 4°C, имеет массу почти один килограмм. Аналогичным образом: 1 миллилитр воды имеет массу около 1 г; 1000 литров воды имеет массу около 1000 кг (1 тонну). Это соотношение имеет место потому, что грамм первоначально был определен как масса 1 мл воды; Тем не менее, от этого определения отказались в 1799 году, потому что плотность воды изменяется в зависимости от температуры и очень незначительно от давления.
В настоящее время известно, что плотность воды также зависит от изотопных соотношений атомов кислорода и водорода в конкретном образце. Современные измерения Венского стандарта океанской воды, которым является чистая дистиллированная вода с изотопным составом образца усредненной природной воды, показывают, что он имеет плотность 6999999975000000000 ♠ 0,999975 ± 6994100000000000000 ♠ 0,000001 кг/л в точке его максимальной плотности (3,984 °С) при стандартных атмосферных условиях (760 мм рт.ст., 101,325 кПа).
Литр как единица измерения
Не смотря на то, что литр не является официальной единицей СИ, он может быть использован с приставками СИ. Чаще всего используемой производной единицей является миллилитр, который определяется как одна тысячная литра, а также часто его называют «кубический сантиметр», в соответствии с названием производной единицы СИ. Это общепринятая используемая мера, особенно в медицине и кулинарии. Другие единицы могут быть найдены в таблице ниже, где часто используемые термины выделены жирным шрифтом. Тем не менее, некоторые представители власти рекомендуют применение некоторых из них; например, в Соединенных Штатах Америки НИСТ пропагандирует использование миллилитра или литра вместо сантилитра.
