Как выводят человека из медикаментозного сна
Всё, что нужно знать о седации и наркозе
О том, что такое седация и что пациенту нужно о ней знать, мы поговорили со специалистами Клиники «Элита Центр».
Один из самых устойчивых страхов из детства – это страх стоматолога. Большинство учатся преодолевать свой страх и, несмотря на волнение, проходят лечение. Но есть люди, для которых лечение зубов – это настоящий кошмар! Иррациональный страх человека с дентофобией не принимает никаких доводов, что современная стоматология безболезненна и анестезия работает практически безупречно. Это приводит к серьезным проблемам в полости рта, требуется большой объем работ — лечение и протезирование обеих челюстей (частичная имплантация, удаление, лечение каналов).
Чтобы избежать таких проблем или помочь в уже запущенном случае, для пациентов предлагается лечение зубов под седацией.
Лечение зубов с применением седации называют по-разному: лечение по программе «антистресс», лечение «во сне», лечение без страха. Несмотря на то, что седация уже более 10 лет применяется в российской стоматологии, знают о ней немногие. В Европе под седацией проводится почти 60% стоматологических процедур и с каждым годом седация становится все популярнее. Европейские тенденции развиваются так же очень быстро и в Москве. На сегодняшний день почти 20% столичных пациентов лечат зубы именно под седацией. И хотя данная услуга представлена на Омском рынке – она пока не получила такого широкого распространения. И наша задача — донести до пациентов информацию о возможностях, которыми они могут воспользоваться.
Итак, седация или лечение зубов во сне (от лат. sedatio — успокаивать) — технология, сочетающая комплекс мер, направленных на успокоение, физическое и эмоциональное расслабление пациента в ходе лечения.
Процедура седации в сочетании с местной анестезией – это безопасная альтернатива глубокому наркозу, так как существует ряд принципиальных, просто колоссальных отличий!
Во время лечения под седацией с пациентом работает целая команда опытных специалистов: врач-стоматолог, который непосредственно будет проводить лечение, медсестра и врач-анестезиолог, который в течение всего лечения будет следить за состоянием здоровья пациента.
Во время процедуры седации опытный врач-анестезиолог с помощью сертифицированных швейцарских и французских препаратов погружает пациента в медикаментозный поверхностный сон, при этом пациент подключается к специальному оборудованию, которое отслеживает и демонстрирует команде врачей насколько глубоко пациент спит.
Погружение «в сон» происходит в комфортных условия буквально за несколько минут и практически сразу пациента покидает чувство страха, волнения, он расслабляется и чувствует себя так же как во время сна. НО! Что очень важно и для врача и для пациента, во время лечения пациент остается контактным, слышит просьбы врача и может их выполнить – например, повернуть голову, открыть или закрыть рот и т.д.
При проведении седации используется анестезия, но уже после того как пациент погружен в медикаментозный сон. Т.е. все негативные впечатления от пребывания в кресле стоматолога: шум приборов, какой-то стук – все, что обычно пугает наших пациентов, здесь напрочь отсутствует!
При седации врач-анестезиолог постоянно контролирует жизненно важные показатели здоровья пациента – давление, сердце, активность мозга и всех жизненно важных органов отражаются на приборах. В любой момент врач-анестезиолог может вывести пациента из состояния седации без какого-либо ущерба для него или для процесса лечения.
Благодаря седации значительно изменяется восприятие пациентом времени: длительное трудное лечение субъективно воспринимается как очень кратковременное. 3-4 часа (а иногда и 6), проведенные в кресле, не вызывают дискомфорта. Пациент просыпается отдохнувшим, полным сил, в памяти не фиксируется процесс лечения, никаких болевых симптомов. Неприятных, мучивших ранее воспоминаний (боль, звук бор-машины) совершенно не остается! Это происходит потому, что седация вызывает состояние глубокого расслабления, при котором восприятие внешних раздражителей (свет, звук и пр.) сильно притупляется. Результат есть, а неприятных ощущений и воспоминаний – нет!
Кстати, после седации значительно лучше идет приживление, поскольку отсутствие напряжения во время лечения положительно сказывается на состоянии тканей.
Какие существуют показания к седации (в некоторых случаях седация просто настоятельно необходима – иначе лечение проводить даже опасно):
В определенных случаях, по показаниям, для проведения стоматологических процедур требуется применение общего наркоза. Необходимость общего наркоза чаще возникает у детей, реже у взрослых. При общем наркозе у пациента полностью выключено сознание и мышечная активность, дыхание обеспечивается аппаратом искусственной вентиляции легких.
Таким образом, единственным риском для пациента является найти Клинику, способную предоставить данную услугу на нужном высоком уровне.
Применение седации и наркоза в практике лечения зубов требует от стоматологической клиники выполнения строгих требований. Чтобы не ошибиться в выборе, обратите внимание на наличие в клинике следующих пунктов:
Специалисты клиники «Элита Центр» рассказывают, что данная процедура становится все более популярной среди их пациентов. Благодаря седации, клиенты преодолевают свои страхи и решаются на длительное необходимое лечение!
Как выводят человека из медикаментозного сна
Проблема поражения легких при вирусной инфекции, вызванной COVID-19 является вызовом для всего медицинского сообщества, и особенно для врачей анестезиологов-реаниматологов. Связано это с тем, что больные, нуждающиеся в реанимационной помощи, по поводу развивающейся дыхательной недостаточности обладают целым рядом специфических особенностей. Больные, поступающие в ОРИТ с тяжелой дыхательной недостаточностью, как правило, старше 65 лет, страдают сопутствующей соматической патологией (диабет, ишемическая болезнь сердца, цереброваскулярная болезнь, неврологическая патология, гипертоническая болезнь, онкологические заболевания, гематологические заболевания, хронические вирусные заболевания, нарушения в системе свертывания крови). Все эти факторы говорят о том, что больные поступающие в отделение реанимации по показаниям относятся к категории тяжелых или крайне тяжелых пациентов. Фактически такие пациенты имеют ОРДС от легкой степени тяжести до тяжелой.
В терапии классического ОРДС принято использовать ступенчатый подход к выбору респираторной терапии. Простая схема выглядит следующим образом: низкопоточная кислородотерапия – высокопоточная кислородотерапия или НИМВЛ – инвазивная ИВЛ. Выбор того или иного метода респираторной терапии основан на степени тяжести ОРДС. Существует много утвержденных шкал для оценки тяжести ОРДС. На наш взгляд в клинической практике можно считать удобной и применимой «Берлинскую дефиницую ОРДС».
Общемировая практика свидетельствует о крайне большом проценте летальных исходов связанных с вирусной инфекцией вызванной COVID-19 при использовании инвазивной ИВЛ (до 85-90%). На наш взгляд данный факт связан не с самим методом искусственной вентиляции легких, а с крайне тяжелым состоянием пациентов и особенностями течения заболевания COVID-19.
Тяжесть пациентов, которым проводится инвазивная ИВЛ обусловлена большим объемом поражения легочной ткани (как правило более 75%), а также возникающей суперинфекцией при проведении длительной искусственной вентиляции.
Собственный опыт показывает, что процесс репарации легочной ткани при COVID происходит к 10-14 дню заболевания. С этим связана необходимость длительной искусственной вентиляции легких. В анестезиологии-реаниматологии одним из критериев перевода на спонтанное дыхание и экстубации служит стойкое сохранение индекса оксигенации более 200 мм рт. ст. при условии, что используются невысокие значения ПДКВ (не более 5-6 см. вод. ст.), низкие значения поддерживающего инспираторного давления (не более 15 см. вод. ст.), сохраняются стабильные показатели податливости легочной ткани (статический комплайнс более 50 мл/мбар), имеется достаточное инспираторное усилие пациента ( p 0.1 более 2.)
Достижение адекватных параметров газообмена, легочной механики и адекватного спонтанного дыхания является сложной задачей, при условии ограниченной дыхательной поверхности легких.
При этом задача поддержания адекватных параметров вентиляции усугубляется присоединением вторичной бактериальной инфекции легких, что увеличивает объем поражения легочной ткани. Известно, что при проведении инвазинвой ИВЛ более 2 суток возникает крайне высокий риск возникновения нозокомиальной пневмонии. Кроме того, у больных с COVID и «цитокиновым штормом» применяются ингибиторы интерлейкина, которые являются выраженными иммунодепрессантами, что в несколько раз увеличивает риск возникновения вторичной бактериальной пневмонии.
В условиях субтотального или тотального поражения дыхательной поверхности легких процент успеха терапии дыхательной недостаточности является крайне низким.
Собственный опыт показывает, что выживаемость пациентов на инвазивной ИВЛ составляет 15.3 % на текущий момент времени.
Алгоритм безопасности и успешности ИВЛ включает:
В связи с тем, что процент выживаемости пациентов при использовании инвазивной ИВЛ остается крайне низким возрастает интерес к использованию неинвазивной искусственной вентиляции легких. Неинвазивную ИВЛ по современным представлениям целесообразно использовать при ОРДС легкой степени тяжести. В условиях пандемии и дефицита реанимационных коек процент пациентов с тяжелой формой ОРДС преобладает над легкой формой.
Тем не менее, в нашей клинической практике у 23% пациентов ОРИТ в качестве стартовой терапии ДН и ОРДС применялась неинвазивная масочная вентиляция (НИМВЛ). К применению НИМВЛ есть ряд ограничений: больной должен быть в ясном сознании, должен сотрудничать с персоналом. Допустимо использовать легкую седацию с целью обеспечения максимального комфорта пациента.
Критериями неэффективности НИМВЛ являются сохранение индекса оксигенации ниже 100 мм рт.ст., отсутствие герметичности дыхательного контура, возбуждение и дезориентация пациента, невозможность синхронизации пациента с респиратором, травмы головы и шеи, отсутствие сознания, отсутствие собственного дыхания. ЧДД более 35/мин.
В нашей практике успешность НИМВЛ составила 11.1 %. Зав. ОАИР: к.м.н. Груздев К.А.
Реаниматолог Госпиталя для ветеранов рассказал, что чувствуют люди в медикаментозном сне
Для чего в реанимации постоянно горит свет? Как кормят тех, кто оказался на инвазивной вентиляции легких? И есть ли в ОРИТ пациенты после вакцинации?
В Петербурге 6 сентября наградили медиков, проявивших самоотверженность при оказании помощи больным в условиях пандемии. Девять врачей получили знаки отличия «За доблесть и отвагу». Среди них и анестезиолог-реаниматолог Госпиталя для ветеранов войн Михаил Дмитриев. «Доктор Питер» расспросил у него, было ли страшно работать в самом начале эпидемии? Что происходит в реанимации? Поможет ли встреча с родными улучшить состояние больных?
Привыкнуть жить со смертью
— Почему вы решились стать анестезиологом-реаниматологом?
— Все произошло неслучайно. Когда я учился в медицинском училище, стал работать санитаром на станции скорой медицинской помощи. Меня, как молодого человека, пригласили в спецбригаду интенсивной терапии, потом в кардиореанимационную. Получается, что я уже с санитарской практики приобщился к интенсивной терапии. И не видел себя в другой отрасли, когда окончил институт. Другие специальности мне не кажутся такими же интересными. После окончания института, я получил специализацию по анестезиологи и реаниматологи и приступил к работе в отделении реанимации больницы имени Петра Великого.
— Вы привыкли к тому, что люди уходят?
— Не могу ответить за всех. Я привыкнуть не смог. Когда человек уходит, у тебя все равно остается ощущение, что ты чего-то не доделал. Всегда червь сомнения есть, и это, мне кажется, нормально.
Паллиативная седация: регуляторные, этические и клинические аспекты
Статья авторов Д.В. Невзоровой и Т.А. Гремяковой, опубликованная в журнале «Pallium: паллиативная и хосписная помощь» (№1 (2), 2019). Текст публикуется с разрешения редакции журнала.
Аннотация
Паллиативная седация применима, когда неизлечимо больные пациенты в конце жизни страдают физически и невосприимчивы к усилению стандартных методов лечения. Адекватная практика ее применения не приводит к уменьшению продолжительности жизни. Паллиативная седация показана как исключение из правил после обсуждения с пациентом и его представителями и принятия решения мультидисциплинарной командой медиков. Что касается необходимой степени седации, сознание пациента следует снижать до уровня, требуемого для облегчения страданий. Этот принцип помогает определиться с моментом начала процедуры и титрованием дозы седативных средств. Бензодиазепины остаются основными препаратами паллиативной седации, дозы зависят от массы тела больного, состояния почек и печени, статуса гидратации, наличия сопутствующих симптомов.
Паллиативная седация – контролируемое введение седативных препаратов с целью уменьшения сознания пациента до уровня переносимости рефрактерных и невыносимых симптомов. Она применима в тех случаях, когда неизлечимо больные пациенты в конце жизни страдают от физических симптомов, невосприимчивых (рефрактерных, резистентных) к стандартным методам лечения. Цель паллиативной седации – избавление от боли и страданий, но не приближение смерти. Результаты клинических исследований показывают, что паллиативная седация применяется в основном у онкологических больных при делирии, одышке, болях, рвоте и тошноте. Адекватная практика ее применения не приводит к уменьшению продолжительности жизни. Паллиативная седация показана на терминальных стадиях заболеваний как исключение из правил после обсуждения данного вопроса с пациентом и его представителем и принятия решения мультидисциплинарной командой медиков. Что касается необходимой степени седации для данного пациента, сознание пациента следует снижать до уровня, который требуется для облегчения страданий от резистентных к лечению симптомов. Этот принцип помогает определиться с моментом начала процедуры и титрованием дозы седативных средств. Бензодиазепины, особенно мидазолам, остаются основными элементами процедуры паллиативной седации. Индивидуальные дозы седативных препаратов могут варьироваться, поскольку они зависят от массы тела больного, функционального состояния почек и печени, статуса гидратации и наличия сопутствующих симптомов. Можно и нужно продолжать лечение любыми другими препаратами, которые ранее использовались для купирования симптомов, однако с началом паллиативной седации следует прекратить повышать их дозу во избежание возникновения возможных побочных эффектов.
Терминология
Купирование мучительных симптомов неизлечимых болезней в конце жизни подчас становится для медиков трудновыполнимой задачей, несмотря на интенсивный паллиативный уход за больными. В случае невосприимчивости симптомов к стандартным лечебным мерам может быть показана паллиативная седация, цель которой избавление от боли и страданий, но ни в коем случае не приближение смерти [1].
Во избежание путаницы необходимо определиться с терминологией. В мировой практике существует несколько процедур, связанных с уходом больного пациента из жизни:
эвтаназия – введение пациенту летального препарата с целью избавления его от неизлечимых и невыносимых страданий;
ассистируемое врачом самоубийство – предоставление врачом пациенту необходимой информации/и/или препаратов, позволяющих больному совершить акт самоубийства;
паллиативная седация – контролируемое введение седативных препаратов с целью уменьшения сознания пациента до уровня переносимости рефрактерных и невыносимых симптомов (одобрено American Medical Association (AMA) в 2008 г.)
В данном обзоре речь пойдет только о паллиативной седации, но даже это определение не является однозначным, и смысл, который вкладывают в него клиницисты, существенным образом различается. Так, в литературе наряду с паллиативной седацией можно найти терминальную, общую, контролируемую, глубокую, непрерывную глубокую седацию (Сontinuous deep sedation (CDS)), седационную терапию и седацию умирающих пациентов. Многочисленность синонимов объясняет, почему только 40% опрошенных врачей соглашаются дать определение паллиативной седации без оговорок [6].
Анализ данных литературы выявил большой разброс в распространенности применения паллиативной седации среди неизлечимо больных пациентов – от 2 до 52%. От 10 до 50% пациентов в программах паллиативной помощи по-прежнему отмечают наличие значительной боли за неделю до смерти. Наиболее распространенные симптомы, наблюдаемые у этих пациентов, – одышка, боль, бред, рвота. Большинство симптомов физические по природе. В ретроспективном анализе 54% пациентов имели больше чем один неподконтрольный симптом [6].
Международный опыт
В США паллиативные отделения могут сообщить, что 23% из 186 пациентов после паллиативной седации выписаны из госпиталя [3].
В Европе нет единых стандартов проведения паллиативной седации:
Бельгия и Нидерланды – эвтаназия легализована, применение продолжительной глубокой седации считается нормой и очень похожа на эвтаназию, семья обычно прощается перед тем, как пациента переведут в бессознательное состояние. В той же Бельгии уровень применения CDS в одной из клиник за 6 лет сократился с 7 до 3% в результате оптимизации управления симптомами и использования командного подхода при принятии решения [3].
Великобритания следует директивам Европейской ассоциации паллиативной помощи (European Association for Palliative Care), которая подчеркивает необходимость титрования дозы пропорционально симптомам, сохраняя, по возможности, сознание пациента [3].
Франция в 2016 г. приняла закон, разрешающий терминальную седацию для неизлечимо больных пациентов [1].
Швейцария – доля терминальной седации в смертности паллиативных больных в Цюрихе, по данным 2013 г., составила 17,5%. Для сравнения в 2001 г. этот показатель равнялся всего 4,7%. Эксперты всерьез обеспокоены таким существенным ростом, так как в стране запрещена эвтаназия подобного рода. Одной из причин роста случаев искусственного сна эксперты называют чрезмерное искусственное продление жизни бессмысленной терапией [1].
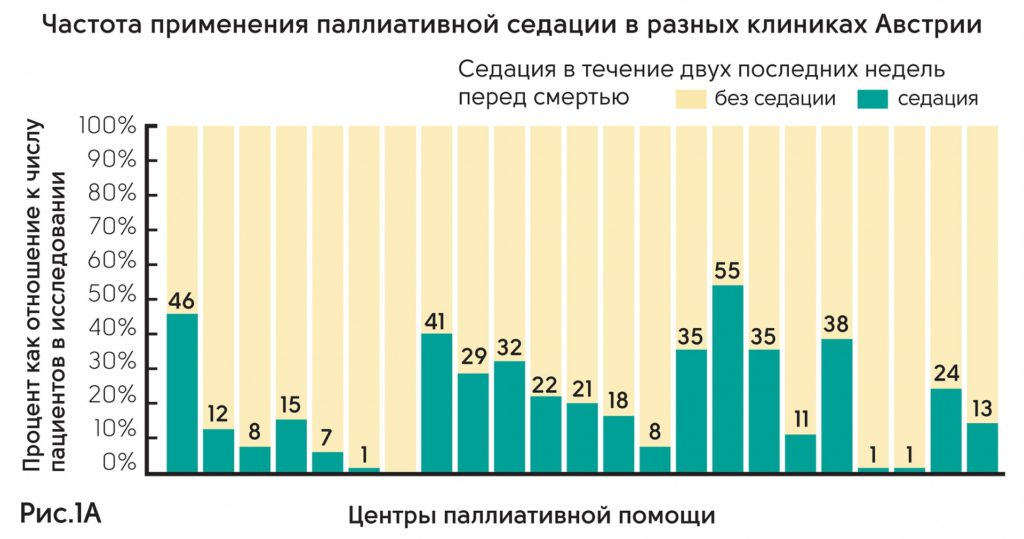
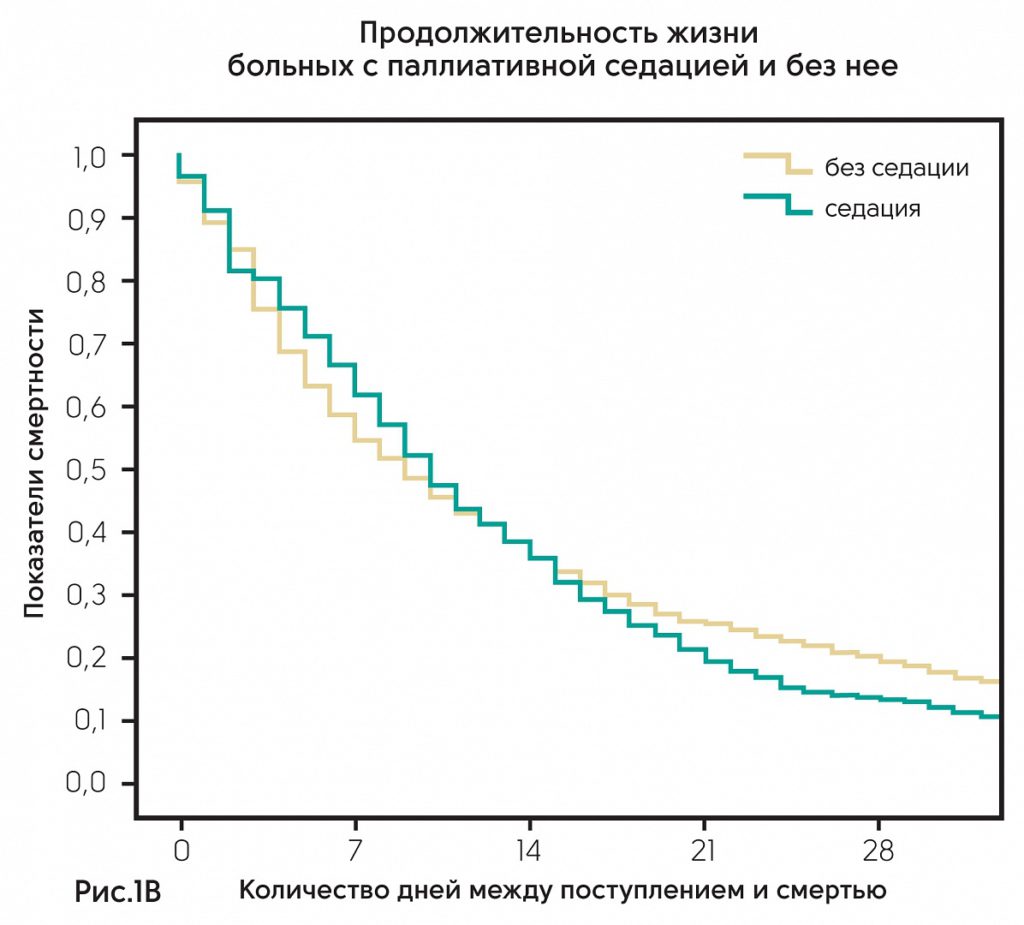
Австрия – проанализированы клинические данные по 2414 пациентам в 23 из 31 отделения паллиативной помощи Австрии. Результаты показали, что частота применения паллиативной седации в разных клиниках колеблется от 0 до 55% (рис. 1А). Из 2414 только 502 получали седацию. Из них 356 (71%) получали непрерывную седацию до момента смерти, 119 (24%) – прерывистую седацию. Среднее время седации составляло 48 ч (IQR 10–72h); 168 пациентов (34%) получали седативные препараты менее 24 ч. Показания для седации – делирий (51%), экзистенциальный дистресс (32%), нарушение дыхания (30%), боль (20%). Основное заболевание – онкология (92%). Среднее количество дней жизни между госпитализацией и смертью у пациентов с седацией статистически не различалось и составляло 10 против 9 дней (p = 0,491) (рис. 1В).
Япония – рассчитанное применение продолжительной глубокой седации у больных с экзистенциальным дистрессом – 1% (90 случаев/8,661 общего числа смертей пациентов). Прогнозируемое время жизни в 94% случаев составляло не более 3 недель. Показания для продолжительной глубокой седации – ощущение бессмысленности/бесполезности (61%), нагрузка на других/зависимость/неспособность к самообслуживанию (48%), боязнь смерти/тревожность/страх/паника (33%), желание самостоятельно контролировать время смерти (24%), изоляция/отсутствие социальной поддержки (22%) [7].
Отсутствие единообразия в терминологии сказывается на представляемых результатах клинических исследований, где под паллиативной седацией имеется в виду и рутинная седация, и другие практики, не имеющие отношения к паллиативной седации [3].
Предлагаются другие дефиниции для замены неоднозначно трактуемой медикаментозной процедуры паллиативной седации. Так, Твайкросс в 2017 г. [3] предложил ввести термин непрерывной глубокой седации (Сontinuous deep sedation – CDS) как основную цель терминального лечения, применяемую только в исключительных случаях.
Но пока это не рассмотрено на законодательном уровне, следует руководствоваться установленными нормами и определениями паллиативной седации, принятой многими международными организациями, действующими в области паллиативной медицины:
Данные организации единогласны в том, что паллиативная седация показана в случае невыносимых физических страданий пациентов в конце их жизни, но не может применяться при экзистенциальном дистрессе, требующем других способов коррекции [6, 9, 10, 11, 12].
Показания для использования паллиативной седации
Паллиативная седация применяется в тех случаях, когда неизлечимо больные пациенты в конце жизни страдают от неконтролируемых симптомов, невосприимчивых (рефрактерных, резистентных) к стандартным методам лечения. В обзоре литературы о применении паллиативной седации у пациентов с неизлечимыми онкологическими заболеваниями за 2012 год по результатам 30‑летних клинических исследований паллиативная седация применялась при делирии у 54% из 774 пациентов, при одышке – у 30%, при болях – у 17% и при тошноте – у 5% [4].
Атрибуты рефрактерных симптомов [5]:
Когда следует принимать решение о паллиативной седации? В наличии должны быть следующие факторы [6]:
Отказ от реанимации в данном случае не противоречит законодательству РФ. Согласно статье 66 ФЗ № 323 РФ, «в некоторых случаях реанимационные мероприятия не проводятся (пункт 7) – «на фоне достоверно установленных неизлечимых заболеваний».
Перед началом паллиативной седации стандартной процедурой является получение информированного согласия пациента и прикрепление этого документа к медицинской карте. Необходимо в любой ситуации уважать автономность пациента, а если он не может или не хочет участвовать в принятии решения, то следует организовать процесс принятия решения вместо пациента его родственником или назначенным законным представителем. Лучше всего, если информированное согласие будет получено у пациента до того, как возникнет необходимость начать паллиативную седацию, предпочтительно в присутствии члена его семьи или его назначенного представителя и с разрешения пациента. В таком случае пожелания пациента будут должным образом учтены, даже если в момент, когда показана паллиативная седация, у пациента уже отсутствует ясная речь.
В процессе получения согласия на встрече с членами семьи необходимо разъяснить основные моменты, в том числе рассказать о текущем состоянии пациента, прогнозе, этиологии резистентных симптомов. Кроме того, необходимо объяснить, почему есть основания полагать, что адекватное купирование симптомов невозможно обеспечить стандартными методами лечения, представить риски и преимущества паллиативной седации и подробно описать процесс седации с заранее установленными целями этого процесса.
Ведение паллиативной седации
Паллиативной седации можно достичь различными методами. Чтобы понять, какой из них будет наиболее эффективным, лечащему врачу, возможно, придется принять во внимание несколько факторов, таких как характер, начало проявления и тяжесть симптомов пациента, общий прогноз, а также цели и желания пациента/семьи.
Что касается необходимой степени седации для данного пациента, сознание пациента, согласно принципу пропорциональности, нужно снижать до уровня, который требуется для облегчения страданий от резистентных симптомов. Этот принцип помогает определиться также с моментом начала процедуры и титрованием дозы седативных средств [1].
Целью паллиативной седации является максимально возможное сохранение способности пациента взаимодействовать с близкими и в то же время обеспечение адекватного купирования его симптомов и комфортного состояния за счет поддержания минимального уровня необходимой седации.
Пожелания пациента к паллиативной седации:
Такая седация может быть обеспечена за счет успокоительных или обезболивающих препаратов, вводимых для седативного воздействия, а не просто с помощью увеличения дозы лекарств, применяемых ранее для контроля симптомов (например, опиоидов), до уровня, когда седативный побочный эффект приведет к гиперседации, поскольку это может вызвать нежелательные побочные эффекты (например, миоклонию, тошноту).
Под рукой также должен быть план лечения стационарных и амбулаторных пациентов на случай чрезвычайной ситуации. Может понадобиться купирование внезапных и тяжелых симптомов в конце жизни, таких как сильное кровотечение, терминальное кислородное голодание, мучительный болевой кризис. В этом случае, чтобы облегчить страдания неизбежно умирающего пациента, может быть показано быстрое проведение агрессивной, глубокой и непрерывной седации [1].
Фармакология паллиативной седации
В медицинском сообществе нет консенсуса или научных доказательств, касающихся наиболее подходящих препаратов для осуществления паллиативной седации. Лекарственный препарат следует выбирать, основываясь на безопасности, эффективности и доступности [6]. В таблице 1 перечислены препараты и дозировки, которые обычно используются для паллиативной седации.
Лоразепам – это бензодиазепин, действующий дольше, чем мидазолам. В жидкой форме его можно применять орально или сублингвально. Печеночная или почечная недостаточность не влияют на его выведение. Таким образом, он незаменим для хосписной помощи на дому и часто входит в хосписный набор медикаментов для облегчения симптомов, особенно в концентрированной форме [1, 6].
Среди других препаратов, широко используемых для паллиативной седации, – антипсихотический хлорпромазин, барбитураты (фенобарбитал или первоначально пентобарбитал) и анестетический пропофол.
Лекарственные препараты для проведения паллиативной седации начинают давать с минимальной дозы и постепенно титруют вверх до минимально необходимой дозы, обеспечивающей облегчение или управление рефрактерными симптомами. Дополнительные дозы могут быть введены при необходимости [6].
Важно помнить, что индивидуальные дозы могут варьироваться, поскольку они зависят от массы тела больного, функционального состояния почек и печени, статуса гидратации и наличия сопутствующих симптомов.
Краткий перечень препаратов, наиболее часто используемых для паллиативной седации, и диапазон начальных доз [1]:
Мидазолам – 0,5 до 1 мг/час внутривенно/подкожно начальная внутривенная доза, от 0,5 до 5 мг по необходимости или нагрузочная доза;
Лоразепам – 0,5 до 5 мг орально/внутривенно/сублингвально, каждые 1–2 часа по необходимости, каждые 4–6 часов по расписанию;
Хлорпромазин – 12,5 до 25 мг внутривенно/внутримышечно каждые 2–4 часа, от 25 до 100 мг ректально каждые 4–12 часов;
Фенобарбитал – 1 до 3 мг/кг нагрузочная доза внутривенно, подкожно, затем – инфузия 0,5 мг/кг/час;
Пропофол – 20 мг нагрузочная доза внутривенно, затем длительная инфузия 10 мг/ч или 2,5 до 5 мг/кг/мин и увеличивать до 10–20 мг/час каждые 10 мин по необходимости;
Галоперидол – орально/внутримышечно/внутривенно, разовая доза – 0,5 мг, суточная – 0,5–15 мг [12].
Постепенное и прогнозируемое нарушение дыхания у терминальных больных не должно использоваться в качестве основания для уменьшения седативного эффекта. Оценка пациента должна включать тяжесть страданий, уровень сознания и неблагоприятные побочные эффекты [6].
Этические вопросы
Паллиативная седация поднимает этические вопросы в тех случаях, когда сознание больного медикаментозно снижается до такой степени, что пациент не в состоянии взаимодействовать с другими людьми, не имеет возможности скорректировать или изменить свое мнение и не в состоянии принимать пищу и воду.
С целью снятия и облегчения эмоциональных нагрузок и ответственности, связанных с уходом за такими больными в конце жизни, очень важно для медицинской команды проводить периодические конференции с разбором данных случаев и оказанием психологической поддержки персоналу [6].
Литература:
Bobb. B. Nurs Clin North Am. 2016, Sep.; 51 (3): 449–57.
Понкин И. В., Понкина А. А.. Паллиативная медицинская помощь. Понятие и правовые основы. 2014.
Twycross R. Regarding Palliative Sedation. Journal of Pain and Symptom Management. 2017. https://www.clinicalkey.com/#!/content/journal/1‑s2.
Maltoni M., Scarpi E., Rosat M. et al. Palliative sedation in end-of-life care and survival: a systematic review. J. Clin. Oncol. 2012; 30 (12: 1378–83. 456.
Cherney N. I., Portenoy R. K. Sedation in the management of refractory symptoms: guidelines for evaluation and treatment. J. Palliat. Care. 1994; 11 (2): 31–38.
Bruce S. D. Palliative Sedation in End-of-Life Care. Journal of Hospice and Palliative Nursing. 2006; 8 (6): 320–327.
Morita T. Palliative sedation to relieve psycho-existential suffering of terminally ill cancer patients. J Pain Symptom Manage. 2004, Nov.; 28 (5): 445–50.
Schur S., Weixler D., Gabl C., Kreye G., Likar R., Masel E. K., Mayrhofer M., Reiner F., Schmidmayr B., Kirchheiner K., Watzke H. H. Sedation at the end of life – a nation-wide study in palliative care units in Austria. BMC Palliative Care (2016) 15:50.
Statement on Palliative Sedation. December 5, 2014. http://aahpm.org/positions/palliative-sedation.
Danis M., Bellavance E., Silverman H. Ethical considerations in managing critically ill patients. Critical Care Medicine: Principles of Diagnosis and Management in the Adult, Fourth Edition Published January 1, 2014.
Kirk T. W. National Hospice and Palliative Care Organization (NHPCO) Position Statement and Commentary on the Use of Palliative Sedation in Imminently Dying Terminally Ill Patients. Journal of Pain and Symptom Management. Vol. 39. No. 5. May 2010. P. 914–923.
Хронический болевой синдром (ХБС) у взрослых пациентов в паллиативной медицинской помощи. МКБ‑10: R52.1, R52.2, 2016.