Что значит устойчивы к препарату
Устойчивость к противомикробным препаратам
Основные факты
Что такое противомикробные препараты?
Противомикробные препараты, включающие в себя антибиотики, противовирусные, противогрибковые и противопаразитические средства, представляют собой лекарственные средства, применяемые для профилактики и лечения инфекций у людей, животных и растений.
Что такое устойчивость к противомикробным препаратам?
Устойчивость к противомикробным препаратам (УПП) возникает в результате постепенной мутации бактерий, вирусов, грибков и паразитов и утраты ими восприимчивости к лекарственным препаратам, затрудняя лечение инфекций и повышая риск распространения, тяжелого течения и летального исхода болезней.
Лекарственная устойчивость приводит к утрате эффективности антибиотиков и других противомикробных препаратов и постепенно осложняет или делает невозможным лечение инфекций.
Почему устойчивость к противомикробным препаратам вызывает обеспокоенность во всем мире?
Появление и распространение невосприимчивых к лекарствам патогенов, у которых выработались новые механизмы резистентности к противомикробным препаратам, продолжают ограничивать наши возможности для лечения распространенных инфекций. Особенно тревожной тенденцией является быстрое распространение в мире бактерий с множественной или тотальной устойчивостью (так называемых «супербактерий»), которые вызывают инфекции, не поддающиеся лечению существующими противомикробными препаратами, в частности антибиотиками.
Портфель клинических разработок новых противомикробных препаратов крайне мал. В 2019 г. ВОЗ выявила 32 антибиотика, которые находятся на этапе клинической разработки и предназначены для лечения болезнетворных возбудителей, включенных в список приоритетных патогенов ВОЗ, из которых только шесть антибиотиков отнесены в категории инновационных. Кроме того, серьезной проблемой остается недостаточная доступность качественных противомикробных препаратов. Нехватку антибиотиков испытывают страны всех уровней развития, и особенно учреждения систем здравоохранения стран.
По мере распространения лекарственной устойчивости во всем мире эффективность антибиотиков неуклонно снижается, и это приводит к появлению трудноизлечимых инфекций и смерти людей. Существует острая потребность в новых противомикробных препаратах, например для лечения карбапенем-резистентных грамотрицательных бактериальных инфекций, внесенных ВОЗ в список приоритетных патогенов. Вместе с тем без изменения нынешней практики использования антибиотиков человеком новые антибиотики, как и нынешние, будут утрачивать свою эффективность.
УПП наносит значительный урон экономике и системам здравоохранения стран, поскольку уменьшает производительность пациентов и ухаживающих за ними лиц в связи с удлинением сроков госпитализации и потребностью в более дорогостоящих и интенсивных видах терапии.
Без эффективных инструментов профилактики и надлежащего лечения лекарственно устойчивых инфекций и расширения доступа к существующим и новым качественным противомикробным препаратам число людей, не излечивающихся или умирающих от инфекций, будет расти. Более рискованными станут такие медицинские вмешательства, как хирургические операции, в том числе кесарево сечение или эндопротезирование тазобедренного сустава, химиотерапия онкологических заболеваний и трансплантация органов.
Какие факторы ускоряют формирование и распространение устойчивости к противомикробным препаратам?
Устойчивость к противомикробным препаратам развивается со временем естественным образом, обычно в результате генетических мутаций. Устойчивые к противомикробным препаратам микроорганизмы присутствуют у людей и животных, в продуктах питания, растениях и окружающей среде (в воде, почве и воздухе). Они могут передаваться от человека к человеку или между людьми и животными, в том числе с пищей животного происхождения. Основными причинами возникновения устойчивости к противомикробным препаратам являются неправильное и чрезмерное применение противомикробных препаратов; отсутствие доступа людей, а также животных к чистой воде, средствам санитарии и гигиены; неудовлетворительная профилактика инфекций и инфекционный контроль в медицинских учреждениях и на сельскохозяйственных предприятиях; ограниченный доступ к качественным и приемлемым по цене лекарственным препаратам, вакцинам и средствам диагностики; низкий уровень осведомленности и знаний; и отсутствие контроля за соблюдением законодательства.
Текущая ситуация
Лекарственная устойчивость бактерий
Во всем мире наблюдаются высокие показатели устойчивости к антибиотикам, используемым для лечения таких распространенных бактериальных инфекций, как инфекции мочевыводящих путей, сепсис, инфекции, передаваемые половым путем, и некоторые формы диареи, что свидетельствует об истощении нашего арсенала эффективных антибиотиков. Так, в странах, представляющих данные в Глобальную систему эпиднадзора за устойчивостью к противомикробным препаратам (GLASS), частота случаев устойчивости к антибиотику ципрофлоксацину, обычно применяемому для лечения инфекций мочевыводящих путей, варьируется в диапазоне от 8,4% до 92,9% для Escherichia coli и от 4,1% до 79,4% для Klebsiella pneumoniae.
Klebsiella pneumoniae – распространенная кишечная бактерия, которая может вызывать опасные для жизни инфекционные поражения. В настоящее время во всех регионах мира распространилась устойчивость K. pneumoniae к препаратам последнего резерва (антибиотикам класса карбапенемов). K. pneumoniae является одной из ведущих причин таких внутрибольничных инфекций, как пневмония, инфекции кровотока и инфекции у новорожденных и пациентов отделений интенсивной терапии. В некоторых странах из-за формирования устойчивости карбапенемы не подходят для лечения более половины пациентов, инфицированных K. pneumoniae.
Широкое распространение получила устойчивость E. coli к противомикробной активности фторхинолонов, используемых для лечения инфекций мочевыводящих путей.
В ряде стран различных регионов мира данная терапия перестала быть эффективной в более чем половине случаев.
Колистин остается единственным препаратом последнего резерва, подходящим для лечения опасных для жизни инфекций, вызываемых карбапенем-устойчивыми энтеробактериями (т.е. E.coli, Klebsiella и т.д.). В ряде стран и регионов уже выявлены колистин-резистентные бактерии, вызывающие инфекции, против которых в настоящее время не имеется эффективных антибиотиков.
Бактерии Staphlylococcus aureus присутствуют в микрофлоре кожных покровов человека, а также нередко вызывают распространение инфекций в быту и медицинских учреждениях. По оценкам, вероятность смерти больного, инфицированного метициллин-резистентной Staphylococcus aureus, на 64% выше, чем пациента с восприимчивой к препарату инфекцией.
С 2019 г. в системе мониторинга ЦУР отслеживается новый показатель, связанный с УПП. Этот показатель используется для мониторинга частоты возникновения инфекций кровотока, вызванных двумя конкретными лекарственно устойчивыми возбудителями: метициллин-резистентной Staphylococcus aureus (MRSA); и E. coli, устойчивой к цефалоспоринам третьего поколения (3GC). В 2019 г. в систему GLASS поступили данные об инфекциях кровотока, вызванных MRSA, в 25 странах и данные об инфекциях кровотока, вызванных E.coli, в 49 странах. Хотя представленные данные пока не являются репрезентативными на национальном уровне, зарегистрированное медианное значение доли случаев инфицирования метициллин-резистентной S. aureus составило 12,11% (МКР 6,4–26,4), а в случае E. coli, устойчивой к цефалоспоринам третьего поколения – 36,0% (МКР 15,2–63,0).
Широко распространенная лекарственная устойчивость значительно различающихся между собой штаммов N. gonorrhoeae сводит на нет усилия по профилактике и лечению гонореи. Быстро развивается устойчивость инфекций к сульфаниламидам, пенициллинам, тетрациклинам, макролидам, фторхинолонам и цефалоспоринам первых поколений. В настоящее время единственным вариантом эмпирической монотерапии гонореи является применение инъекционного цефалоспорина широкого спектра действия цефтриаксона.
Лекарственная устойчивость mycobacterium tuberculosis
Устойчивые к антибиотикам штаммы mycobacterium tuberculosis (палочки Коха) угрожают достижениям в борьбе с глобальной эпидемией туберкулеза. По оценкам ВОЗ, в 2018 г. в мире произошло около полумиллиона новых случаев заболевания туберкулезом с устойчивостью к рифампицину (РУ-ТБ); в подавляющем большинстве случае они представляли собой туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ) – форму туберкулеза, характеризующуюся невосприимчивостью к двум наиболее мощным противотуберкулезным препаратам. При этом только треть из около полумиллиона пациентов, заболевших МЛУ/РУ-ТБ в 2018 г., была выявлена и включена в отчетность. По сравнению с нерезистентным туберкулезом для лечения МЛУ-ТБ требуются более продолжительные, менее эффективные и гораздо более дорогостоящие схемы лечения. Успешное излечение от МЛУ/РУ-ТБ наступает у менее 60% больных.
В 2018 г. доля случаев МЛУ-ТБ/РУ-ТБ оценивалась на уровне 3,4% среди ранее не болевших пациентов и на уровне 18% среди уже получавших лечение; таким образом, формирование устойчивости к новым противотуберкулезным препаратам последнего резерва, предназначенным для лечения лекарственно устойчивых форм туберкулеза, является крайне опасным явлением.
Лекарственная устойчивость вирусов
Устойчивость к противовирусным препаратам, формирующаяся в результате непрерывной репликации вирусов под длительным воздействием лекарственных средств и отбора резистентных штаммов, представляет собой растущую угрозу для пациентов с ослабленным иммунитетом. В настоящее время проблема устойчивости затрагивает большинство противовирусных препаратов, включая антиретровирусные (АРВ).
Формирование лекарственно устойчивой ВИЧ-инфекции (ЛУ-ВИЧ) может привести к частичной и полной утрате эффективности всех препаратов АРВ, в том числе относящихся к новым классам. Инфицирование ЛУ-ВИЧ может происходит как у пациентов, уже получающих антиретровирусную терапию, так и у заражающихся ВИЧ впервые. В большинстве стран Африки, Азии и Латинской Америки, в которых ведется мониторинг ситуации, доля случаев ЛУ-ВИЧ с дотерапевтической резистентностью к ненуклеозидным ингибиторам обратной транскриптазы (ННИОТ) на этапе до начала лечения среди взрослых, которым назначается терапия первой линии, превышает 10%. Тревожно высокой является распространенность дотерапевтической резистентности среди младенцев. В странах Африки к югу от Сахары носителями устойчивого к ННИОТ вируса являются более 50% младенцев с недавно диагностированной ВИЧ-инфекцией. С учетом данных обстоятельств в последнем варианте руководящих принципов ВОЗ по АРВ-терапии содержится рекомендация о применении в качестве предпочтительной терапии первой линии у взрослых и детей нового препарата долутегравир. Назначение данного препарата является особенно актуально для предотвращения негативных последствий устойчивости к ННИОТ.
Рост показателей устойчивости порождает и значимые экономические последствия, поскольку препараты второй и третьей линии являются гораздо более дорогостоящими по сравнению с препаратами первой линии. В рамках программы ВОЗ по борьбе с лекарственной устойчивостью ВИЧ-инфекции ведется мониторинг тенденций передачи инфекции и формирования ее устойчивости к более старым и новым препаратам против ВИЧ во всем мире.
Лекарственная устойчивость малярийных паразитов
Появление лекарственно устойчивых малярийных паразитов представляет собой одну из самых серьезных угроз для борьбы с малярией и приводит к увеличению заболеваемости малярией и смертности от нее. Рекомендуемым методом лечения первой линии при неосложненной малярии, вызванной P. falciparum, является артемизинин-комбинированная терапия (АКТ), применяемая в большинстве эндемичных по малярии стран. АКТ – комбинация компонента артемизинина и дополнительного лекарственного компонента. В рамках исследований, проведенных в 2001–2019 гг. в таких регионах ВОЗ, как Регион стран Западной части Тихого океана и Регион Юго-Восточной Азии, частичная устойчивость к артемизинину и устойчивость к ряду дополнительных лекарственных компонентов АКТ была подтверждена в Камбодже, Лаосской Народно-Демократической Республике, Мьянме, Таиланде и Вьетнаме. Это усложняет подбор эффективных лекарственных средств и требует пристального мониторинга процесса лечения.
В некоторых странах Региона Восточного Средиземноморья ВОЗ устойчивость P. falciparum к сульфадоксину-пириметамину сделала неэффективной терапию артезунатом в сочетании с сульфадоксином-пириметамином и потребовала перехода к другому варианту ACT.
В отношении стран Африки недавно были опубликованы данные, свидетельствующие о появлении мутаций, вызывающих частичную устойчивость паразита к артемизинину, в Руанде. На сегодняшний день апробированные варианты АКТ сохраняют высокую эффективность. Однако дальнейшее распространение устойчивости к артемизинину и дополнительным лекарственным компонентам АКТ может создать серьезную проблему для здоровья населения и поставить под угрозу важнейшие достижения в борьбе с малярией.
Лекарственная устойчивость грибков
Распространенность лекарственно устойчивых грибковых инфекций растет, усугубляя и без того сложную ситуацию с их лечением. Лечение многих грибковых инфекций и ранее осложнялось рядом факторов, в частности проблемой токсичности, особенно при ведении пациентов с другими сопутствующими инфекциями (например, ВИЧ). Уже приобрела широкое распространение лекарственно устойчивая форма одной из наиболее распространенных инвазивных грибковых инфекций Candida auris, у которой зарегистрирована резистентность к флуконазолу, амфотерицину B и вориконазолу и растущая резистентность к каспофунгину.
Это приводит к появлению новых случаев заражения трудноизлечимыми грибковыми инфекциями, терапевтическим неудачам, затягиванию госпитализаций и к переходу на гораздо более дорогостоящие схемы лечения. ВОЗ проводит всеобъемлющий обзор грибковых инфекций в мире и намерена опубликовать перечень приоритетных для общественного здравоохранения патогенных грибков с анализом ситуации в области разработки новых противогрибковых препаратов.
Необходимость согласованных действий
УПП является комплексной проблемой и требует коллективного многосекторального подхода. Концепция «Единое здравоохранение» предполагает объединение усилий широкого круга секторов и заинтересованных сторон, занимающихся вопросами здоровья человека, наземных и водных животных и растений, проблемами производства продовольствия и кормов и охраны окружающей среды, позволяя им взаимодействовать и совместно разрабатывать и осуществлять программы, стратегии, законодательные меры и исследования, направленные на повышение показателей здоровья населения.
Насущной задачей является активизация инновационной деятельности и наращивание капиталовложений в таких областях, как оперативные исследования, поиск и разработка новых противомикробных препаратов, вакцин и средств диагностики, особенно предназначенных для борьбы с наиболее серьезными грамотрицательными бактериями, в частности карбапенем-резистентными энтеробактериями и Acinetobacter baumannii. Значительному сокращению недостатка финансирования в этой области может способствовать создание Многостороннего партнерского целевого фонда по борьбе с устойчивостью к противомикробным препаратам (МПЦФ УПП), Глобального партнерства по научным исследованиям и разработкам антибиотиков, Фонда действий в отношении УПП и других фондов и инициатив. Правительства ряда стран, включая Швецию, Германию, США и Соединенное Королевство, апробируют модели возмещения затрат компаний-производителей новых препаратов. Для выработки долгосрочных решений круг этих инициатив должен быть расширен.
Глобальный план действий (ГПД) по борьбе с устойчивостью к противомикробным препаратам
Страны мира взяли на себя обязательство осуществлять рамочные принципы, изложенные в Глобальном плане действий (ГПД) по борьбе с УПП[1], принятом на сессии Всемирной ассамблеи здравоохранения в 2015 г., а также разработать и осуществлять многосекторальные планы действия на национальном уровне. ГПД был впоследствии одобрен руководящими органами Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО) и Всемирной организации охраны здоровья животных (МЭБ). Для обеспечения неуклонного улучшения ситуации во всем мире страны необходимо обеспечить финансированием и осуществлять национальные планы действий в целом ряде секторов. До одобрения ГПД в 2015 г. глобальные усилия по противодействию УПП осуществлялись, в частности, в рамках Глобальной стратегии ВОЗ по сдерживанию устойчивости к противомикробным препаратам, которая была разработана 2001 г. и описывает комплекс мероприятий, направленных на замедление процесса формирования и распространения УПП.
Трехсторонний совместный секретариат по проблеме устойчивости к противомикробным препаратам
В политической декларации заседания высокого уровня ООН по проблеме УПП, принятой главами государств в сентябре 2016 г. на сессии Генеральной Ассамблеи Организации Объединенных Наций в Нью-Йорке, подтверждается чрезвычайная важность широкого скоординированного подхода, объединяющего все стороны, включая секторы охраны здоровья людей, животных, растений и окружающей среды. Руководствуясь концепцией «Единое здравоохранение», ВОЗ осуществляет тесное взаимодействие с ФАО и МЭБ в целях распространения передового опыта в области сокращения масштабов и замедления темпов формирования УПП.
После состоявшегося в 2016 г. заседания высокого уровня Организации Объединенных Наций по УПП Генеральный секретарь ООН учредил Межучрежденческую координационную группу (МУКГ) по УПП. МУКГ объединяет партнеров по системе ООН, международные организации и частных лиц, имеющих опыт в области охраны здоровья человека, животных и растений, а также в области производства продовольствия и кормов для животных, торговли, развития и охраны окружающей среды, и призвана сформулировать план противодействия устойчивости к противомикробным препаратам. В апреле 2019 г. Межучрежденческая координационная группа по УПП представила Генеральному секретарю ООН свой доклад«Нельзя терять время: обеспечим защиту от лекарственно устойчивых инфекций в будущем». Рекомендации, сформулированные в докладе, в настоящее время находятся в процессе выполнения.
Для содействия участию широкого круга заинтересованных сторон в решении проблемы УПП при ВОЗ был создан трехсторонний совместный секретариат (ФАО, МЭБ и ВОЗ). Было решено создать ряд ключевых структур для управления работой, а именно Глобальную руководящую группу по борьбе с УПП на основе концепции «Единое здравоохранение», Независимую комиссию по рассмотрению фактических данных для принятия мер по борьбе с УПП и Многостороннюю партнерскую платформу. Эти структуры находятся в процессе создания.
Всемирная неделя правильного использования противомикробных препаратов
Раньше эта неделя называлась Всемирной неделей правильного использования антибиотиков. С 2020 г. она получила название «Всемирная неделя правильного использования противомикробных препаратов». Новое название отражает расширение тематики недели, поскольку теперь она посвящена всем типам противомикробных препаратов, включая антибиотики, противогрибковые, противопаразитические и противовирусные средства. Всемирная неделя проводится ежегодно начиная с 2015 г. в виде глобальной кампании, направленной на повышение осведомленности о проблеме устойчивости к противомикробным препаратам во всем мире и пропаганду передовых методов, позволяющих замедлить появление и распространение лекарственно устойчивых инфекций, среди широкой общественности, медицинских работников и политиков. Согласно решению Трехстороннего исполнительного комитета, начиная с 2020 г. Всемирная неделя будет проводиться с 18 по 24 ноября. В течение последних пяти лет неделя проходила под общим лозунгом «Антибиотики: используйте осторожно!» В 2020 г. он был изменен на «Противомикробные препараты требуют осторожного обращения».
Глобальная система по надзору за устойчивостью к противомикробным препаратам (GLASS)
Глобальная система эпиднадзора за устойчивостью к противомикробным препаратам была создана ВОЗ в 2015 г. в целях непрерывного сбора недостающих данных, необходимых для стратегического планирования на всех уровнях. GLASS призвана систематически накапливать данные эпиднадзора за лекарственно устойчивыми инфекциями у человека, информацию о применении противомикробных препаратов и о лекарственно устойчивых инфекциях в продовольственных системах и окружающей среде. GLASS обеспечивает стандартизированный подход к сбору, анализу, интерпретации и распространению данных по странам, территориям и районам и позволяет отслеживать состояние существующих и новых национальных систем эпиднадзора, уделяя особое внимание качеству и репрезентативности собираемых данных. В некоторых регионах ВОЗ созданы сети эпиднадзора, обеспечивающие оказание технической поддержки странам и упрощающие присоединение к GLASS.
Глобальные исследования и выбор приоритетов в области борьбы с УПП
В 2017 г. ВОЗ разработала список приоритетных патогенов, призванный служить ориентиром для проведения научных исследований и разработки новых противомикробных препаратов. Он будет обновлен в 2022 г. Для оценки прогресса в разработке препаратов против приоритетных патогенов из списка ВОЗ Организация ежегодно анализирует антибактериальные препараты, находящиеся на стадии доклинической оценки и клинических испытаний. На сегодняшний день исследованиями и разработками по-прежнему не охвачен целый ряд направлений, в частности по разработке препаратов против грамотрицательных карбапенем-резистентных бактерий.
Глобальное партнерство по научным исследованиям и разработкам антибиотиков (GARDP)
Данное совместное начинание ВОЗ и Инициативы по лекарственным средствам против забытых болезней направлено на стимулирование исследований и разработок на основе государственно-частных партнерств. К 2025 г. Партнерство должно разработать и внедрить пять новых лекарственных препаратов, эффективных в отношении наиболее опасных с точки зрения ВОЗ лекарственно устойчивых бактерий.
Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью
Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью
Антибиотикорезистентные бактерии одолевают один препарат за другим и неконтролируемо распространяются
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Устойчивость бактерий к антибиотикам — серьезная угроза здоровью людей. Из-за распространения резистентности с каждым годом подобрать эффективное лечение становится все сложнее. Человечество использует антибиотики повсеместно и тем самым только ускоряет процесс. К сожалению, резистентные штаммы могут передаваться от одного человека к другому, и масштаб проблемы до сих пор известен не до конца. Может ли, например, высокий уровень потребления антибиотиков в одной стране ухудшить эпидемиологическую обстановку в другой, где правительство регулирует использование противомикробных препаратов? Недавнее исследование, о котором мы расскажем в первой части статьи, утверждает, что да, может. А значит, опасность еще серьезнее, чем мы думали. Поэтому необходимо искать препараты, ломающие сам механизм устойчивости, так как уже сейчас существуют бактерии, которые невозможно остановить практически ни одним антибиотиком. Во второй части статьи мы расскажем об исследовании, открывшем новые свойства уже известных препаратов, как об одном из способов «отключить» резистентность и тем самым спасти миллионы жизней.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Вступление
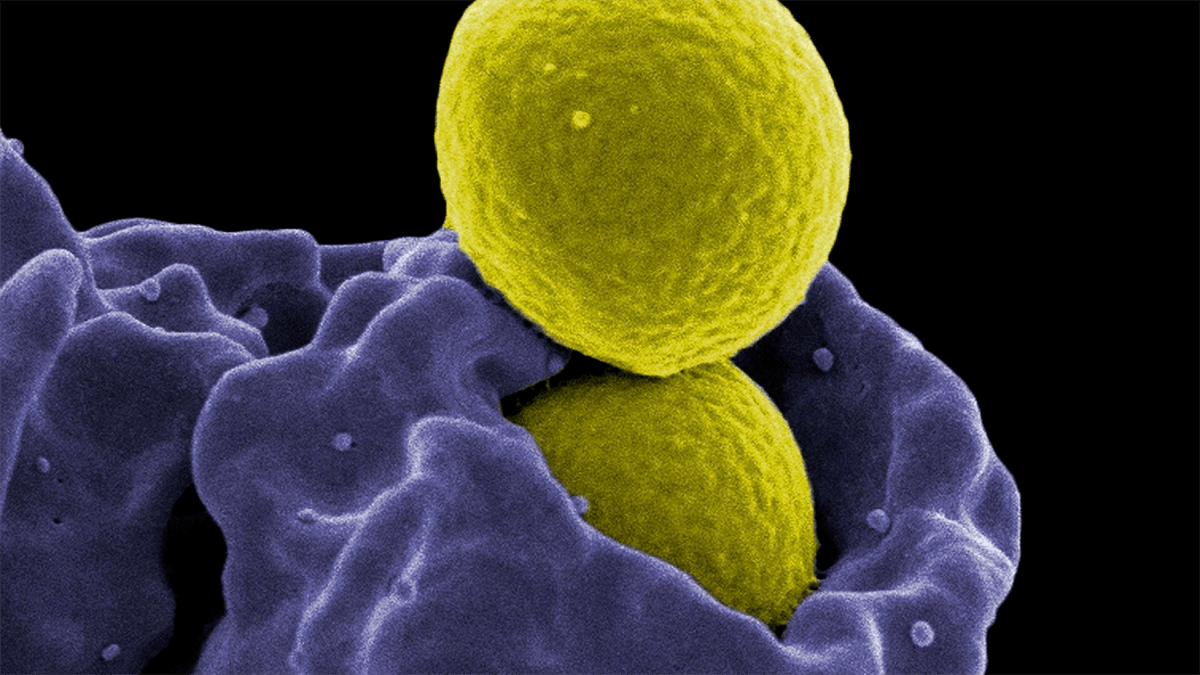
С тех пор как Александр Флеминг впервые выделил пенициллин, жить стало значительно веселее: теперь можно было не умирать от остеомиелита, родильной горячки, гангрены или сифилиса. За последующие девяносто лет человечество успело обзавестись внушительным арсеналом противомикробных препаратов и начать их активно использовать везде: от медицины до сельского хозяйства. И все бы хорошо, если бы не одно но: со временем антибиотики, которые призваны убивать бактерии или останавливать их рост, предотвращая развитие болезни, перестают работать. Некоторые микроорганизмы выживают после применения того или иного лекарства. Они мутируют и продолжают расти и размножаться, уже не встречая конкуренции со стороны других штаммов. К таким «суперзлодеям» от мира бактерий относятся, например, метициллинрезистентный золотистый стафилококк (рис. 1) или микобактерии туберкулеза со множественной лекарственной устойчивостью.
Рисунок 1. Нейтрофил обезвреживает метициллин-резистентную бактерию Staphylococcus aureus, фагоцитируя ее. Фото конфокального микроскопа, цвета условны. Подробнее о конфокальной микроскопии можно прочесть в материале «12 методов в картинках: микроскопия» [1].
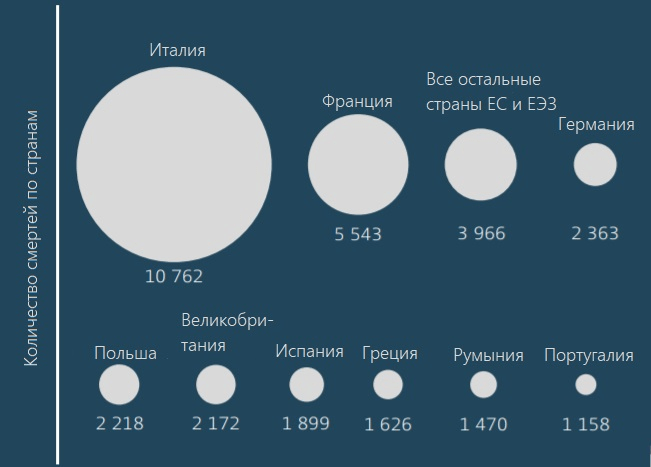
По данным комиссии, собранной британским министерством здравоохранения в 2014–2016 гг., ежегодно около 700 000 человек по всему миру умирает от бактериальных инфекций, которые вызваны невосприимчивыми к действию антибиотиков патогенами. К 2050-му эта цифра может вырасти до 10 миллионов человек в год [2]. А по данным за 2019 год, только в США и европейских странах суммарно от болезней, вызванных резистентными бактериями, умирает около 68 000 человек в год (рис. 2) [3], [4].
Рисунок 2. Количество смертей от болезней, вызванных резистентными к антибиотикам бактериями, в европейских странах по данным за 2015 год
О механизмах резистентности и ее передаче можно подробнее почитать в материалах [5] и [6].
Распространение резистентности: связь с уровнем потребления антибиотиков и влияние окружения
Многие исследования говорят в пользу существования прямой зависимости между увеличением потребления антибиотиков и распространением устойчивости бактерий к их действию [2–4], [7]. Помимо прямого влияния, когда из-за малых доз или недостаточно долгого применения лекарства бактерии быстро адаптируются к враждебной среде, существуют и косвенные «преимущества», которые дает устойчивым штаммам прием противомикробных препаратов: такие как устранение конкурентов в лице восприимчивых штаммов или подавление полезной микрофлоры, которая помогает организму справляться с инфекционной нагрузкой.
Иногда случается так, что потребление антибиотиков сокращается, а уровень устойчивости наоборот, только растет. Например, так произошло в Исландии 20 лет назад. В 2002 году было опубликовано исследование [8], согласно которому, несмотря на сокращение потребления противомикробных препаратов с 1,5 до 1,1 курса в год на одного ребенка (возрастом от одного года до шести лет), за пять лет распространенность устойчивых к пенициллину пневмококков выросла в двух наиболее удаленных от столицы регионах в четыре и в десять раз. Причем в десять раз она выросла там, где сокращение потребления антибиотиков было самым значительным по стране. Хотя в среднем за этот период уровень резистентности в Исландии действительно сократился: на 5%. Авторы исследования предположили, что из-за слабого коллективного иммунитета жители сельских регионов (рис. 3, 4) оказываются более уязвимыми к новым патогенам, которые сначала распространяются в крупных городах и только спустя время доходят до деревень. Можно было бы предположить, что свою роль сыграли и маленькие дозы лекарства или некорректная длительность терапии, однако, по данным исследования, все дети получали адекватное лечение.
Рисунок 3. Поселение Болунгарвик (исл. Bolungarvík), где зарегистрировали самый значительный рост резистентности при наиболее сильном снижении объема потребления антибиотиков.
Рисунок 4. Маяк Оусхоулавити (исл. Óshólaviti) в Болунгарвике. Фотограф: Герберт Ортнер, Вена (Herbert Ortner, Vienna).
Тем не менее исландский кейс остается скорее частным примером того, как на резистентность могут влиять и другие факторы, помимо объема потребления противомикробных препаратов. В целом же, прием антибиотиков остается одной из главных причин распространения устойчивости в мире [2–4].
К сожалению, даже если человек никогда не злоупотреблял антибиотиками, он может получить резистентную микрофлору от кого-то из своего непосредственного окружения, например, от родственников.
Исследование [9] на основе данных, полученных в 1998 году в двух деревнях штата Юта (рис. 5), показало, что вероятность получить как устойчивые, так и чувствительные штаммы растет с увеличением количества детей в семье. А прием антибиотиков ребенком увеличивает количество именно устойчивых бактерий у братьев и сестер.
Рисунок 5. Билборд на въезде в штат Юта со слоганом штата: Life Elevated («Возвышенная жизнь»)
В 2019 году израильские ученые показали, что прием матерями фторхинолонов (противомикробных лекарств широкого действия) повышал риск заражения резистентными штаммами не принимавших эти лекарства детей на 50% [10].
Бактерии распространяются не только в семьях, но и в других небольших сообществах, где люди тесно взаимодействуют, например в больницах. Так, в 2001 году другой исследовательский коллектив из Израиля подтвердил, что прием цефалоспоринов и амикацина (полусинтетического антибиотика группы аминогликозидов) в шести отделениях больницы был связан с повышенным риском заражения устойчивыми патогенами в течение последующих месяцев, в том числе и у пациентов, не принимавших эти антибиотики в течение предыдущего года. Причем у принимавших этот риск был выше 1,5–3 раза [11].
Распространение резистентности в больших сообществах
Второго ноября было опубликовано исследование [12] ученых Гарвардского университета, которое показало, что на степень распространения резистентности к антибиотикам среди населения одного региона существенно влияет уровень их потребления в соседних — точнее, в тех, которые интенсивнее всего с этим регионом взаимодействуют: например, если люди активно перемещаются между ними. Для описания таких ситуаций авторы статьи используют термин «спилловер-эффект» (от англ. to spill over — «выходить за пределы чего-либо, распространяться на другие области»; существительное spillover обозначает соответствующий процесс «распространения»).
Исследователи рассматривали данные о потреблении антибиотиков и распространенности устойчивости к ним в американских штатах и европейских странах. Они предположили, что чем два штата или две страны теснее взаимодействуют, тем меньше между ними разница в уровне резистентности к антибиотикам, и непосредственное влияние объема потребления антибиотиков на устойчивость будет ниже, чем в идеальной ситуации, когда регион полностью изолирован от других.
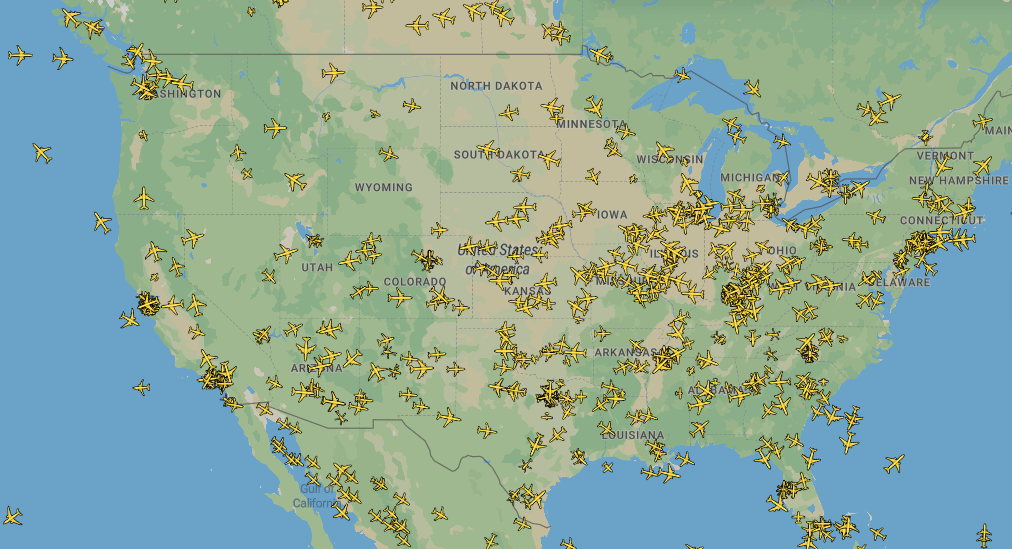
Чтобы проверить гипотезу, ученые сначала использовали математические модели, с помощью которых они делали численные предсказания того, насколько спилловер-эффект увеличится от усиления интенсивности взаимодействия сообществ. А затем они обратились к эмпирическим данным и соотнесли разницу в уровне резистентности внутри регионов с интенсивностью их взаимодействия друг с другом. Степень интенсивности определяли по данным о перелетах американскими и европейскими авиалиниями — ученые предположили, что чем меньше рейсов между регионами, тем слабее эти регионы взаимодействуют (рис. 6).
Рисунок 6. Карта авиаперелетов
В результате две математические модели, применявшиеся в исследовании, — WHN и D-type (см. «Расшифровки» в конце статьи), — подтвердили предположение, что у активно взаимодействующих между собой сообществ разница в уровне устойчивости ниже, чем у тех, которые взаимодействуют меньше. Конкретные величины зависят от выбора модели, однако согласно обеим, достаточно, чтобы было всего на 1% больше взаимодействий между сообществами, для сокращения разницы в уровне резистентности между ними на треть, а то и на 50% — опять же, зависит от выбора модели.
Исследователи рассматривали три пары патогенов и антибиотиков: «пневмококки и макролиды», «пневмококки и β-лактамы» и «кишечная палочка и фторхинолоны». Именно эти комбинации наиболее часто исследовали прежде.
Источники информации о потреблении антибиотиков и распространении устойчивости внутри регионов ученые распределили по трем группам: первые две включали в себя американские базы данных, а третья — данные по европейским странам.
Но в итоге было сформировано шесть датасетов вместо девяти: два убрали, потому что пришлось исключить данные по устойчивости пневмококков к β-лактамам в США — в предыдущих исследованиях на этих датасетах связь между объемом потребления антибиотиков и уровнем резистентности получила отрицательную точечную оценку. Кроме того, информация по потреблению фторхинолонов для США была только во втором наборе данных, так что для этой комбинации патогена и антибиотика собрали два датасета вместо трех, как у остальных (один европейский и один американский).
После попарного сравнения регионов, связь между интенсивностью взаимодействия и снижением зависимости уровня резистентности от объема потребления антибиотиков оказалась статистически значимой в четырех из шести датасетов. Иными словами, чем активнее люди перемещались между сообществами, тем меньшее влияние на распространенность устойчивости оказывал уровень потребления антибиотиков внутри каждого из них — значительную роль начинали играть соседи.
Ученые также сгруппировали все сообщества по парам и ранжировали список по степени интенсивности взаимодействия. Затем они сравнили первые 10% пар из начала с 10% пар с конца и выяснили, что для пар в начале рейтинга связь между объемом потребления антибиотиков и резистентностью в среднем на 50% слабее, чем для пар, которые взаимодействовали меньше всего.
О чем говорят эти данные? В первую очередь о том, что спилловер-эффект оказывает значимое влияние на распространение устойчивости бактерий к антибиотикам на уровне США и европейских стран. Из этого наблюдения следуют несколько важных выводов. Во-первых, бессмысленно проводить какую бы то ни было политику по сокращению потребления антибиотиков с целью снизить уровень резистентности, не учитывая ситуацию в соседних регионах. Во-вторых, куда эффективнее любые меры принимать не на уровне отдельной страны или штата, а на уровне более крупных регионов: США или Евросоюза целиком. В-третьих, массовые испытания антибиотиков могут привести к росту устойчивости внутри всей контрольной популяции (если она не полностью изолирована от испытуемых) за счет все того же спилловер-эффекта.
Однако на распространение устойчивости влияют не только потребление антибиотиков или путешествия между регионами. Свою роль могут играть и другие факторы. Так, исследование 2017 года показало, что устойчивость бактерий к антибиотикам растет с повышением среднегодовой температуры на 2–4% [13]. А согласно другому исследованию, уже 2018 года, на распространение резистентности влияют и социально-экономические факторы (рис. 7): чем лучше развита инфраструктура и выше расходы государства на здравоохранение, тем ниже уровень распространения устойчивости к антибиотикам [14]. Поэтому не исключено, что схожесть в уровне резистентности у тесно взаимодействующих регионов может быть связана с их схожестью в плане географии или на экономическом уровне. Также, различия в образе жизни между разными социальными группами (разделенными по гендерному, этническому или экономическому признакам) может оказаться очень высокой — возможно, сравнение между собой административных единиц не совсем корректно, и куда эффективнее было бы сравнивать разные социальных слои [15], [16]. Кроме того, в исследовании не учитывались другие способы передвижения между регионами, помимо авиаперелетов. Кажется, что на близкие расстояния люди могут чаще перемещаться наземным транспортом: поездами или автомобилями, поэтому небольшое количество рейсов между двумя регионами еще не говорит об их слабом взаимодействии. Поэтому для получения адекватной картины происходящего необходимо принимать во внимание даже такие «мелочи», как дорожная инфраструктура региона или стоимость перемещения разными видами транспорта.
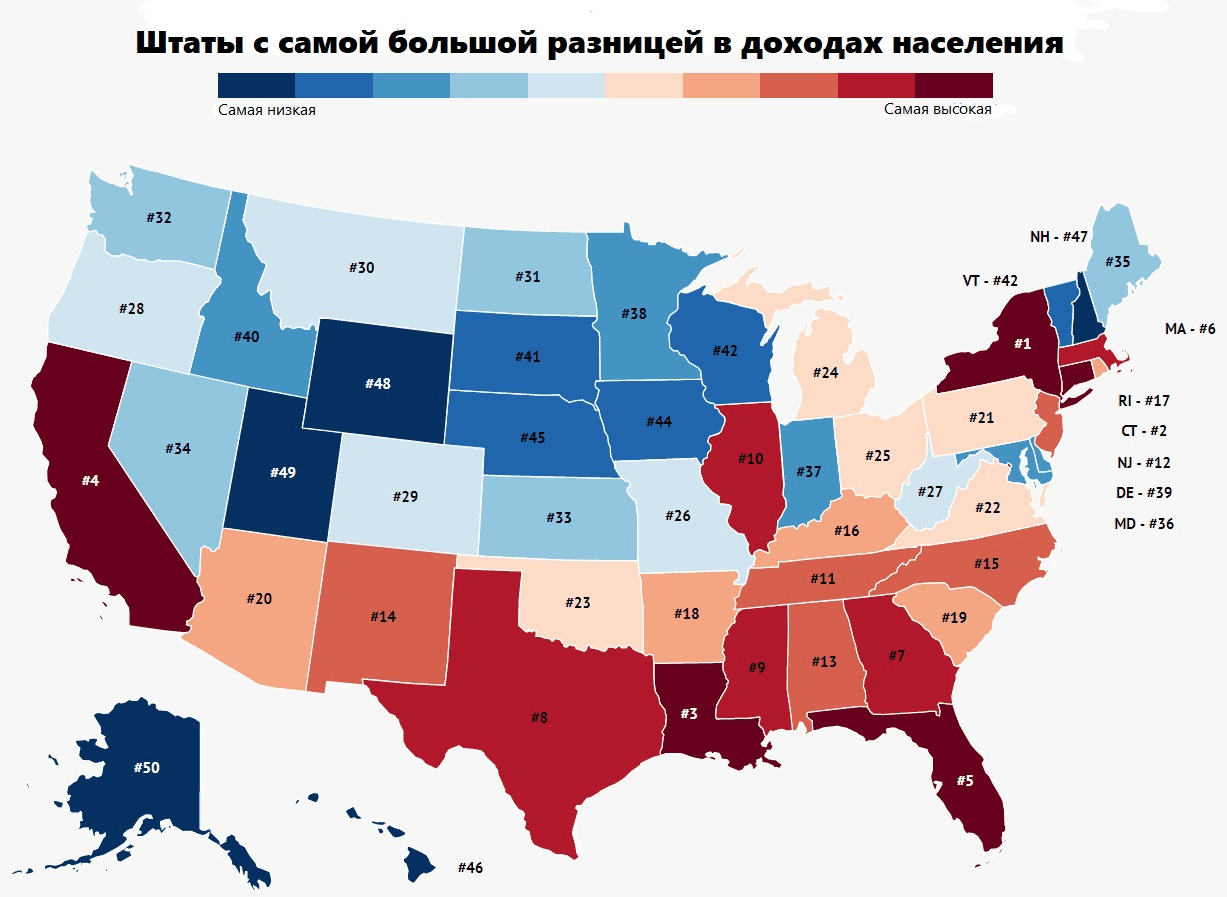
Рисунок 7. Разница в уровне доходов у американского населения по штатам. Экономическое неравенство сказывается и на сфере здравоохранения: у людей с высоким и низким доходом разные условия проживания, неравный доступ к медицине и др. Это может быть релевантно при анализе эпидемиологической обстановки региона.
К тому же, чтобы упростить себе задачу, в рамках исследования ученые исходили из того, что связь между объемом потребления антибиотиков и уровнем резистентности неоспорима, а изменения в распространенности устойчивости следуют за изменениями в объеме потребления антибиотиков в течение какого-то относительно небольшого и обозримого отрезка времени, хотя оба эти положения являются предметом активного изучения. Попарное сравнение сообществ также существенно упрощает задачу построения математической модели и обработки данных. Однако надо понимать, что на деле регионы взаимодействуют между собой одновременно, и это взаимодействие может иметь сезонный характер, или его интенсивность может меняться в зависимости от каких-то социальных, политических или экологических процессов. Так что теоретические выкладки, полученные исследователями, довольно грубы и позволяют составить только беглое представление о проблеме.
Борьба с резистентностью: поиск новых решений
Итак, мы выяснили: устойчивость к антибиотикам страшна не только тем, что ее уровень растет по мере того, как увеличиваются объемы потребления антибиотиков, но и своей способностью распространяться внутри сообществ любого размера: от семей до государств. Особенное беспокойство вызывает распространение мультилекарственной резистентности некоторых патогенов — защищенности сразу от нескольких групп препаратов. Борьба с угрозой идет в основном по двум фронтам: во-первых, человечество создает все новые и новые препараты, способные эффективно подавлять устойчивые микроорганизмы, а во-вторых, придумывает способы замедлить распространение резистентности (как правило, за счет снижения объемов потребления антибиотиков) и выиграть время. Однако эта гонка бесконечна (см. обзор [17]). Как долго мы сможем «убегать»?
Хорошо бы научиться «отключать» резистентность, чтобы уже известные антибиотики заново стали эффективным «оружием». Для этого нужно проанализировать механизмы передачи, хранения и реализации устойчивости к антибиотикам. О некоторых из уже существующих способов борьбы с мультилекарственной резистентностью можно почитать в материалах [6] и [18].
Рисунок 8. Инфографика по карбапенем-резистентным энтеробактериям из доклада Департамента здравоохранения и социальных служб США. Согласно ей, в 2017 году насчитывалось 13 100 случаев госпитализации пациентов с инфекциями, вызванными карбапенем-резистентными энтеробактериями, в том числе и 1100 случаев летального исхода, а соответствующие затраты на здравоохранение в Америке составили 130 миллионов долларов США. Карбапанем-резистентные энтеробактерии представляют серьезную проблему для пациентов медицинских учреждений: некоторые штаммы развили устойчивости почти ко всем распространенным антибиотикам, что вынуждает врачей прибегать к более токсичным или менее эффективным препаратам.
А здесь мы рассмотрим, как может решаться проблема мультилекарственной резистентности, на примере карбапенем-резистентных энтеробактерий (CRE, от Сarbapenem-Resistant Enterobacteriaceae). CRE могут поражать органы мочеполовой системы, кровь или легкие, но главная их опасность заключается в устойчивости к самым серьезным препаратам, направленным против них (рис. 8). Карбапенемы — антибиотики «последней надежды», то есть средства, которые применяются лишь в крайних ситуациях, когда ничто больше не помогает. Часто CRE устойчивы не только к карбапенемам, но и ко многим другим классам антибиотиков, что делает лечение от них чрезвычайно тяжелым [19]. В 2019 году Центр по контролю и профилактике заболеваний США поместил карбапенем-резистентных энтеробактерий среди пяти групп микроорганизмов, защиту от которых из-за угрозы здравоохранению необходимо разрабатывать в первую очередь [3].
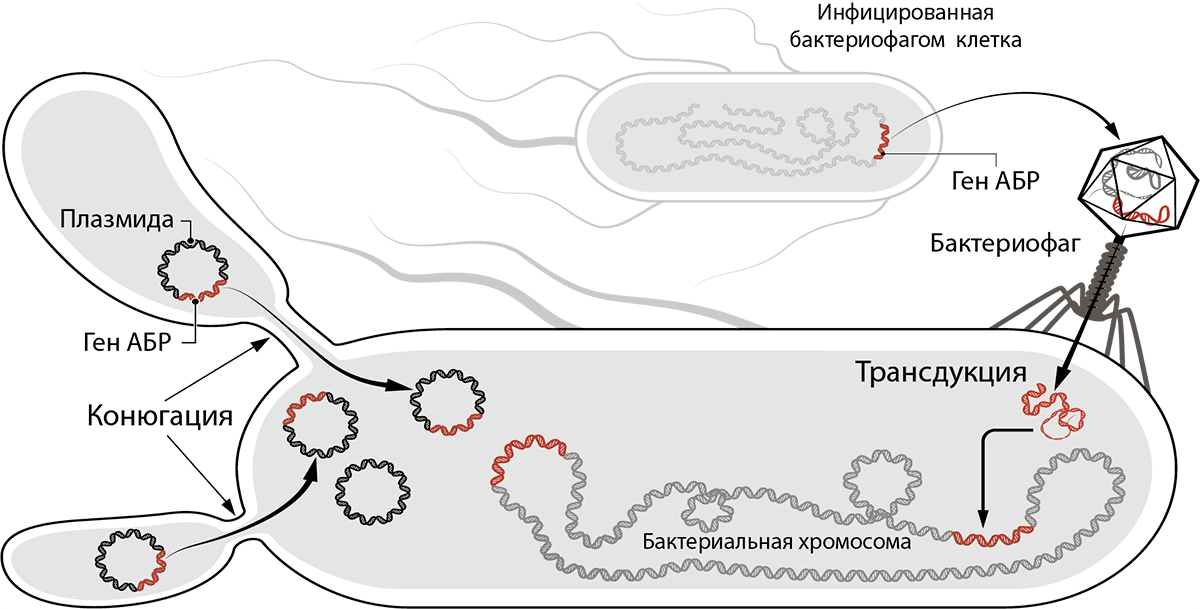
Рисунок 9. Как последовательности ДНК, ответственные за резистентность, попадают в клетку бактерии и хранятся в ней? Последовательности ДНК, кодирующие ферменты, которые обеспечивают резистентность, могут находиться в плазмидах — кольцевых ДНК внутри клеток бактерий, — передаваться в составе плазмид потомкам и родственникам при коньюгации. Еще такие последовательности ДНК могут передаваться из ДНК одной бактерии в ДНК другой путем трансдукции — переноса внутри вируса.
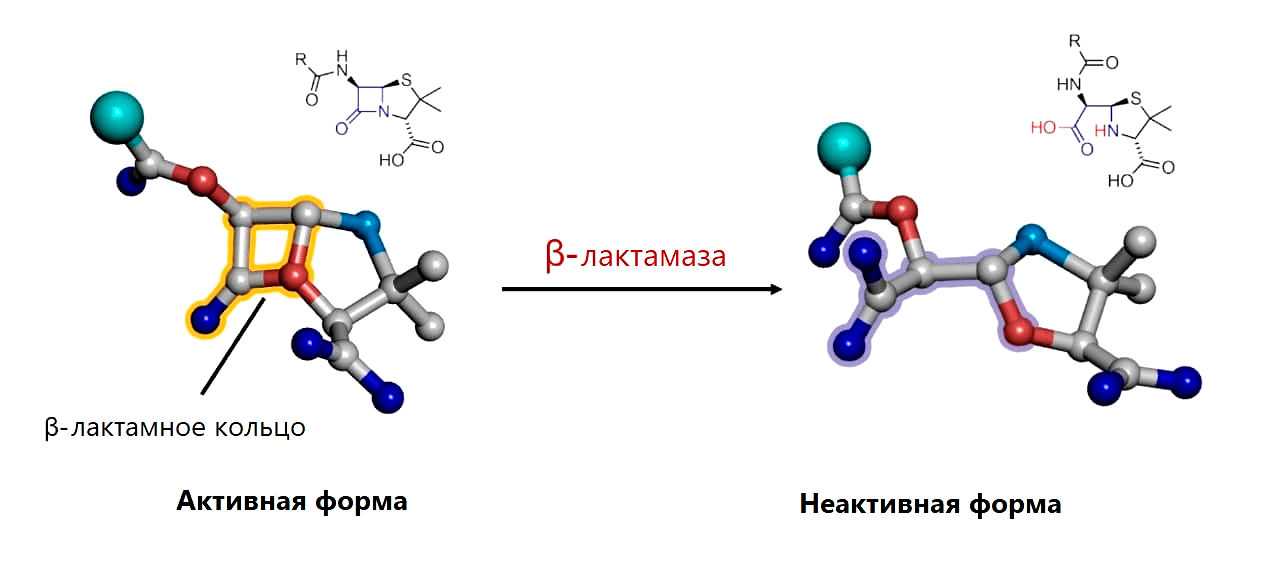
Устойчивость CRE работает по проверенной механике Докинза: резистентность переносится плазмидами устойчивости CRE (pCRE, CRE resistance plasmids), которые так и хочется назвать эгоистичными (рис. 9). Ведь карбапенем-резистентные энтеробактерии платят высокую цену за свою неуязвимость: если клетка утрачивает pCRE, то она погибает из-за токсина, который был закодирован в плазмиде и остался в клетке [20]. (До утраты pCRE с нее синтезировался неустойчивый антидот, блокирующий действие токсина.) pCRE очень большие, поэтому количество их копий в одной клетке CRE можно сосчитать по пальцам. Чтобы не потеряться во время деления, в pCRE закодирован механизм распределения по дочерним клеткам, как и множество ферментов, «обслуживающих» плазмиду, в которой заложено всё для ее распространения и выживания ее носителя, в том числе карбапенемаза — фермент, расщепляющий не только карбапенемы, но и многие другие β-лактамные антибиотики (рис. 10) [21]. Фермент, закодированный в плазмиде, «защищает» ее носителя. То есть в первую очередь опасность представляют не бактерии, а плазмида, поэтому методы борьбы должны быть направлены главным образом против нее.
Рисунок 10. Разрушение β-лактамного кольца β-лактамазой путем гидролиза связи между атомами углерода (серыми) и азота (голубыми)
Кэйтлин Зулауфа и Джеймс Кирби из Гарвардской медицинской школы нашли подходящие для вмешательства в работу плазмиды препараты среди тех, которые уже используются, но в иных целях, и попробовали объяснить их эффективность в борьбе с резистентными штаммами [22]. Это исследование кажется нам важным, поэтому ниже мы расскажем об экспериментах, проведенных коллегами-учеными, и данных, говорящих в пользу их открытия.
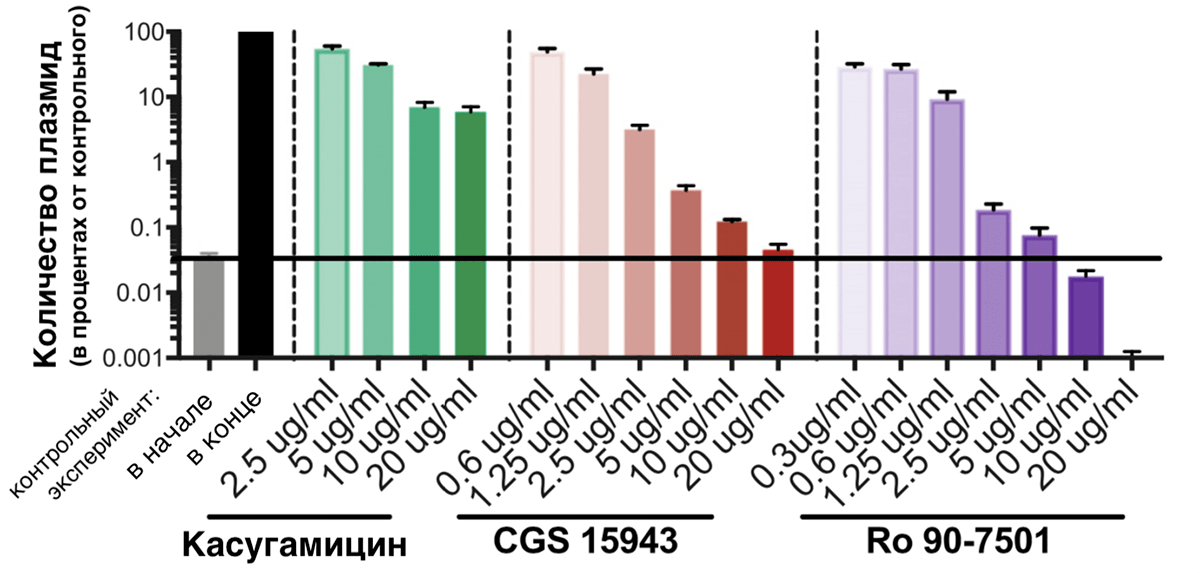
В результате скрининга более 12 000 биоактивных соединений исследователи выделили три, после воздействия которых копии pCRE не распространялись в культуре бактерий при делениях, что делало последующие поколения восприимчивыми к карбапенемам.
Наш первый кандидат — касугамицин — аминогликозидный антибиотик, который, судя по данным исследователей, мешает процессу синтеза белка RepE, играющего ключевую роль в размножении pCRE путем репликации (удвоения) [23]. То есть без RepE плазмида, скорее всего, не передастся новым поколениям бактерий. После воздействия касугамицина в течение 24 часов репликация pCRE случалась реже более чем в 10 раз (рис. 11), по сравнению с необработанными бактериями (более 90% потомков бактерий, резистентных еще сутки назад, утратили защиту). Однако даже во время применения максимальной в этом исследовании дозы касугамицина плазмиды все же размножались (их становилось больше на два порядка). Зафиксируем, что касугамицин не блокирует репликацию полностью, а лишь сильно замедляет ее.
Рисунок 11. Зависимость активности размножения плазмид в растущей бактериальной культуре от воздействия препаратов. По вертикальной шкале — количество плазмид бактерий после инкубирования при разных концентрациях препаратов, выраженное в процентах от количества плазмид в посевах в обычных условиях. Первые два столбца — контрольный эксперимент (без воздействия препаратов): серый столбец — количество в начале контрольного эксперимента; черный — в бактериях после обычных условий культивирования. Зеленые столбики — после культивирования при разных концентрациях касугамицина; красные столбики — после культивирования при разных концентрациях CGS 15943; фиолетовые столбики — после культивирования при разных концентрациях Ro 90-7501.
Наш второй кандидат — CGS 15943 (см. «Расшифровки» в конце статьи) — возможно, нарушает считывание последовательности RepE. В любом случае, он мешает репликации плазмид настолько, что их количество при максимальной дозе CGS 15943 почти не увеличилось (рис. 11). Отметим, что CGS 15943 способен почти полностью останавливать репликацию pCRE.
Третий кандидат — Ro 90-7501 (см. «Расшифровки» в конце статьи) — имеет самые впечатляющие результаты. Взглянув на рисунок 11, хочется назвать его «убийцей» pCRE. Дело в том, что Ro 90-7501 — интеркалятор ДНК, то есть соединение, которое встраивается между цепями ДНК, «ломая» ее структуру и мешая репликации. Только начиная исследование, ученые не хотели использовать интеркаляторы, потому что для человека целостность собственной ДНК не менее важна, чем для плазмиды целостность своей. Например, зафиксировано воздействие этого же Ro 90-7501 на клетки млекопитающих: он влияет на сборку фибрилл амилоида β42 (связанного с болезнью Альцгеймера) [24], на активность врожденного иммунитета [25] и ингибирует протеинфосфатазу 5 — фермент, важный в регуляции ключевых событий жизни клетки [26], [27]. Однако Ro 90-7501 оказался селективным к pCRE, и ученые изучили его особенно тщательно. Оговорив, что концентрация Ro 90-7501, при которой достигается максимальный антиплазмидный эффект, ниже токсичной для клеток млекопитающих почти в 30 раз [28].
Сравним препараты: CGS 15943 не имеет известных побочных эффектов для клеток человека, однако он и не истребляет плазмиды так, как это делает Ro 90-7501. То есть после окончания курса CGS 15943 резистентные патогены могут выжить и размножиться опять. Возможно, получится изменить последовательность Ro 90-7501 так, чтобы он перестал воздействовать на процессы в клетках млекопитающих. Однако обоим препаратам стоит «поучиться» у касугамицина проникать в клетки грамотрицательных бактерий (к которым относятся и энтеробактерии), видимо, для их применения в реальных условиях нужно разработать подходящий способ проникновения молекул препарата внутрь клетки.
Таким образом, использование каких-то из этих препаратов может привести нас к победе над опасными карбапенем-резистентными энтеробактериями. Ученым предстоит долгая и кропотливая работа по поиску или синтезу веществ, которые окажутся действенными в устранении описанного нами механизма резистентности.
Исследования, подобные этому, внушают надежду на то, что нам удастся не просто вечно бежать на шаг впереди, создавая препараты, к которым у бактерий еще не выработалась устойчивость, но и «поворачивать время вспять» — сопротивляться уже существующим механизмам резистентности, придумывая способы для непосредственной остановки их действия. И тогда пугающая цифра в 10 миллионов смертей в год никогда не станет реальностью.