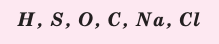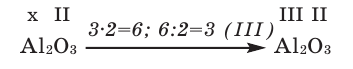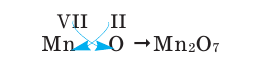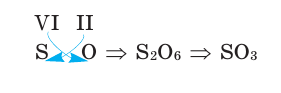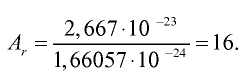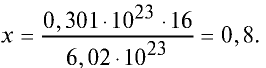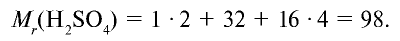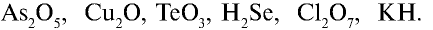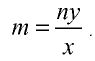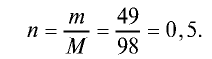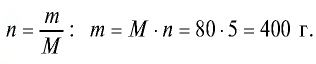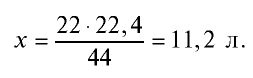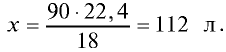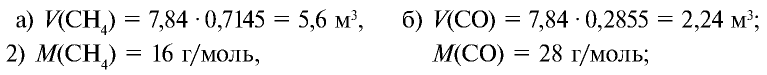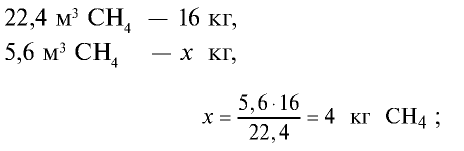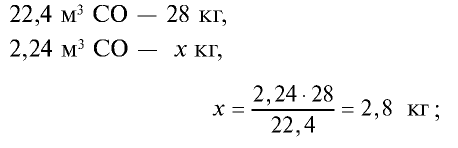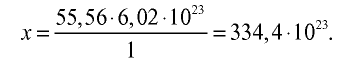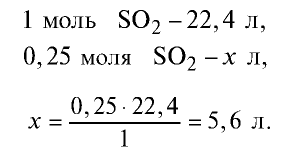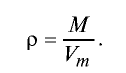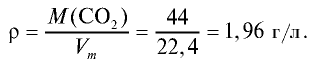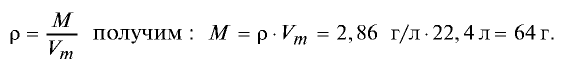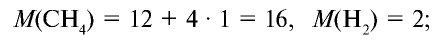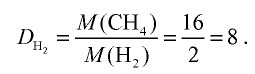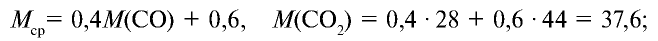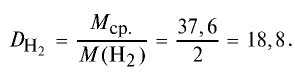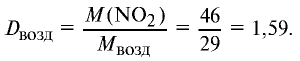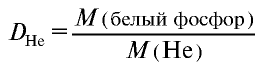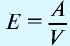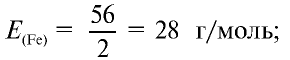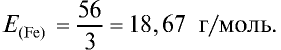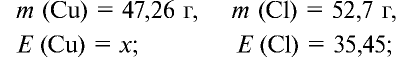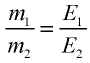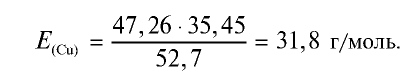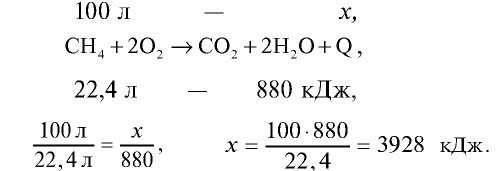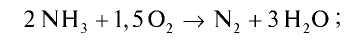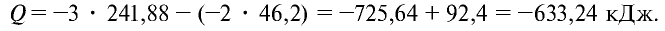Что значит умножение в химии
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
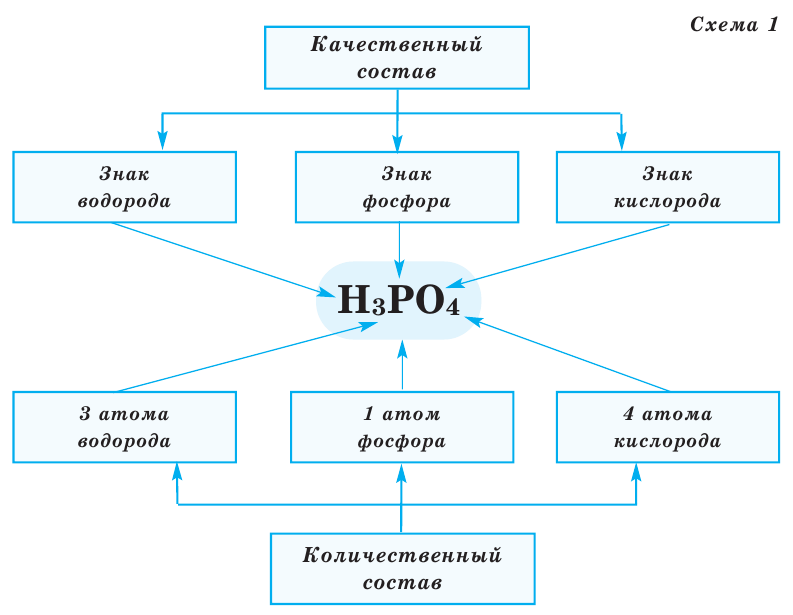
Химическая формула
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
H 2 SO 4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H 2 SO 4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10 −10 м и масса m = 19.94∙10 −27 кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
Иными словами, «всё познаётся в сравнении». Эталоном является двенадцатая часть атома Углерода. А ОАМ показывает ВО СКОЛЬКО РАЗ отличается масса элемента от эталона. Иначе можно объяснить: образцом сравнения является корзина, в которой содержится 12 яблок. Вся остальная численность, которая может содержаться в других корзинах (это может быть 10, 15, 5) будет сравниваться во сколько раз больше или меньше.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
Например: Ar(Mg) = 24,305
Относительная молекулярная масса (ОММ)
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.
Определим ОММ, например:
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797
32) и путём сложения вычисляем Mr(H2S).
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.
Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?
Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10 −23 г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙10 23 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 10 24 молекул хлора?
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)
Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г /моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 10 23 структурных единиц.
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
Связь количества вещества и объёма выражается в следующем виде:
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?
Как можно увидеть, количество вещества связывает три величины:
Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
Задача 7. Какую массу составляют 18.06 ∙10 23 молекул аммиака (NH3)?
Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?
Закон Авогадро и его следствия
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
Задача 9. Вычислите относительную плотность кислорода по воздуху
Относительная плотность кислорода по воздуху равна
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
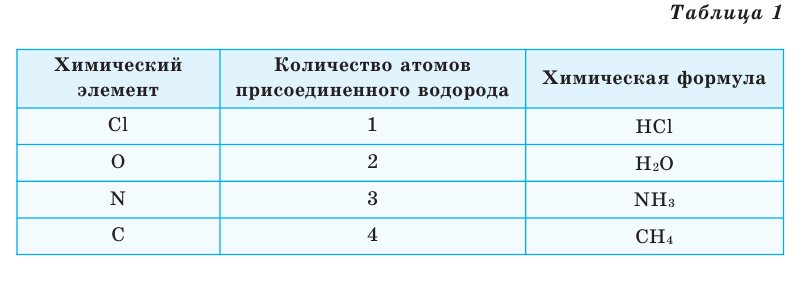
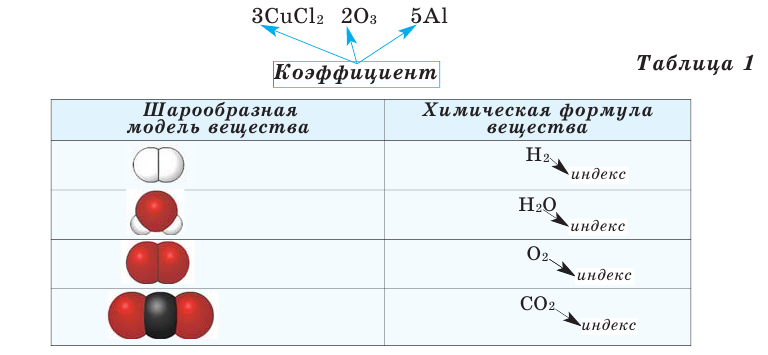
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
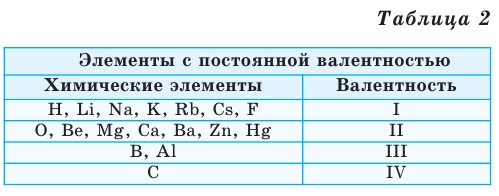
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
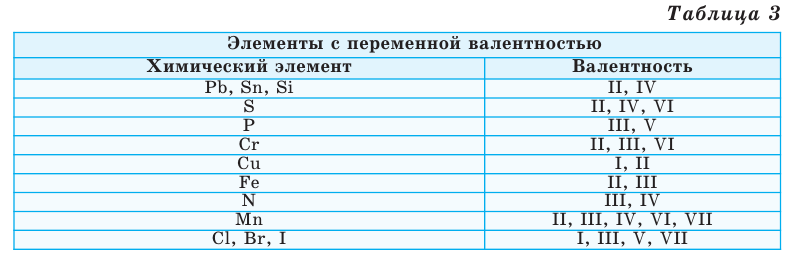
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 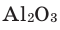
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
Химическая формула
Заполните таблицу. Как произносится химическая формула вещества?
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
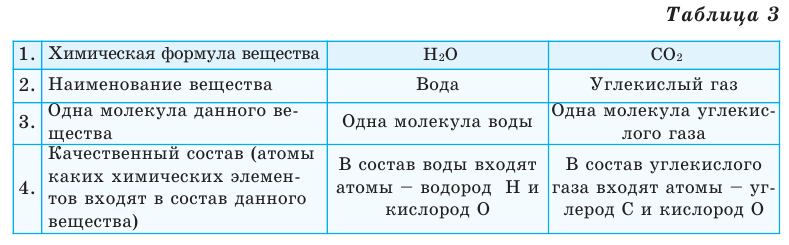
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза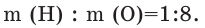
Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово «атом» в переводе с древнегреческого языка означает
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium («образующий воду»).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674• 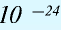

Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 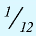
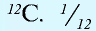
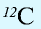

Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02• 
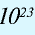
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 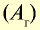 | Число атомов в 1 моле |
| Водород | Н | 1,674•  | 1,008 | 6,02• |
| Кислород | О | 26,567• | 15,999 | 6,02• |
| Углерод | С | 12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667• 
Решение. Единица массы 1 атома равна 1,66057• 
Ответ: 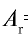
Пример №2
Какой будет масса (г) 0,301 • 
Решение. 6,02 • 
Тогда, если 6,02 • 

Определение химической формулы
Например: 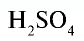
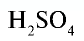
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (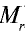
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (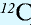
В 12 г углерода содержится 6,02• 
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 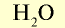 | 18 | 1 | 6,02• |
| Углекислый газ | 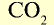 | 44 | 1 | 6,02• |
| Серная кислота | 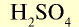 | 98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) 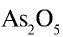
2) 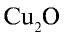
3) 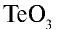
4) 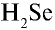
5) 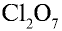
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 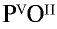
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в 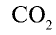
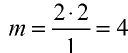
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 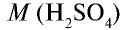
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество | 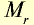 | Молярная масса, г/моль | Молярный объем, л | Число молекул |
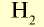 | 2 | 2 | 22,4 | 6,02• |
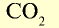 | 44 | 44 | 22,4 | 6,02• |
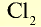 | 71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 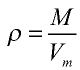
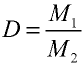
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 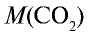
2) вычислим объем 22 г 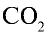
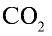
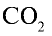
Ответ: 22 г 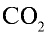
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
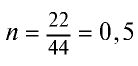
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(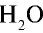
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 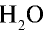
90г 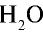
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т<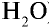
2) вычислим количество вещества в 1000 г воды:
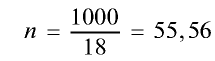
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02• 
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • 
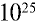
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г 
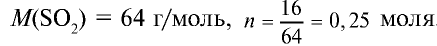
2) вычислим, какой объем займут 16 г (или 0,25 моля) 
Ответ: 16 г 
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении «Азот» в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(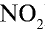
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
следует, что М(белый фосфор) = 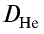
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: 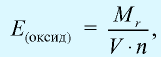

Эквивалентность оснований выражается формулой: 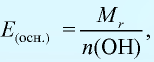
где 
Эквивалентность кислот выражается формулой: 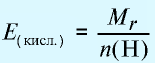

n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 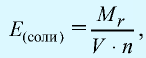

Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 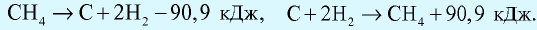
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования 
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.