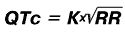Что значит удлинение корригированного qt интервала свыше 450 мс у взрослого
Удлинение интервала QT
Статья посвящена врождённому и приобретённому ЭКГ-синдрому удлинённого интервала QТ, а также Амиодарону, как наиболее частой медикаментозной причине данного состояния.
Синдром удлинения QT интервала представляет собой сочетание удлиненного интервала QT стандартной ЭКГ и угрожающих жизни полиморфных желудочковых тахикардий (torsade de pointes – «пируэт»). Пароксизмы желудочковых тахикардий типа «пируэт» клинически проявляются эпизодами потери сознания и нередко заканчиваются фибрилляцией желудочков, являющихся непосредственной причиной внезапной смерти.
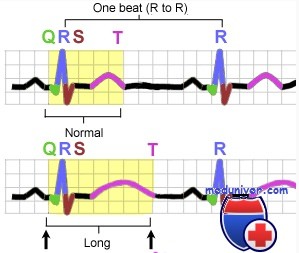
Длительность интервала QT зависит от частоты сердечных сокращений и пола пациента. Поэтому используют не абсолютную, а корригированную величину интервала QT (QTc), которую рассчитывают по формуле Базетта:
где: RR – расстояние между соседними зубцами R на ЭКГ в сек. ;
К = 0, 37 для мужчин и К = 0, 40 для женщин.
Удлинение интервала QT диагностируют в том случае, если длительность QTc превышает 0, 44 с.
Установлено, что как врожденные, так и приобретенные формы удлинения интервала QT являются предикторами фатальных нарушений ритма, которые, в свою очередь, приводят к внезапной смерти больных.
Так, отсутствует единое мнение о верхней границе нормальных значениях дисперсии корригированного интервала QT. По мнению одних авторов, предиктором желудочковых тахиаритимий является QTcd более 45, другие исследователи предлагают считать верхней границей нормы QTcd 70 мс и даже 125 мс.
Cуществуют два наиболее изученных патогенетических механизма аритмий при синдроме удлиненного QT интервала. Первый – механизм «внутрисердечных нарушений» реполяризации миокарда, а именно, повышенная чувствительность миокарда к аритмогенному эффекту катехоламинов. Второй патофизиологический механизм – дисбаланс симпатической иннервации (снижение правосторонней симпатической иннервации вследствие слабости или недоразвития правого звездчатого ганглия). Эта концепция подтверждается на моделях с животными (удлинение QT интервала после правосторонней стеллэктомии) и результатами левосторонней стеллэктомии в лечении резистентных форм удлинения QT интервала.
Частота выявления удлинения интервала QT у лиц с пролапсами митрального и/или трикуспидального клапанов достигает 33%. По мнению большинства исследователей, пролапс митрального клапана является одним из проявлений врожденной дисплазии соединительной ткани. Среди других проявлений «слабости соединительной ткани» – повышенная растяжимость кожи, астенический тип телосложения, воронкообразная деформация грудной клетки, сколиоз, плоскостопие, синдром гипермобильности суставов, миопия, варикозное расширение вен, грыжи. Рядом исследователей выявлена взаимосвязь увеличенной варибельности QT интервала и глубины пролабирования и/или наличия структурных изменений (миксоматозная дегенерация) створок митрального клапана. Одной из главных причин формирования удлинения интервала QT у лиц с пролапсом митрального клапана является генетически предопределенный или приобретенный дефицит магния
Приобретенное удлинение QT интервала может возникнуть при атеросклеротическом или постинфарктном кардиосклерозе, при кардиомиопатии, на фоне и после перенесенного мио– или перикардита. Увеличение дисперсии интервала QT (более 47 мс) может также являться предиктором развития аритмогенных синкопальных состояний у больных с аортальными пороками сердца.
Удлинение интервала QT может наблюдаться и при синусовой брадикардии, атриовентрикулярной блокаде, хронической цереброваскулярной недостаточности и опухоли головного мозга. Острые случаи удлинения интервала QT могут также возникать при травмах (грудной клетки, черепно–мозговых).
Автономная нейропатия также увеличивает величину интервала QT и его дисперсию, поэтому данные синдромы имеют место у больных сахарным диабетом I и II типов.
Удлинение интервала QT может иметь место при нарушениях электролитного баланса с гипокалиемией, гипокальциемией, гипомагнезиемией. Подобные состояния возникают под воздействием многих причин, например, при длительном приеме диуретиков, особенно петлевых (фуросемид). Описано развитие желудочковой тахикардии типа «пируэт» на фоне удлинения интервала QT cо смертельным исходом у женщин, находившихся на малобелковой диете с целью снижения массы тела.
Общеизвестно удлинение QT при острой ишемии миокарда и инфаркте миокарда. Стойкое (более 5 дней) увеличение интервала QT, особенно при сочетании с ранними желудочковыми экстрасистолами, прогностически неблагоприятно. У этих пациентов выявлено значительное (в 5–6 раз) повышение риска внезапной смерти.
В патогенезе удлинения QT при остром инфаркте миокарда, несомненно, играет роль гиперсимпатикотония, именно этим многие авторы объясняют высокую эффективность b–блокаторов у этих пациентов. Кроме того, в основе развития данного синдрома лежат и электролитные нарушения, в частности, дефицит магния. Результаты многих исследований свидетельствуют о том, что до 90% больных с острым инфарктом миокарда имеют дефицит магния. Выявлена также обратная корреляционноая взаимосвязь уровня магния в крови (сыворотке и эритроцитах) с величиной интервала QT и его дисперсией у пациентов с острым инфарктом миокарда.
У пациентов с идиопатическим пролапсом митрального клапана лечение следует начинать с применения пероральных препаратов магния (Магнерот по 2 табл. 3 раза в день в течение не менее 6 месяцев), поскольку тканевой дефицит магния считают одним из основных патофизиологических механизмов формирования как синдрома удлинения QT интервала, так и «слабости» соединительной ткани. У этих лиц после лечения препаратами магния не только нормализуется величина интервала QT, но и уменьшаются глубина пролабирования створок митрального клапана, частота желудочковых экстрасистол, выраженность клинических проявлений (синдрома вегетативной дистонии, геморрагических симптомов и др. ). Если лечение пероральными препаратами магния через 6 месяцев не оказало полного эффекта показано добавление b–блокаторов.
Другой важной причной удлинёния интервала QT является приём специальных медикаментов, одним из таких препаратов, чаще всего используемых в клинической практике является Амиодарон (Кордарон).
Амиодарон относится к III классу антиаритмических препаратов (класс ингибиторов реполяризации) и обладает уникальным механизмом антиаритмического действия, так как помимо свойств антиаритмиков III класса (блокада калиевых каналов) он обладает эффектами антиаритмиков I класса (блокада натриевых каналов), антиаритмиков IV класса (блокада кальциевых каналов) и неконкурентным бета-блокирующим действием.
Кроме антиаритмического действия у него имеются антиангинальный, коронарорасширяющий, альфа- и бета-адреноблокирующий эффекты.
Антиаритмические свойства:
— увеличение продолжительности 3-ей фазы потенциала действия кардиомиоцитов, в основном за счет блокирования ионного тока в калиевых каналах (эффект антиаритмика III класса по классификации Вильямса) ;
— уменьшение автоматизма синусового узла, приводящее к уменьшению частоты сердечных сокращений;
— неконкурентная блокада альфа- и бета- адренергических рецепторов;
Описание
— замедление синоатриальной, предсердной и атриовентрикулярной проводимости, более выраженное при тахикардии;
— отсутствие изменений проводимости желудочков;
— увеличение рефрактерных периодов и уменьшение возбудимости миокарда предсердий и желудочков, а также увеличение рефрактерного периода атриовентрикулярного узла;
— замедление проведения и увеличение продолжительности рефрактерного периода в дополнительных пучках предсердно-желудочкового проведения.
Другие эффекты:
— отсутствие отрицательного инотропного действия при приеме внутрь;
— снижение потребления кислорода миокардом за счет умеренного снижения периферического сопротивления и частоты сердечных сокращений;
— увеличение коронарного кровотока за счет прямого воздействия на гладкую мускулатуру коронарных артерий;
— поддержания сердечного выброса за счет снижения давления в аорте и снижения периферического сопротивления;
— влияние на обмен тиреоидных гормонов: ингибирование превращения Тз в Т4 (блокада тироксин-5-дейодиназы) и блокирование захвата этих гормонов кардиоцитами и гепатоцитами, приводящее к ослаблению стимулирующего влияния тиреоидных гормонов на миокард.
Терапевтические эффекты наблюдаются в среднем через неделю после начала приема препарата (от нескольких дней до двух недель). После прекращения его приема амиодарон определяется в плазме крови на протяжении 9 месяцев. Следует принимать во внимание возможность сохранения фармакодинамического действия амиодарона в течение 10-30 дней после его отмены.
Каждая доза амиодарона (200 мг) содержит 75 мг йода.
Показания к применению
Профилактика внезапной аритмической смерти у больных группы высокого риска
Для больных хронической сердечной недостаточностью амиодарон является единственным разрешенным к применению антиаритмиком. Это связано с тем, что прочие препараты у этой категории пациентов или увеличивают риск внезапной середечной смерти, или угнетают гемодинамику.
При наличии ишемической болезни сердца препаратом выбора является соталол, на 1/3 являющийся, как известно, b–адреноблокатором. Но при его неэффективности в нашем распоряжении вновь только амиодарон. Что же касается больных с артериальной гипертензией, то из их числа, в свою очередь, выделяются пациенты с выраженной и невыраженной гипертрофией левого желудочка. Если гипертрофия невелика (в Руководстве 2001 г. – толщина стенки левого желудочка менее 14 мм), препарат выбора – пропафенон, но при его неэффективности – как всегда, амиодарон (наряду с соталолом). Наконец, при выраженной гипертрофии левого желудочка, как и при хронической сердечной недостаточности, амиодарон – единственный возможный препарат.
Источник: Остроумова О. Д. Удлинение интервала QT. РМЖ №18 2001 С 750-54
Статья добавлена 11 апреля 2015 г.
Что значит удлинение корригированного qt интервала свыше 450 мс у взрослого
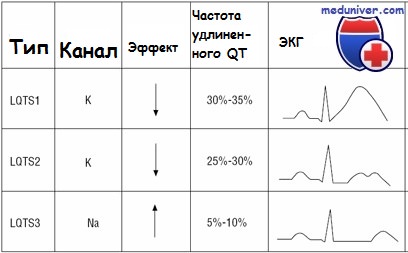
Этиология и встречаемость синдрома удлиненного QT. Синдромы удлиненного QT (LQT) — разнородная панэтническая группа нарушений, получивших название каналопатий, поскольку они вызываются дефектами в ионных каналах сердца. Распространеность синдромов удлиненного QT приблизительно 1 на 5000-7000 человек. Большинство случаев удлиненного QT вызвано мутациями в пяти известных генах ионных каналов сердца (KCNQ1, KCNH2, SCN5A, KCNE1.KKCNE2).
Генетика, лежащая в основе синдромов удлиненного QT, сложна. Во-первых, существует локусная гетерогенность. Наиболее частый из синдромов удлиненного QT, аутосомно-доминантный синдром Романо-Уорда (MIM №192500), вызван преимущественно мутациями в двух локусах, KCNQ1 и KCNH2, а также содействующим третьим локусом, SCN5A.
Во-вторых, разные мутантные аллели в одном и том же локусе могут вызывать два различающихся синдрома удлиненного QT, синдром Романо-Уорда и аутосомно-рецессивный синдром Джервелла-Ланге-Нильсена (MIM №220400).
Патогенез синдрома удлиненного QT
Синдром удлиненного QT вызывается дефектами реполяризации в клетках сердца. Реполяризация — управляемый процесс, требующий баланса между направленным внутрь клетки потоком натрия и кальция и из клетки — калия. Дисбаланс удлиняет или укорачивает длительность потенциала действия, вызывающего соответственно удлинение или сокращение интервала QT на электрокардиограмме.
Большинство случаев синдрома удлиненного QT вызваны мутациями с утратой функции в генах, кодирующих субъединицы или полные белки каналов калия (названия этих генов начинаются с KCN). Эти мутации уменьшают реполяризацию, тем самым продлевая потенциал действия клетки и уменьшая порог для последующей деполяризации.
У других пациентов с синдромом удлиненного QT мутации с усилением функции в гене натриевого канала, SCN5A, ведут к повышенному притоку натрия, вызывая аналогичные изменения потенциала действия и эффекты реполяризации.
Фенотип и развитие синдрома удлиненного QT
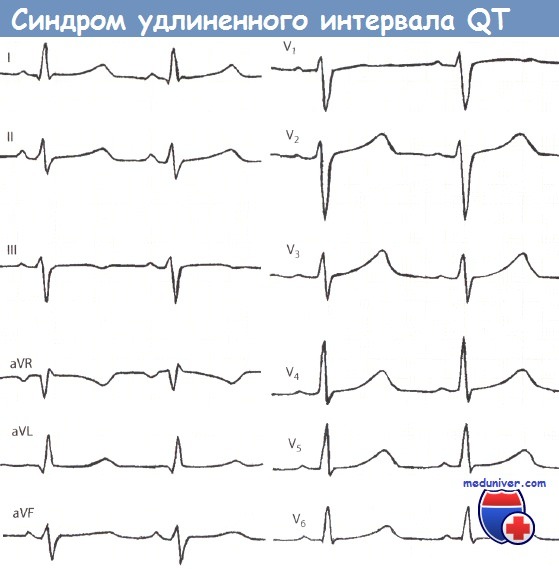
Синдромы удлиненного QT характеризуются удлинением интервала QT и аномалиями зубца Т на электрокардиограмме, включая тахиаритмию и полиморфную желудочковую тахикардию. Желудочковая тахикардия характеризуется изменением амплитуды и скручиванием комплекса QRS. Полиморфная желудочковая тахикардия связана с удлиненным интервалом QT и обычно заканчивается спонтанно, но может упорствовать и прогрессировать в фибрилляцию желудочков.
При самом частом варианте синдрома удлиненного QT, Романо-Уорда, обмороки из-за аритмии сердца — наиболее частый признак. Если ребенок остается недиагностированным или не получает лечение, синкопальные состояния повторяются и могут быть летальными в 10-15% случаев. Тем не менее от 30 до 50% индивидуумов с синдромом удлиненного QT никогда не имеют синкопальных симптомов. Сердечные эпизоды чаще всего встречаются в возрасте от 9 до 12 лет, уменьшаясь со временем.
Эпизоды могут происходить в любом возрасте, если спровоцированы приемом медикаментов, удлиняющих интервал QT. Нефармакологические триггеры сердечных событий при синдроме Романо-Уорда отличаются в зависимости от ответственного гена. Триггеры LQT1 — обычно адренергические стимулы, включая физическую нагрузку и внезапные эмоции (испуг). Лица с LTQ2 находятся в риске как при нагрузке, так и в покое, а также при слуховых стимулах, например звонок будильника или телефона. Пациенты с LQT3 имеют эпизоды с замедлением сердечных показателей в периоды отдыха и сна.
Кроме того, 40% случаев LQT1 проявляют себя до 10-летнего возраста; симптоматика появляется до 10 лет жизни только в 10% случаев LTQ2 и крайне редко при LQT3. Синдром LQT5 редкий, о течении и триггерах известно меньше.
Синдром удлиненного QT имеет неполную пенетрантность, как с точки зрения электрокардиографических аномалий, так и синкопальных эпизодов. До 30% больных могут иметь интервалы QT, перекрывающиеся с нормальными колебаниями. Варьирующаяся экспрессия заболевания может происходить как внутри семьи, так и между семьями. Из-за неполной пенетрантности для точного диагноза у членов семьи часто необходима нагрузочная электрокардиография.
Синдромы удлиненного QT могут сопровождаться дополнительными данными при медицинском осмотре. Например, синдром Джервелла-Ланге-Нильсена (MIM №220400) характеризуется глубокой врожденной нейросенсорной глухотой в сочетании с синдромом удлиненного QT. Это аутосомно-рецессивное заболевание, вызываемое также определенными мутациями в одном из двух генов (KCNQ1 и KCNE1), участвующих в развитии аутосомно-доминантного синдрома Романо-Уорда.
Гетерозиготные родственники пациентов с синдромом Джервелла-Ланге-Нильсена не глухие, но имеют 25% риск развития синдрома удлиненного QT.
Особенности фенотипических проявлений синдрома удлиненного QT:
• Длинный QTc (>470 мс для мужчин, >480 мс для женщин)
• Тахиаритмия
• Синкопальные эпизоды
• Внезапная смерть
Лечение синдрома удлиненного QT
Лечение синдрома удлиненного QT направлено на предотвращение синкопальных эпизодов и остановки сердца. Оптимальное лечение зависит от идентификации ответственного в данном случае гена. Например, терапия b-адреноблокаторами до начала симптомов — наиболее эффективный метод при LQT1 и, отчасти, при LQT2, но его эффективность при LQT3 незначительна. При лечении b-адреноблокаторами необходимо тщательно проверять соответствие возрастным дозам, не прерывать прием лекарственных средств.
Для больных с брадикардией могут оказаться необходимыми водители ритма; может потребоваться доступ к внешним дефибрилляторам. Имплантируемые кардиовертеры-дефибрилляторы могут быть необходимыми больным с LQT3 или некоторым лицам с синдромом удлиненного QT, для которых проблематична терапия бета-адреноблокаторами, например больным бронхиальной астмой, депрессией или сахарным диабетом, а также пациентам с остановкой сердца в анамнезе.
Некоторые лекарства, например антидепрессивный препарат амитриптилин, фенилэфрин и дифенилгидрамин, или противогрибковые лекарства, включая флуконазол и кетоназол, должны быть исключены из-за их действия, удлиняющего интервал QT или повышения симпатико-тонии. Исключают также виды деятельности и спорта, связанные с интенсивной физической нагрузкой и эмоциональным стрессом.
ЧСС 90 ударов в минуту, длительность QT 0,42 с, относительная длительность интервала QT составляет 128%, откорректированный интервал QTC удлинен и равен 0,49 с.
Риски наследования синдрома удлиненного QT
Лица с синдромом Романо-Уорда имеют 50% шанс родить ребенка с унаследованными мутациями в гене. Поскольку частота новых мутаций низкая, большинство больных имеют пораженного родителя (хотя, возможно, бессимптомного). Чрезвычайно важны и могут оказаться жизнесохраняющими подробный семейный анамнез и тщательная кардиологическая оценка членов семьи. Риск повторения для сибсов пациентов с синдромом Джервелла-Ланге-Нильсена — 25%, как и ожидается при аутосомно-рецессивном заболевании. Пенетрантность изолированного синдрома удлиненного QT без глухоты для гетерозиготных носителей синдрома Джервелла-Ланге-Нильсена — 25%.
Пример синдрома удлиненного QT. А.Б., 30-летняя женщина с синдромом удлиненного QT (LQT), обратилась в генетическую клинику вместе с мужем, поскольку они планируют беременность. Пара хочет знать риск повторения этого заболевания у детей и подходящие методы генетического тестирования и пренатальной диагностики. Женщина также обеспокоена потенциальным влиянием беременности на ее собственное здоровье. Диагноз синдрома LQT установлен в начале третьего десятилетия жизни, когда она проходила обследование после внезапной смерти ее 15-летнего брата. В целом она — здоровый человек с нормальным слухом, отсутствием дисморфических признаков.
У нее никогда не было обморочных состояний. Впоследствии электрокардиографические данные подтвердили диагноз синдрома у нее, ее отца и одной из теток по отцу. Молекулярное тестирование выявило миссенс-мутацию в гене KCNH2, ранее описанную в других семьях с синдромом Романо-Уорда, тип LQT2.
Первоначально пациентка получала бета-адреноблокаторы, но ее кардиологи решили, что низкая эффективность b-адреноблокаторов при LQT2 и летальный случай у ее брата оправдывают имплантацию кардиовертера-дефибриллятора как ей, так и ее пораженным родственникам. Пациентка — первый человек в ее семье, проходящий генетическое консультирование по синдрому удлиненнго QT.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Удлинение QT
Здравствуйте! Помогите разобраться пожалуйста. Страдаю ВСД уже более 10 лет. Постоянно нахожусь в тревожном состоянии. За этот месяц участились приступы трепыхания в груди. Решила поставить холтер. Как раз в эти сутки, когда висел холтер, самочувствие было норрмальное, только ночь толком пришлось не спать, вставала к ребёнку. Из-за этого повышен пульс в течении суток. А сегодня ночью опять была бессоница, спать хочется, а мозг не отключается и ощущение, что останавливается дыхание и я потом делаю вдохи и дискомфорт в области сердца. Сегодня опять за пол дня уже пару раз по несколько секунд трепыхается в груди, головная боль, и холодные руки. На эхо сердца регургитация 1 ст. Остальное всё в пределах нормы. Заключение холтера: Ритм: синусовый. ЧСС: мин. 62 уд.мин, макс 169 уд.мин, средняя 90 уд.мин. Среднее значение ЧСС в дн период 97уд.мин, в ночной: 80уд.мин. Циркадный индекс:1,21 ( норма 1.24-1.44). Наджелудочковая эктопическая активность: 2 мономорфорные монотопные экстрасистолы. Нарушение проводимости: в 13.02 эпизод АВ блокад 1 степени с паузой 1546 мсек ( в этот момент я проснулась). Изменения сегмента ST не выявлено. Интервал QT : на минимальной: ЧСС 58уд,мин=418 мс. QTc (расч. вручную)= 411 мс. Максимальное значение QT:независимо от ЧСС 390-530, QTс не должен превышатьу взрослых 440 мс. Вариабельность ритма сердца: в пределах возрастной нормы. Подскажите пожалуйста, очень переживаю за интервал QT. Ведь он доходит до 530. Следует ли дальше загоняться и обследоваться, может ещё стоит на сутки поставить холтер или всё таки мне дорога к психотерапевту. Повторюсь, что на момент холтерского иследования, ночь приходилось вставать до 5 утра, из за этого пульс учащённый, а самое чувствие в тот день было нормальное, трепыхания ни одного не ощутила. Страдаю ПМС, реагирую на погоду. Буду очень благодарна за ваш ответ. Заранее благодарю!
Удлинение интервала QT
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
МГМСУ имени Н.А. Семашко
В последние годы в клинической кардиологии проблема удлинения интервала QT привлекает к себе пристальное внимание отечественных и зарубежных исследователей как фактор, приводящий к внезапной смерти. Установлено, что как врожденные, так и приобретенные формы удлинения интервала QT являются предикторами фатальных нарушений ритма, которые, в свою очередь, приводят к внезапной смерти больных.
Синдром удлинения QT интервала представляет собой сочетание удлиненного интервала QT стандартной ЭКГ и угрожающих жизни полиморфных желудочковых тахикардий (torsade de pointes – «пируэт»). Пароксизмы желудочковых тахикардий типа «пируэт» клинически проявляются эпизодами потери сознания и нередко заканчиваются фибрилляцией желудочков, являющихся непосредственной причиной внезапной смерти.
Длительность интервала QT зависит от частоты сердечных сокращений и пола пациента. Поэтому используют не абсолютную, а корригированную величину интервала QT (QTc), которую расчитывают по формуле Базетта
где: RR – расстояние между соседними зубцами R на ЭКГ в сек.;
К = 0,37 для мужчин и К = 0,40 для женщин.
Удлинение интервала QT диагностируют в том случае, если длительность QTc превышает 0,44 с.
Наиболее распространенная методика выявления дисперсии QT – регистрация стандартной ЭКГ в течение 3–5 минут при скорости записи 25 мм/час. Используют также холтеровское мониторирование ЭКГ, что позволяет анализировать колебания дисперсии QTс (QTcd) в течение суток. Однако ряд методологических аспектов данного метода находятся в стадии разработки. Так, отсутствует единое мнение о верхней границе нормальных значениях дисперсии корригированного интервала QT. По мнению одних авторов, предиктором желудочковых тахиаритимий является QTcd более 45, другие исследователи предлагают считать верхней границей нормы QTcd 70 мс и даже 125 мс.
Cуществуют два наиболее изученных патогенетических механизма аритмий при синдроме удлиненного QT интервала. Первый – механизм «внутрисердечных нарушений» реполяризации миокарда, а именно, повышенная чувствительность миокарда к аритмогенному эффекту катехоламинов. Второй патофизиологический механизм – дисбаланс симпатической иннервации (снижение правосторонней симпатической иннервации вследствие слабости или недоразвития правого звездчатого ганглия). Эта концепция подтверждается на моделях с животными (удлинение QT интервала после правосторонней стеллэктомии) и результатами левосторонней стеллэктомии в лечении резистентных форм удлинения QT интервала.
Этиология синдрома удлинения интервала QT
У здоровых людей в покое имеется лишь незначительная вариабельность процессов реполяризации, поэтому дисперсия интервала QT минимальна. Причины удлинения интеврала QT условно делят на 2 группы – врожденные и приобретенные [1].
Врожденные формы синдрома удлинения QT интервала становяся одной из причин смерти детей. Смертность при нелеченных врожденных формах данного синдрома достигает 75%, при этом 20% детей умирают в течение года после первой потери сознания и около 50% – в первое десятилетие жизни. К врожденным формам синдрома удлиненения интервала QT относят синдром Gervell и Lange–Nielsen и синдром Romano–Ward. Синдром Gervell и Lange–Nielsen – редкое заболевание, имеет аутосомно–рецессивный тип наследования и представляет собой сочетание врожденной глухонемоты с удлинением интервала QT на ЭКГ, эпизодами потери сознания и нередко заканчивается внезапной смертью детей в первое десятилетие жизни. Синдром Romano–Ward имеет аутосомно–доминантный тип наследования с популяционной частотой 1:10 000–1:15 000 и пенетрантностью гена 0,9. Он имеет сходную клиническую картину: нарушения ритма сердца, в ряде случаев с потерей сознания на фоне удлиненного интервала QT у детей без нарушения слуха и речи.
Частота выявления удлиненного интервала QT у детей школьного возраста с врожденной глухонемотой на стандартной ЭКГ достигает 44%, при этом почти у половины из них (около 43%) отмечались эпизоды потери сознания и пароксизмы тахикардии. При суточном мониторировании ЭКГ почти у 30% из них зарегистрированы пароксизмы наджелудочковой тахикардии, примерно у каждого пятого – «пробежки» желудочковой тахикардии типа «пируэт» [1].
Для диагностики врожденных форм синдрома удлинения QT интервала в случае пограничного удлинения и/или отсутствия симптомов предложен набор диагностических критериев. «Большие» критерии – это удлинение QT интервала более 0,44 мс, наличие в анамнезе эпизодов потери сознания и наличие синдрома удлинения QT интервала у членов семьи. «Малые» критерии – это врожденная нейросенсорная тугоухость, эпизоды альтернации Т–волн, медленный сердечный ритм (у детей) и патологическая желудочковая реполяризация. Наибольшее диагностическое значение имеют достоверное удлинене QT–интервала, пароксизмы тахикардии torsade de pointes и эпизоды синкопе.
Врожденный синдром удлинения интервала QT – генетически гетерогенное заболевание, в которое вовлечены более 5 различных локусов хромосом. Установлено, как минимум, 4 гена, определяющих развитие врожденного удлинения интервала QT.
Наиболее распространенной формой синдрома удлинения интервала QT у молодых лиц является сочетание данного синдрома с пролапсом митрального клапана. Частота выявления удлинения интервала QT у лиц с пролапсами митрального и/или трикуспидального клапанов достигает 33% [2]. По мнению большинства исследователей, пролапс митрального клапана является одним из проявлений врожденной дисплазии соединительной ткани. Среди других проявлений «слабости соединительной ткани» – повышенная растяжимость кожи, астенический тип телосложения, воронкообразная деформация грудной клетки, сколиоз, плоскостопие, синдром гипермобильности суставов, миопия, варикозное расширение вен, грыжи. Рядом исследователей выявлена взаимосвязь увеличенной варибельности QT интервала и глубины пролабирования и/или наличия структурных изменений (миксоматозная дегенерация) створок митрального клапана. Одной из главных причин формирования удлинения интервала QT у лиц с пролапсом митрального клапана является генетически предопределенный или приобретенный дефицит магния [1, 2].
Приобретенное удлинение QT интервала может возникнуть при атеросклеротическом или постинфарктном кардиосклерозе, при кардиомиопатии, на фоне и после перенесенного мио– или перикардита. Увеличение дисперсии интервала QT (более 47 мс) может также являться предиктором развития аритмогенных синкопальных состояний у больных с аортальными пороками сердца.
Отсутствует единое мнение о прогностическом значении увеличения дисперсии интервала QT у больных постинфарктным кардиосклерозом: часть авторов выявили у этих пациентов четкую взаимосвязь между увеличением продолжительности и дисперсии интервала QT (на ЭКГ) и риском развития пароксизмов желудочковой тахикардии, другие исследователи подобной закономерности не обнаружили. В тех случаях, когда у пациентов с постинфарктным кардиосклерозом в покое величина дисперсии интервала QT не увеличина, следует оценить этот параметр при проведении пробы с физической нагрузкой. У больных постинфарктным кардиосклерозом оценку дисперсии QT на фоне нагрузочных проб многие исследователи считают более информативной для верификации риска желудочковых нарушений ритма.
Удлинение интервала QT может наблюдаться и при синусовой брадикардии, атриовентрикулярной блокаде, хронической цереброваскулярной недостаточности и опухоли головного мозга. Острые случаи удлинения интервала QT могут также возникать при травмах (грудной клетки, черепно–мозговых).
Автономная нейропатия также увеличивает величину интервала QT и его дисперсию, поэтому данные синдромы имеют место у больных сахарным диабетом I и II типов.
Удлинение интервала QT может иметь место при нарушениях электролитного баланса с гипокалиемией, гипокальциемией, гипомагнезиемией. Подобные состояния возникают под воздействием многих причин, например, при длительном приеме диуретиков, особенно петлевых (фуросемид). Описано развитие желудочковой тахикардии типа «пируэт» на фоне удлинения интервала QT cо смертельным исходом у женщин, находившихся на малобелковой диете с целью снижения массы тела.
QT интервал может удлиняться при применении терапевтических доз ряда лекарственных средств, в частности, хинидина, новокаинамида, производных фенотиазина. Удлинение электрической систолы желудочков может наблюдаться при отравлении лекарствами и веществами, оказывающими кардиотоксическое действие и замедляющими процессы реполяризации. Например пахикарпин в токсических дозах, ряд алкалоидов, которые блокируют активный транспорт ионов в клетку миокарда, а также оказывают ганглиоблокирующее действие. Известны также случаи удлинения интервала QT при отравлениях барбитуратами, фосфороорганическими инсектицидами, ртутью.
Представляют интерес данные о суточных ритмах дисперсии QT, полученных при холтеровском мониторировании ЭКГ. Обнаружено достоверное увеличение дисперсии интервала QT в ночные и ранние утренние часы, что, возможно, и повышает риск внезапной смерти в это время у больных с различными сердечно–сосудистыми заболеваниями (ишемия и инфаркт миокарда, сердечная недостаточность и др.). Полагают, что увеличение дисперсии интервала QT в ночные и утренние часы связано с повышенной симпатической активностью в данное время суток.
Общеизвестно удлинение QT при острой ишемии миокарда и инфаркте миокарда. Стойкое (более 5 дней) увеличение интервала QT, особенно при сочетании с ранними желудочковыми экстрасистолами, прогностически неблагоприятно. У этих пациентов выявлено значительное (в 5–6 раз) повышение риска внезапной смерти.
При развитии острой ишемии миокарда также достоверно повышается дисперсия интервала QT. Установлено, что дисперсия интервала QT увеличивается уже в первые часы острого инфаркта миокарда. Отсутствует единое мнение о величине дисперсии интервала QT, которое является четким предиктором внезапной смерти у больных острым инфарктом миокарда [3]. Установлено, что при передних инфарктах миокарда дисперсия более 125 мс – прогностически неблагоприятный фактор, свидетельствующий о высоком риске летального исхода. Ряд авторов выявили еще более значительное повышение дисперсии QT при реперфузии (после коронарной ангиопластики). Однако другие исследователи, наоборот, обнаружили уменьшение дисперсии QT во время реперфузии у больных острым инфарктом миокарда, а увеличение дисперсии QT отметили в тех случаях, когда реперфузия не была достигнута. Поэтому некоторые авторы рекомендуют использовать снижение дисперсии QT интервала в качестве маркера успешной реперфузии. У больных с острым инфарктом миокарда также нарушается циркадный ритм дисперсии QT: она повышена в ночные и утренние часы, что повышает риск внезапной смерти в это время суток.
В патогенезе удлинения QT при остром инфаркте миокарда, несомненно, играет роль гиперсимпатикотония, именно этим многие авторы объясняют высокую эффективность b–блокаторов у этих пациентов. Кроме того, в основе развития данного синдрома лежат и электролитные нарушения, в частности, дефицит магния. Результаты многих исследований свидетельствуют о том, что до 90% больных с острым инфарктом миокарда имеют дефицит магния. Выявлена также обратная корреляционноая взаимосвязь уровня магния в крови (сыворотке и эритроцитах) с величиной интервала QT и его дисперсией у пациентов с острым инфарктом миокарда [1].
Прежде всего следует устранить этиологические факторы, которые привели к удлинению интервала QT в тех случаях, где это возможно. Например, следует отменить или уменьшить дозу медикаментов (диуретики, барбитураты и др.), которые могут увеличивать продолжительность или дисперсию интервала QT. Адекватное лечение сердечной недостаточности, согласно международным рекомендациям, и успешное хирургическое лечение пороков сердца также приведет к нормализации величины интервала QT. Известно, что у больных с острым инфарктом миокарда фибринолитическая терапия уменьшает величину и дисперсию интервала QT (хотя и не до нормальных величин). Среди групп препаратов, которые способны влиять не патогенез данного синдрома, особо следует отметить две группы – b–блокаторы и препараты магния.
Врожденный синдром удлинения интервала QT
Пациентам с синдромами Romano–Ward и Gervell и Lange–Nielsen необходим постоянный прием b–блокаторов в сочетании с пероральными препаратами магния (Магния оротат по 2 табл. 3 раза в день). Левосторонняя стеллэктомия и удаление 4 и 5 грудных ганглиев может быть рекомендовано пациентам, у которых фармакологическая терапия не дала положительного результата. Имеются сообщения об успешном сочетании лечения b–блокаторами с имплантацией искусственного водителя ритма сердца [1].
Для пациентов, нуждающихся в неотложной терапии, препаратом выбора является пропранолол внутривенно (со скоростью 1 мг/мин, максимальная доза – 20 мг, средняя доза – 5–10 мг под контролем АД и ЧСС) либо болюсное внутривенное введение 5 мг пропранолола на фоне внутривенного капельного введения магния сульфата (Кормагнезина) (из расчета 1–2 г сульфата магния (200–400 мг магния) в зависимости от массы тела (в 100 мл 5% раствора глюкозы в течение 30 мин).
У пациентов с идиопатическим пролапсом митрального клапана лечение следует начинать с применения пероральных препаратов магния (Магнерот по 2 табл. 3 раза в день в течение не менее 6 месяцев), поскольку тканевой дефицит магния считают одним из основных патофизиологических механизмов формирования как синдрома удлинения QT интервала, так и «слабости» соединительной ткани. У этих лиц после лечения препаратами магния не только нормализуется величина интервала QT, но и уменьшаются глубина пролабирования створок митрального клапана, частота желудочковых экстрасистол, выраженность клинических проявлений (синдрома вегетативной дистонии, геморрагических симптомов и др.). Если лечение пероральными препаратами магния через 6 месяцев не оказало полного эффекта показано добавление b–блокаторов.
Приобретенный синдром удлинения интервала QT
Должны быть отменены все препараты, способные удлинить QT интервал. Необходима коррекция электролитов сыворотки крови, особенно калия, кальция, магния. В ряде случаев этого бывает достаточно для нормализации величины и дисперсии интервала QT и профилактики желудочковых нарушений ритма.
При остром инфаркте миокарда фибринолитическая терапия и b–блокаторы уменьшают величину дисперсии интервала QT [3]. Эти назначения, согласно международным рекомендациям, являются обязательными у всех больных острым инфарктом миокарда с учетом стандартных показаний и противопоказаний.
Однако даже при адекватном ведении пациентов с острым инфарктом миокарда у немалой части из них величина и дисперсия QT интервала не достигают нормальных величин, следовательно, сохраняется риск внезапной смерти. Поэтому активно изучается вопрос об эффективности применения препаратов магния в острой стадии инфаркта миокарда. Длительность, дозировки и способы введения препаратов магния у этих больных окончательно не установлены. Имеются следующие схемы: внутривенное введение Кормагнезина–400 из расчета 0,5–0,6 г магния в 1 час в течение первых 1–3х суток с последующим переходом на пероральный прием Магнерота (2 табл. 3 раза в течение не менее 4–12 недель). Имеются данные, что у больных острым инфарктом миокарда, получавших подобную терапию, отмечены нормализация величины и дисперсии интервала QT и частоты желудочковых нарушений ритма [1].
При купировании желудочковых тахиаритмий у пациентов с приобретенными формами удлинения интервала QT в схему лечения рекомендуется также добавление внутривенное капельное введение Кормагнезина из расчета 2–4 г сульфата магния (400–800 мг магния) в 100 мл 5% раствора глюкозы в течение 30 минут. В случае необходимости возможно его повторное введение [1].
Таким образом, удлинение интервала QT является предиктором фатальных нарушений ритма и внезапной кардиогенной смерти как у больных с сердечно–сосудистыми заболеваниями (в том числе с острым инфарктом миокарда), так и у лиц с идиопатическими желудочковыми тахиаритмиями. Своевременная диагностика удлинения QT и его дисперсии, в том числе при холтеровском мониторировании ЭКГ и при проведении нагрузочных проб, позволят выделить группу больных с повышенным риском развития желудочковых аритмий, синкопальных состояний и внезапной смерти. Эффективными средствами профилактики и лечения желудочковых нарушений ритма сердца у больных с врожденными и приобретенными формами синдрома удлинения интервала QT являются b–блокаторы в сочетании с препаратами магния.
Магнерот (торговое название)
1. Шилов А.М., Мельник М.В., Санодзе И.Д. Диагностика, профилактика и лечение синдрома удлинения QT интервала. // Методические рекомендации – Москва, 2001 – 28с.
2. Степура О.Б., Мельник О.О., Шехтер А.Б., Пак Л.С., Мартынов А.И. Результаты применения магниевой соли оротовой кислоты «Магнерот» при лечении больных с идиопатическим пролапсом митрального клапана. // Российские медицинские вести, 1999, №2, С.74–76.
3. Макарычева О.В., Васильева Е.Ю., Радзевич А.Э., Шпектор А.В. Динамика дисперсии QT при остром инфаркте миокарда и ее прогностическое значение // Кардиология – 1998 – №7 – С.43–46.