Что значит таргетная терапия
Таргетная терапия
Что такое таргетная терапия?
Таргетная терапия – это специальные лекарства, которые уничтожают определенные типы раковых клеток. Они воздействуют исключительно на вещества, благодаря которым некоторые виды онкологии растут и распространяются по организму.
Название метода происходит от английского слова «target» – цель или мишень. Именно так он и работает – точно против измененных тканей.
Чем таргетная терапия отличается от химиотерапии?
Подобные вещества, так же как и другие используемые для лечения рака лекарства, технически считаются химиотерапией, но принцип их действия отличается:
Как работает таргетная терапия?
Таргетные препараты предназначены для воздействия на определенные вещества в раковых клетках: избыток некоторых белков, а также соединения или изменения генов, которые отсутствуют в нормальных тканях.
Такие лекарства умеют:
Виды таргетной терапии
Существует несколько типов препаратов, каждый из которых выполняет определенную задачу.
Ингибиторы ангиогенеза: блокируют образование новых кровеносных сосудов, которые необходимы новообразованию для питания и быстрого роста – например, бевацизумаб, применяющийся при нескольких видах рака.
Моноклональные антитела: доставляют в опухолевую клетку молекулы, которые ее убивают. Одни их виды называют таргетной терапией, поскольку у них есть конкретная цель в онкологической клетке, которую они стремятся найти и атаковать. Другие действуют как иммунотерапия, стимулирующая иммунную систему и помогающая ей обнаруживать онкологию и бороться с ней. К таким лекарствам относят трастузумаб, работающий при некоторых типах новообразований молочной железы, и цетуксимаб, назначающийся пациентам с опухолями прямой кишки, легких, головы и шеи.
Ингибиторы протеасом: нарушают нормальную работу клеток, что приводит к их гибели. Их примером является бортезомиб, применяющийся при множественной миеломе – заболевании кроветворной системы.
Ингибиторы сигнальной трансдукции: блокируют активность молекул, передающих сигналы между клетками. Так работает препарат иматиниб, применяющийся при некоторых типах хронической лейкемии – поражении костного мозга, приводящем к образованию измененных клеток крови.
Высококвалифицированные специалисты Онкоцентра «Лапино-2» проводят любое противораковое лечение, включая таргетное – без очередей, задержек и потерь времени.
Как принимают таргетную терапию?
На сегодняшний день существует несколько форм, в которых выпускаются подобные препараты. Их можно принимать внутрь, как обычные таблетки, капсулы или сиропы, либо внутривенно.
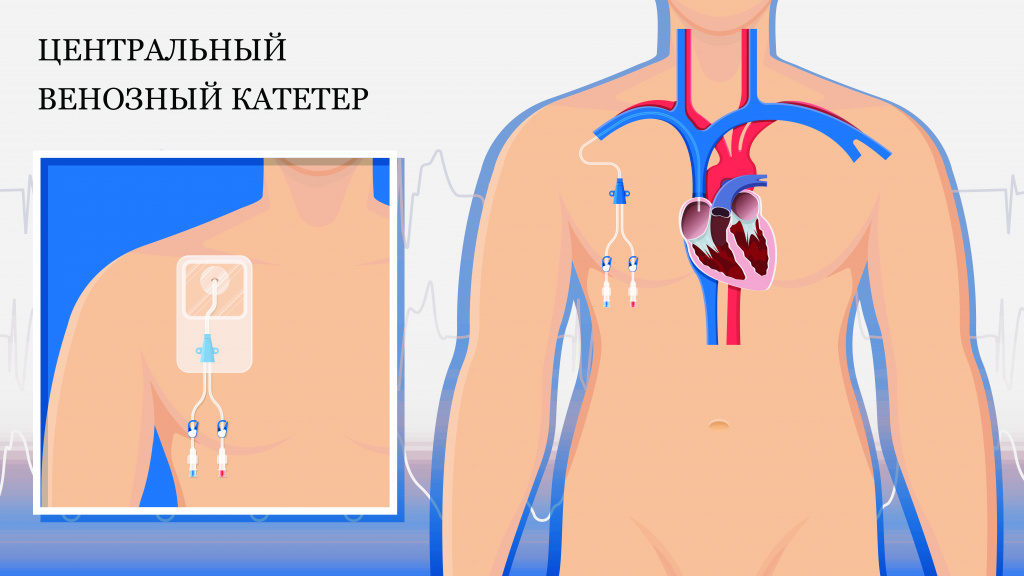
Лекарства доставляют в организм через обычный катетер – тонкую мягкую пластиковую трубку в кровеносном сосуде, или центральный венозный, так называемый порт – устанавливаемое под кожу устройство. Они вводятся специалистом за несколько минут или часов.
Оральная таргетная терапия обычно принимается по четкому графику дома. Каждый пациент получает четкие инструкции о том, сколько, когда и как это нужно делать. Дозы средства рассчитываются таким образом, чтобы в организме постоянно присутствовало необходимое количество данных веществ, уничтожающих раковые клетки.
Любой малейший сбой или отклонение от схемы может повлиять на эффективность лечения.
О каждом пропуске или задержке в приеме препарата нужно сообщить врачу, который решит, как действовать в данной ситуации.
Порты для таргетной и химиотерапии
Центральный венозный катетер, или порт – удобное решение для онкобольных, которым нужно регулярно получать внутривенное лечение и сдавать кровь. С течением времени состояние их сосудов ухудшается из-за постоянных проколов, а попытки введения препаратов превращаются в пытку как для пациентов, так и для медицинского персонала.
Практически незаметное устройство, обычно устанавливаемое под кожу чуть ниже ключицы, эту проблему решает – его обладатели не испытывают проблем со сдачей анализов и доставкой в организм препаратов.
Преимуществ у портов много: они позволяют сократить количество уколов, избежать дискомфорта при проведении химио- или таргетной терапии, и уменьшить риски попадания препаратов на кожу, а значит и ее раздражения.
К их минусам можно отнести вероятность засорения катетера, появление в нем сгустков крови, его перекручивание либо смещение. Избежать неприятных последствий не сложно – достаточно строго следовать инструкциям по очистке, тщательно мыть руки, стараться избегать по нему ударов и не заниматься контактными видами спорта.
Побочные эффекты таргетной терапии
Несмотря на то, что таргетные препараты работают против раковых клеток и практически не повреждают здоровые, после их приема могут возникнуть побочные эффекты. Они встречаются не у всех пациентов и отличаются от «побочек» обычной химиотерапии, которая воздействует на все ткани тела.
Большая часть неприятных последствий проходит после окончания лечения, но поскольку многие вещества изобретены совсем недавно, долгосрочные последствия их приема еще изучены не полностью.
Проблемы с кожей
Самая распространенная из них – сыпь, обычно возникающая голове, лице, шее, груди и верхней части спины.
Чаще всего она начинается с покраснения и припухлостей на первых же неделях лечения, а примерно через месяц кожа покрывается корками, становится пересушенной и красной. У некоторых людей появляются круглые, плоские или выпуклые пятна или гнойные прыщи.
Сыпь вызывает зуд и жжение и нередко приводит к заметному изменению внешности, но обычно полностью проходит примерно через месяц после отмены таргетных препаратов.
Сухость, приводящая к ломкости, зуду, шелушению и даже трещинам – еще одна распространенная проблема, которая возникает практически у всех пациентов, получающих лечение на протяжении полугода.
Некоторые вещества могут вызвать покраснение и болезненность кутикулы, а также появление вокруг ногтей на руках и ногах отечных красных язв, которые нередко инфицируются.
Ладонно-подошвенный синдром – поражение кожи на ладонях и подошвах стоп, связан со многими препаратами для лечения рака, включая химио- и некоторые виды таргетной терапии. Его причина до сих пор точно не известна – возможно, все дело в повреждении крошечных кровеносных сосудов в конечностях или окружающих их тканей. Обычно он развивается в течение первых 2-6 недель лечения, а его первыми симптомами становятся повышенная чувствительность, покалывание или онемение. Затем пострадавшие области опухают, краснеют, как при солнечном ожоге, шелушатся, трескаются и покрываются волдырями.
Применение некоторых средств может привести к ухудшению качества волос – их сухости, ломкости, истончению и появлению залысин.
У части пациентов кожа или волосы темнеют или приобретают желтоватый оттенок.
Кроме того, возможно пересыхание, покраснение и ощущение жжения в области век и глаз.
При появлении сыпи или любых других проблем с кожей необходимо сразу же сообщить об этом врачу-онкологу, поскольку при отсутствии правильного лечения у пациента могут развиться инфекции, требующие отсрочки или даже прекращения терапии.
Другие побочные эффекты целевого лечения похожи на последствия стандартной «химии». К ним относят тошноту и рвоту, диарею или запоры, образование язв во рту, одышку – ощущение нехватки воздуха, кашель, усталость, головную боль, выпадение волос, повреждение печени, почек и щитовидной железы, а также аллергические реакции.
Таргетная терапия различных видов рака
Данные препараты подходят не для всех пациентов – они помогают только в том случае, если в раковых клетках человека присутствуют определенные изменения. Перед назначением лечения врачи проводят биопсию – изымают небольшую частичку новообразования и передают ее в лабораторию, где она тщательно исследуется. Если специалистам удается найти особенности опухоли, для которых уже созданы лекарства, их применяют – часто одновременно с химиотерапией или другими видами вмешательства.
Таргетная терапия рака гортани
Для лечения некоторых запущенных форм онкологии горла и гортани используется Цетуксимаб (Эрбитукс), блокирующий EGFR – белок, который помогает опухолевым клеткам быстро расти. Его можно комбинировать с лучевой или химиотерапией.
Таргетная терапия рака желчных протоков
На сегодняшний день при данном типе онкологии используется 2 типа препаратов:
Таргетная терапия немелкоклеточного рака легкого
Для пациентов с немелкоклеточной онкологией легких создано множество таргетных препаратов:
Таргетная терапия рака молочной железы
Примерно у 1 из 5 женщин с раком груди опухолевые клетки содержат на своей поверхности слишком много стимулирующего их рост белка – HER2. Эти HER2-положительные новообразования быстро развиваются и распространяются по организму. Для их лечения применяются:
Примерно 2 из 3 случаев рака молочной железы чувствительны к гормонам – веществам, которые создаются нашими железами, через кровоток попадают в органы и сообщают им, как действовать – работать или отдыхать, выделять что-то или поглощать. В таких ситуациях применяется гормональная терапия:
Олапариб (Линпарза) и Талазопариб (Талценна): блокируют белки PARP, необходимые для восстановления поврежденной ДНК, что часто приводит к гибели раковых клеток.
Сацитузумаб говитекан: моноклональное антитело, присоединенное к химиотерапевтическому препарату. Лекарство работает в случае избытка в опухоли белка Trop-2, помогающего ей быстро расти и распространяться по организму.
Таргетная терапия рака печени
Для пациентов с раком печени есть несколько типов таргетных препаратов:
Таргетная терапия рака пищевода
При лечении рака пищевода используется несколько типов таргетных препаратов.
Некоторые типы опухолей содержат слишком много белка HER2, который способствует быстрому росту онкологических клеток. Такие заболевания называются HER2-положительными. Против них можно применять:
Таргетная терапия рака поджелудочной железы
Для лечения онкологии поджелудочной железы используются:
Таргетная терапия рака почки
Врачи применяют 2 типа таргетных препаратов для лечения рака почки. Их назначают пациентам с запущенным заболеванием для снижения скорости разрастания опухоли или уменьшения ее размеров.
Таргетная терапия рака предстательной железы
При лечении онкологии простаты используются Рукабариб (Рубрака) и Олапариб (Линпарза) – так называемые ингибиторы PARP. Данные лекарства не позволяют восстанавливаться поврежденной ДНК в клетках новообразований, что приводит к их гибели.
Таргетная терапия саркомы матки
Пазопаниб (Вотриент): назначается при лейомиосаркоме – опасной для жизни опухоли гладкой мускулатуры матки, которая распространилась по организму или вернулась после проведенного лечения.
Таргетная терапия рака щитовидной железы
В случае папиллярного или фолликулярного рака щитовидной железы применяют 3 типа препаратов:
При медуллярном раке используются:
При анапластических новообразованиях применяются:
Таргетная терапия рака яичников
Пациенткам с онкологией яичников могут назначаться:
В Онкоцентре «Лапино-2» проводится не только инновационная таргетная терапия, но и любое другое противоопухолевое лечение всех типов онкологии самыми современными препаратами.
Таргетная терапия
Таргетная терапия – вид лекарственной терапии для лечения онкологических заболеваний. Главной ее особенностью является целенаправленное (с англ. target – цель) действие препаратов на внутриклеточные механизмы, влияющие на рост опухоли. Она блокирует не рост клеток в целом, а определенный рецептор раковой клетки, который отвечает за постоянное деление.
Обычно этих рецепторов значительно больше на раковых клетках, чем на здоровых. А это значит, что препараты таргетной терапии минимально влияют на здоровые клетки организма, уменьшая тем самым количество побочных эффектов.
Специалисты Медскан в своей работе ориентируются на мировые стандарты, поэтому таргетная терапия проходит так же, как и в клиниках Израиля и США
Олькин Дмитрий Борисович
главный онколог «Медскан»
Как работает таргетная терапия?
Раковые клетки отличаются от нормальных, здоровых клеток. У них есть изменения в генах и белках, которые «говорят» клетке, как функционировать. Таргетная терапия использует эти мутации, чтобы помешать тому, как раковые клетки растут, делятся или распространяются.
В зависимости от вида таргетной терапии в онкологии препарат может воздействовать на молекулы:
Целевой препарат может блокировать сигналы, которые «говорят» раковой клетке, что делать. Используемое лекарство также изменяет способ, которым раковая клетка делает белок важным для роста клеток. Некоторые целевые методы лечения работают, останавливая подачу кислорода и питательных веществ к раковым клеткам через кровеносные сосуды.
Другие целевые методы лечения также помогают вызвать гибель раковых клеток. Независимо от метода действия, главная цель таргетной терапии – нарушить функцию раковых клеток, чтобы они не могли расти и выживать.
Как разрабатываются таргетные методы лечения?
После того, как «мишень» была идентифицирована, следующим шагом является разработка терапии, которая воздействует на нее таким образом, что препятствует росту или выживанию раковых клеток. Например, таргетная терапия при раке может снизить активность мишени или предотвратить ее связывание с рецептором, который она обычно активирует, среди других возможных механизмов.
Большинство таргетных методов лечения – это:
Моноклональные антитела вырабатываются путем введения животным (обычно мышам) очищенных целевых белков, в результате чего их организм вырабатывает различные типы антител. Они тестируются, чтобы найти те, которые лучше всего связываются с мишенью, не связываясь с нецелевыми белками.
При каких онкозаболеваниях применяется таргетная терапия
Таргетная терапия может быть использована для лечения различных видов рака. Перед применением целевого препарата, врачи проверяют, есть ли в опухолевой клетке определенные генетические изменения или мутации. Таргетная терапия также назначается, если другое лечение не сработало или если рак вернулся. Может применяться как самостоятельно, так и в сочетании с другими методами лечения, такими как химиотерапия, хирургия и лучевая терапия. Иногда может быть назначено более одного препарата таргетной терапии.
В последние годы препараты таргетной терапии проявили высокую эффективность при лечении некоторых подтипов рака молочной железы, желудка, легкого, при меланоме, колоректальном раке и др.
Ингибиторы роста: подавление деления и роста раковых клеток
Рост и размножение клеток обычно строго регулируются в организме:
В раковых клетках передача сигнала может быть изменена в разных местах. Эти места являются возможными целями атаки противораковых препаратов. Моноклональные антитела могут занимать рецепторы на поверхности клетки, тем самым предотвращая связывание факторов роста. Клетки больше не получают сигнала к делению. Одним из примеров является трастузумаб. Это антитело направлено против рецептора роста HER2, который усиленно формируется, например, у части пациентов с раком молочной железы и желудка. Антитела получают в виде вливания в вену.
Блокирование рецепторов внутри клетки: рецепторы выступают не только наружу, но и внутрь клетки. Таким образом, передается сигнал извне внутрь. Этот процесс также можно заблокировать: с помощью лекарств, которые проникают в клетки и связываются с рецептором изнутри. Сами сигналы передаются белками. Препараты, которые блокируют киназы, называются ингибиторами киназы. Обычно они назначаются перорально. Примерами являются активные ингредиенты гефитиниб и эрлотиниб, которые назначаются при раке легких.
Нарушение цепей передачи сигналов
Постепенная пересылка сигналов внутри клетки также в значительной степени работает через так называемые киназы. Кроме того, они могут быть заблокированы целевыми активными ингредиентами – ингибиторами киназы. Существуют различные киназы:
Ингибиторы образования кровеносных сосудов: нарушение питания опухоли
Растущие опухоли, как и другие ткани, нуждаются в снабжении кислородом и питательными веществами через кровеносные сосуды. Опухолевые клетки могут сами стимулировать образование новых кровеносных сосудов, называемых ангиогенезом. Для этого они образуют сосудистый эндотелиальный фактор роста, сокращенно VEGF.
Существуют препараты для таргетной терапии, которые нарушают новообразование кровеносных сосудов и, таким образом, предотвращают дальнейшее развитие опухоли. Их называют ингибиторами ангиогенеза. Также среди этих препаратов есть антитела и ингибиторы киназы. Одним из примеров является антитело бевацизумаб, которое получают пациенты с раком молочной железы или толстой кишки. Сунитиниб является примером ингибитора киназы, который блокирует переадресацию сигнала от рецептора VEGF.
Защита организма: установка иммунной системы на опухоль
Целевые антитела также вызывают иммунную реакцию, среди прочего. Это означает, что иммунная система организма сама распознает опухолевые клетки и борется с ними. Однако это не основной эффект большинства целевых лекарств. Они, скорее всего, были предназначены для целенаправленного вмешательства в пути передачи сигналов.
Частный случай ингибиторов иммунной контрольной точки: эти препараты направлены против «торможения» организма в иммунной системе, тем самым предотвращая подавление иммунного ответа опухолевыми клетками. Поэтому их можно отнести к иммунотерапии. Одним из примеров является антитело ипилимумаб, которое назначают при раке кожи.
Антитела как транспорт: целенаправленное направление клеточных токсинов в раковую клетку
Антитела также можно использовать для целенаправленной доставки токсинов в опухолевые клетки. Для этого их связывают с токсинами или радиоактивными веществами, которые оказывают свое действие только на злокачественные клетки. Антитела связываются со специфическими особенностями опухолевых клеток, тем самым доставляя свой «груз» к месту назначения.
Например, связанное вещество может быть химиотерапевтическим препаратом (цитостатиком), который вмешивается в образование важных молекул белка. Одним из примеров является трастузумаб-эмтанзин: антитело трастузумаб связано с цитотоксическим веществом мертансин. Трастузумаб-эмтанзин используется при раке молочной железы.
Ингибирование ферментов: целенаправленное влияние на важные процессы в раковой клетке
Ферменты – это молекулы, которые контролируют важные процессы в клетке, такие как восстановление и частота считывания наследственного материала или утилизация ненужных белков. Некоторые из этих процессов нарушены в раковых клетках. Их нужно целенаправленно ингибировать с помощью лекарств.
Блокирование утилизации «мусора» клетки: это функция так называемых ингибиторов протеасомы. Раковые клетки производят гораздо больше молекул белка, чем здоровые, и поэтому более чувствительны к ингибированию протеасомы. Они задыхаются от собственных отходов. Примером активного ингредиента является бортезомиб, который назначают при множественной меланоме.
Предотвращение восстановления поврежденного наследственного материала: так действуют ингибиторы PARP. Поскольку раковые клетки, в отличие от здоровых, не имеют альтернативных механизмов восстановления, они умирают. Одним из примеров является олапариб, который эффективен при раке яичников.
Содействие суицидальной программе клеток (апоптозу): раковые клетки в результате разрушают сами себя. Одним из таких активных ингредиентов является венетоклакс, который одобрен для лечения пациентов с определенной формой лейкемии.
Изменение частоты чтения генов: в раковых клетках гены часто ошибочно включаются или отключаются. Некоторые ингибиторы ферментов могут снова включать гены, ингибирующие рак, и отключать гены, способствующие его развитию. Одним из примеров является азацитидин, который назначается при лейкемии.
Преимущества таргетной терапии
Для лечения таргетной терапией используются новые типы лекарств, которые воздействуют на специфические особенности раковых клеток. Каждый целевой препарат воздействует на определенный аспект функционирования раковых клеток. Эти лекарства являются основным направлением современных исследований в области лечения рака.
Преимущества таргетной терапии:
Лекарства целенаправленно действуют против свойств опухолевых клеток. Тем не менее, таргетная терапия в онкологии имеет последствия, т. к. структуры, на которые нацелены активные ингредиенты, частично встречаются и в здоровых клетках. Типичными являются, например, побочные эффекты на коже, сердце и кровяное давление. Также могут быть затронуты щитовидная железа, печень и желудочно-кишечный тракт.
Таргетная терапия при онкологии «Медскан»
Наши специалисты назначают таргетную терапию только после молекулярно-генетического анализа клеток опухоли. Такой анализ позволяет узнать, поддаются ли клетки влиянию препаратов и, если да, то какой именно препарат будет эффективен в конкретном случае.
Преимущества проведения таргетной терапии в клинике «Медскан» в Москве:
Большинство препаратов таргетной медицины относятся или к малым молекулам или к моноклональным антителам. Низкомолекулярные препараты легко проникают внутрь клетки, воздействуя на внутриклеточные мишени, тогда как моноклональные антитела прикрепляются к мишеням на внешней стороне клетки.
Для назначения наиболее подходящего препарата в клинике таргетной терапии пациенту проводят биопсию опухоли с последующим гистологическим, иммуногистохимическим и молекулярно-генетическим исследованием, в результате чего лабораторные специалисты определяют возможность применения таргетного препарата вместе с вашим лечащим врачом-онкологом. Цены на таргетную терапию определяются индивидуально.
Таргетная терапия
Таргетная терапия (биологическая терапия, биотерапия) — это вид лекарственного лечения онкологических заболеваний, основанный на избирательном вмешательстве в определенные внутриклеточные механизмы, необходимые для опухолевого роста.
В отличие от традиционной (цитостатической) химиотерапии, которая непосредственно повреждает быстроделящиеся клетки (как «хорошие», так и «плохие»), таргетная терапия блокирует так называемые сигнальные пути, по которым клетка «понимает», что ей нужно делиться.
Как происходит передача клеточных сигналов, по которым клетки «понимают», когда им нужно делиться, а когда остановиться?
Происходит это через активацию определенными веществами — лигандами (например, эпителиальным фактором роста, EGF) специальных рецепторов на поверхностях клеточных мембран.
Эти вещества выполняют важную функцию в регуляции внутренних процессов, например, при заживлении ран и вообще регенерации. Рецепторы также могут находиться внутри клетки и взаимодействовать с веществами, которые проходят сквозь мембрану клеток. Взаимодействие рецептора с лигандами активирует сигнальные пути, в результате чего происходит пролиферация клеток.
Злокачественная опухоль возникает в результате множества мутаций в различных генах, ряд которых экспрессируется в виде рецепторов (антигенов) на поверхности клеточных мембран.
Опухолевые клетки также имеют сигнальные пути, и некоторые из них могут быть активированы рецепторами — как обычными, так и измененными в результате мутаций определенных генов.
Таргетная терапия использует 2 основные группы препаратов: моноклональные антитела, которые связываются с внешними рецепторами, и малые молекулы, ингибиторы, которые блокируют сигнальные пути внутри клеток (например, ингибиторы тирозинкиназ).
Определенное антитело находит свой антиген и связывается с ним, обеспечивая его невосприимчивость к другим веществам. Антигены и антитела строго подходят только друг к другу (афинны), как ключ к замку, и дефектный (мутировавший) антиген является в этом смысле идеальной мишенью — он присущ только опухолевым клеткам.
Таким образом, таргетная терапия блокирует именно пути передачи (сигнальные пути), которые активируются при взаимодействии рецептора с его лигандом, за счет связывания с этими рецепторами.
Для этого используются специальные вещества, полученные искусственным путем — моноклональные антитела.
Блокирование внутриклеточных механизмов осуществляется с помощью искусственно созданных малых молекул, которые могут проходить внутрь клеток сквозь мембрану.
Одна из перспективных задач современной науки в онкологии — поиск таких мишеней, которые присущи только опухолевым клеткам. Одной из первых обнаруженных мишеней, для воздействия на которую был введен в широкую клиническую практику первый препарат для таргетной терапии, был рецептор человеческого эпидермального фактора 2 типа. Повышенная экспрессия этого антигена (гиперэкспрессия) на поверхности клеток была обнаружена при раке молочной железы. Дальнейшие исследования показали, что эта мутация среди всех случаев рака молочной железы определяется примерно в 15-30%. Гиперэкспрессия данного онкогена (маркера) усиливает пролиферацию (деление) раковых клеток и тормозит их естественную гибель. Это является фактором, обуславливающим повышенную агрессивность опухоли и менее благоприятный прогноз. Анти-HER2 терапия сегодня является «золотым стандартом» лечения HER2-позитивных пациенток с раком молочной железы.
Как узнать, будет ли конкретная опухоль чувствительна к таргетным препаратам?
Предрасположенность к таргетной терапии определяется с помощью иммуногистохимического или молекулярно-генетического исследования. С их помощью выявляются мутации (или их отсутствие) в определенных генах, или экспрессия антигенов на клеточных мембранах.
Наиболее успешные таргетные методы лечения используют химические субстанции, нацеленные или преимущественно нацеленные на какой-либо белок или фермент, который несет мутацию или другие генетические изменения, являющиеся специфичными для раковых клеток. Однако могут быть ситуации, когда, наоборот, наличие мутации предопределяет отсутствие чувствительности опухоли к таргетной терапии. Например, наличие мутации в гене KRAS, NRAS определяет отсутствие чувствительности опухоли к ингибиторам тирозинкиназ — анти-EGFR препаратам.
Таргетную терапию часто используют вместе с химиотерапией и другими видами лечения рака, однако она может назначаться в виде самостоятельного лечения.
В некоторых случаях назначается комбинированная таргетная терапия (двойная анти-HER2 терапия при раке молочной железы или комбинация ингибиторов BRAF и MEK при лечении BRAF-позитивной метастатической меланомы).
В каких случаях назначают таргетную терапию?
Биология опухоли может быть различной даже при одном и том же типе рака. Поэтому таргетная терапия подбирается индивидуально, в зависимости от молекулярно-генетических характеристик выявленного рака.
Пациентам с раком толстой кишки разумно пройти обследование на наличие мутации KRAS. В настоящий момент помимо этой мутации определяется ряд других. По мере появления новых мишеней и результатов клинических исследований, профилирование опухолей часто пересматривается в сторону расширения. Это помогает назначить самое эффективное лечение.
Одним из примеров частого и широкого применения таргетной терапии является немелкоклеточный рак легкого. При распространенной болезни ткань исследуется на довольно широкий список мутаций — EGFR, ALK, ROS1, PD-L1, а с недавних пор — на NTRK и MET. Каждая из них определяет высокую чувствительность опухоли к определенной терапии.
В связи с этим, в последнее время традиционная система стадирования если не утрачивает своего решающего значения, то, во всяком случае, значительно дополняется, а лечение рака все чаще определяется не органной принадлежностью, а биологическим подтипом.
Примеры применения таргетной терапии
Как проводится таргетная терапия?
Длительность курса лечения и режим вводимых лекарств зависит от типа рака и его стадии, типа таргетной терапии и индивидуальной переносимости пациента.
Довольно часто таргетная терапия проводится до прогрессирования рака или появления непереносимости.
Таргетная терапия может быть как внутривенной (при этом она обычно носит цикличный характер), так и пероральной (прием препаратов может проводиться каждый день).
Эффект таргетной терапии определяется результатами контрольных обследований, который проводятся с определенными временными интервалами (от 4 недель до нескольких месяцев).
Побочные эффекты таргетной терапии
В отличие от химиотерапии, таргетная терапия не наносит существенного вреда здоровым клеткам — ее препараты нацелены на определенные клеточные мишени.
Однако, блокирование некоторых сигнальных путей распространяется на нормальные клетки и приводит к нарушениям их работы. Несмотря на это, таргетная терапия, как правило, переносится лучше, чем традиционная химиотерапия.
Побочные эффекты таргетной терапии зависят от вида вводимого препарата и его дозировки.
Наиболее часто встречаются следующие побочные эффекты:
Важно понимать, что речь не идет об обязательном проявлении всех перечисленных побочных эффектов, и в каждой конкретной ситуации спектр и тяжесть побочных действий различная. В случае их возникновения онкологи клиники Рассвет помогут вам снизить неприятные ощущения и предложат все возможные варианты необходимой сопроводительной терапии. Большинство побочных эффектов таргетной терапии проходят после окончания лечения.