Что значит связь поляризована
Поляризация химической связи
Если атомы, образующие ковалентную связь, одинаковы и несут одинаковые или близкие по электроотрицательности заместители, распределение электронной плоскости симметрично относительно плоскости, перпендикулярной связи и пересекающей связь на равных расстояниях от атомов; такие связи называют неполярными.
В случае, когда атомы, образующие ковалентную связь различны (C-F, O-H) или несут различные заместители (H3C-CN, H3CC-CF3), электронная плотность смещается в сторону более электроотрицательного атома; такие связи называются поляризованными (полярная связь).
Полярная связь — химическая связь, обладающая постоянным электрическим дипольным моментом вследствие несовпадения центров тяжести отрицательного заряда электронов и положительного заряда ядер. Большинство ковалентных связей являются полярными. Молекулы с полярной связью обычно гораздо более реакционноспособны, чем неполярные молекулы. Полярность связи не следует отождествлять с полярностью молекул, которая зависит также от геометрического расположения атомов в молекуле. Поляризация связей вносит существенный вклад в электрический дипольный момент молекулы.
Дипольный момент поляризованной связи может вызывать поляризацию соседних связей в молекуле (индуктивный или I-эффект), однако такой эффект быстро слабеет по цепи σ-связей. В случае наличия в молекуле системы сопряженных π-связей возможно сильное влияние мезомерного или M-эффекта делокализации электронов на поляризацию связи — вплоть до обращения поляризации. В качестве иллюстрации такого влияния можно привести распределение электронной плотности в молекулах пирролидина и пиррола: если в первом случае дипольный момент составляет 1.6 D и направлен к более электроотрицательному атому азота, то во втором — 1.8 D и направлен от азота к циклу (см. Рис.).
Поляризация химической связи
Поляризация химической связи — асимметрия (смещение) электронной плотности, связывающей молекулярной орбитали ковалентной связи.
Если атомы, образующие ковалентную связь, одинаковы и несут одинаковые или близкие по электроотрицательности заместители, распределение электронной плоскости симметрично относительно плоскости, перпендикулярной связи и пересекающей связь на равных расстояниях от атомов; такие связи называют неполярными.
В случае, когда атомы, образующие ковалентную связь различны (C-F, O-H) или несут различные заместители (H3C-CN, H3CC-CF3), электронная плотность смещается в сторону более электроотрицательного атома; такие связи называются поляризованными (полярная связь).
Полярная связь — химическая связь, обладающая постоянным электрическим дипольным моментом вследствие несовпадения центров тяжести отрицательного заряда электронов и положительного заряда ядер. Большинство ковалентных, а также донорно-акцепторные связи являются полярными. Молекулы с полярной связью обычно гораздо более реакционноспособны, чем неполярные молекулы. Полярность связи не следует отождествлять с полярностью молекул, которая зависит также от геометрического расположения атомов в молекуле. Поляризация связей вносит существенный вклад в электрический дипольный момент молекулы.
Дипольный момент поляризованной связи может вызывать поляризацию соседних связей в молекуле (индуктивный или I-эффект), однако такой эффект быстро слабеет по цепи σ-связей. В случае наличия в молекуле системы сопряженных π-связей возможно сильное влияние мезомерного или M-эффекта делокализации электронов на поляризацию связи — вплоть до обращения поляризации. В качестве иллюстрации такого влияния можно привести распределение электронной плотности в молекулах пирролидина и пиррола: если в первом случае дипольный момент составляет 1.6 D и направлен к более электроотрицательному атому азота, то во втором — 1.8 D и направлен от азота к циклу (см. Рис.).
См. также
Полезное
Смотреть что такое «Поляризация химической связи» в других словарях:
Поляризация — (франц. polarisation, первоисточник: греч. pólos ось, полюс) процессы и состояния, связанные с разделением каких либо объектов, преимущественно в пространстве. Поляризация вакуума Поляризация волн Поляризация электромагнитных волн… … Википедия
поляризация диэлектриков — 1) смещение электрических зарядов в диэлектрике под действием приложенного электрического поля. Может осуществляться благодаря сдвигу ионов относительно друг друга, деформации электронных оболочек отдельных атомов, молекул, ионов либо ориентации… … Энциклопедический словарь
Ковалентные связи — Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) 2 электрона, а у углерода (C) 8 электронов. Ковалентная связь связь, образованная направленными валентными электронными облаками. Нейтральные… … Википедия
Поляризации — Поляризация (франц. polarisation, первоисточник: греч. pólos ось, полюс) процессы и состояния, связанные с разделением каких либо объектов, преимущественно в пространстве. Поляризация вакуума Поляризация волн Поляризация диэлектриков Поляризация… … Википедия
Ковалентная связь — Рис.1. Модель одинарной ковалентной связи (электронная плотность выделена красным цветом) Ковалентная связь (атомная связь, гомеополярная связь) химическая связь, образованная перекрытием (обобществлением) пары … Википедия
Ковалентная химическая связь — Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) 2 электрона, а у углерода (C) 8 электронов. Ковалентная связь связь, образованная направленными валентными электронными облаками. Нейтральные… … Википедия
Бинарные соединения — Бинарные соединения химические вещества, образованные, как правило, двумя химическими элементами. Термин «бинарные соединения» обычно не применяется в отношении основных и кислотных оксидов. При этом несолеобразующие оксиды включают в… … Википедия
Ионная связь — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Атом — (от греч. atomos неделимый) частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств. Каждому элементу соответствует определённый род А.,… … Большая советская энциклопедия
Химия — I Химия I. Предмет и структура химии Химия одна из отраслей естествознания, предметом изучения которой являются химические элементы (Атомы), образуемые ими простые и сложные вещества (молекулы (См. Молекула)), их превращения и… … Большая советская энциклопедия
Ионные связи и поляризация



Лекция 5
Поляризация ионов.Так как электронные плотности атомов и ионов простираются на значительные расстояния от ядер и имеют заметные значения за пределами их эффективных радиусов, то при образовании любой химической связи обязательно имеет место перекрывание облаков, то есть связь не может быть чисто ионной.
| Li + | Be 2+ | B 3+ |
| Na + | Mg 2+ | Al 3+ |
| K + | Ca 2+ | Ga 3+ |
Поляризация ионов, связанная со степенью ковалентности (К) или ионности (i), сильно влияет на такие свойства веществ как температуры плавления и кипения, растворимость, цветность. Так, увеличение поляризации ионов в ионных кристаллах приводит к снижению температур плавления, например, температуры плавления (°C) BeCl2 (450), CaCl2 (772), HgCl2 (276), NaBr (755), MgBr2 (700), AlBr3 (97,5), LiF (870), LiCl (613), LiBr (547), LiI (446).
Растворимость в полярных растворителях уменьшается с увеличением поляризации. Например, в ряду AgF, AgCl, AgBr, AgI поляризация растет из-за увеличения радиуса аниона, а растворимость падает.
| m2 М ¾ О m1 С ¾ О М ¾ О |
Термическая устойчивость карбонатов (и ряда других оксо- и тио- солей) уменьшается с увеличением поляризующей способности катиона. В данном случае имеет место контрполяризациядвух катионов (С 4+ и М n + ) по отношению к иону кислорода (указано стрелками). В результате поляризующего действия электроны частично смещаются к катионам, что облегчает разрыв связей С-О. Катионы с наибольшим поляризующим действием вообще не образуют устойчивых карбонатов. Например,
Полярность и поляризуемость химической связи
Химическая связь
Учение о химической связи является одной из центральных проблем современной химии. Создание надёжной модели, отражающей строение атомов, молекул и природу сил взаимодействия между ними, позволило бы рассчитать свойства веществ, не прибегая к эксперименту.
Совокупность химически связанных атомов (например, молекула или кристалл) – это сложная система ядер и электронов. Из всех сил, существующих в природе, при образовании химической связи мы будем учитывать только электростатические, так как они наиболее существенны.
Современные методы исследования позволяют экспериментально определить пространственное расположение в веществе атомных ядер. С электронами дело обстоит гораздо сложнее, можно говорить лишь о вероятности нахождения электронов в определённом месте вокруг ядра или о плотности электронного облака. Выяснить, как распределяется электронная плотность – это означает описать химическую связь.
В зависимости от характера распределения различают три основных типа химической связи: ковалентную, ионную и металлическую. В «чистом» виде перечисленные типы связи проявляются редко, в большинстве соединений имеет место наложение разных типов связи.
С помощью физических методов исследования определяют основные параметры молекул – межъядерные расстояния, валентные углы и геометрию молекул.
Характеристики химической связи
Расстояние между ядрами химически связанных атомов называют длиной связи.
Угол между воображаемыми линиями, проходящими через ядра химически связанных атомов, называется валентным углом.
Химическая связь в основном осуществляется так называемыми валентными электронами. У s- и p-элементов вылентными являются электроны внешнего слоя, а у d-элементов – электроны s-состояния внешнего слоя и d-состояния предвнешнего слоя.
Химическая связь возникает в том случае, если электрон оказывается между ядрами. Она осуществляется за счёт электростатического взаимодействия положительно заряженных ядер и отрицательно заряженных электронов.
Ковалентная связь
Ковалентная связь образуется при соединении атомов с одинаковыми или не очень сильно отличающимися по величине значениями электроотрицательности.
Наиболее признанной для описания этого вида химической связи является теория валентных связей или метод валентных связей.
Теория валентных связей (локализованных электронных пар) исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких электронных пар. Таким образом, в представлении теории ВС химическая связь локализована между двумя атомами, то есть она двухцентровая и двухэлектронная. В рамках данной теории численное значение валентности соответствует числу ковалентных связей, которые образует атом.
Химическая связь возникает, когда встречаются два атома, имеющих неспаренные электроны. Например: Н∙ + ∙Н = Н:Н. Спаривание электронов и пребывание их в поле двух ядер энергетически гораздо выгоднее, поэтому в образовании ковалентных связей принимают участие все одноэлектронные облака.
N 2s 2 2p 3 : N ∙ + 3 H∙ = : N : H
Иногда число непарных электронов увеличивается при возбуждении атома, когда двухэлектронные облака распадаются на одноэлектронные. Примером может служить атом углерода: С 2s 2 2p 2 C * 2s 1 2p 3
∙ C ∙ + 4 :F ∙ = : F – C – F:
Существует ещё и так называемый донорно-акцепторный механизм образования ковалентной связи: одна из частиц имеет пару электронов, а другая – свободную орбиталь: А: + В = А – В. Частица, предоставляющая своё двухэлектронное облако – донор; частица со свободной орбиталью – акцептор.
Пример: B 2s 2 2p 1 B * 2s 1 2p 2
. H H H
H H H
Рассматриваемые механизмы образования ковалентной связи объясняют одно из её важнейших свойств. Речь идёт о насыщаемости химической связи. Насыщаемость – это способность атома образовывать определённое число ковалентных связей, которое зависит от строения атома (количество неспаренных электронов плюс число электронных пар на внешнем уровне или число вакантных орбиталей). Вследствие насыщаемости связи молекулы имеют определённый состав и существуют в виде дискретных частиц с определённой структурой.
Следующим важнейшим свойством является направленность (имеется в виду пространственная) ковалентной связи.
Мы уже выяснили, что электронные облака имеют различную форму, их взаимное перекрывание осуществляется по-разному.
Если перекрывание облаков осуществляется вдоль линии соединения ядер атомов, то образуется сигма-связь σ (s, p, d).
Перекрывание облаков по обе стороны от линии соединения центров атомов приводит к возникновению пи-связи π (p,d).
Перекрывание всех четырёх лопастей d-электронных облаков, расположенных в параллельных плоскостях, влечёт за собой образование дельта-связи δ.
Электронные облака (кроме s) направлены в пространстве, значит и образуемые химические связи также имеют направление. Обычно атомы формируют связи за счёт электронов разных энергетических состояний. При этом, не смотря на различие форм исходных электронных облаков, связи оказываются равноценными и расположены симметрично. Это явление можно объяснить с помощью концепции гибридизации валентных орбиталей.
Полярность и поляризуемость химической связи
Если ковалентная связь образуется между двумя одинаковыми атомами, то общая электронная пара расположена на одинаковом расстоянии от обоих ядер, в этом случае ковалентная связь называется неполярной (Н2, О2).
Таким образом, по степени смещения (поляризации) связующего электронного облака связь может быть неполярной, полярной и ионной. Неполярная и ионная – два крайних случая, встречаются они гораздо реже, чем ковалентная полярная связь.
Для характеристики реакционной способности молекул важно знать, легко ли изменить исходное распределение электронной плотности в молекуле?
Полярность молекул
В зависимости от того, как распределена электронная плотность, молекулы могут быть полярными и неполярными. В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. Полярные молекулы являются диполями, то есть системами, состоящими из двух равных по величине и противоположных по знаку зарядов (+q и –q), которые находятся на некотором расстоянии l друг от друга.
Расстояние между центрами тяжести положительного и отрицательного зарядов называется длиной диполя. Полярность молекулы оценивается величиной её электрического момента диполя μ = q*l. Электрический момент диполя молекулы представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от пространственного строения молекулы. Рассмотрим примеры.
СО2 δ- О = С 2δ+ = О δ- симметричное линейное строение, связи С–О
сильно полярны, но их электрические моменты диполя взаимно компенсируют друг друга μ (СО2) = 0. Неполярными являются также высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрическая молекула SF6.
На величину электрического момента диполя молекулы сильно влияют несвязывающие электронные пары.
Под действием внешнего электрического поля в молекуле происходит перераспределение заряда, молекула поляризуется. В ней возникает диполь, который называется наведённым или индуцированным.
Ионная связь
Ионная связь осуществляется за счёт взаимного электростатического притяжения противоположно заряженных ионов.
Способность элементов образовывать простые ионы обусловлена электронной структурой атомов, количественно её можно оценить величинами энергии ионизации атома и его сродства к электрону. Легче всего образуют катионы щелочные и щелочноземельные металлы. Простые анионы легче всего дают галогены вследствие их высокого сродства к электрону.
Соединения, состоящие из простых ионов немногочисленны. Но и в этих соединениях электронная плотность между атомами не равна нулю, то есть можно говорить о преимущественно ионном характере связи.
Ионы можно принять за заряженные шары, их силовые поля направлены во все стороны. Поэтому ион может притягивать к себе противоионы в любом направлении. Таким образом, ионная связь является ненаправленной. При образовании молекулы (связи) силовые поля полностью не компенсируют друг друга, у ионов сохраняется возможность притягивать другие заряды, значит, ионная связь характеризуется ненасыщаемостью.
Таким образом, в обычных условиях ионные соединения – это кристаллические вещества, кристаллы можно рассматривать как гигантские молекулы, состоящие из огромного числа ионов NanCln.
Дата добавления: 2015-12-29 ; просмотров: 4186 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Поляризация света для «чайников»: определение, суть явления и сущность
В нашем блоге уже можно найти статьи про преломление, дисперсию и дифракцию света. Теперь пришло время поговорить о том, в чем заключается сущность поляризации света.
В самом общем смысле правильнее говорить о поляризации волн. Поляризация света, как явление, представляет собой частный случай поляризации волны. Ведь свет представляет собой электромагнитное излучение в диапазоне, воспринимаемом глазами человека.
Что такое поляризация света
Поляризация – это характеристика поперечных волн. Она описывает положение вектора колеблющейся величины в плоскости, перпендикулярной направлению распространения волны.
Если этой темы не было на лекциях в университете, то вы, вероятно, спросите: что это за колеблющаяся величина и какому направлению она перпендикулярна?
Как выглядит распространение света, если посмотреть на этот вопрос с точки зрения физики? Как, где и что колеблется, и куда при этом летит?
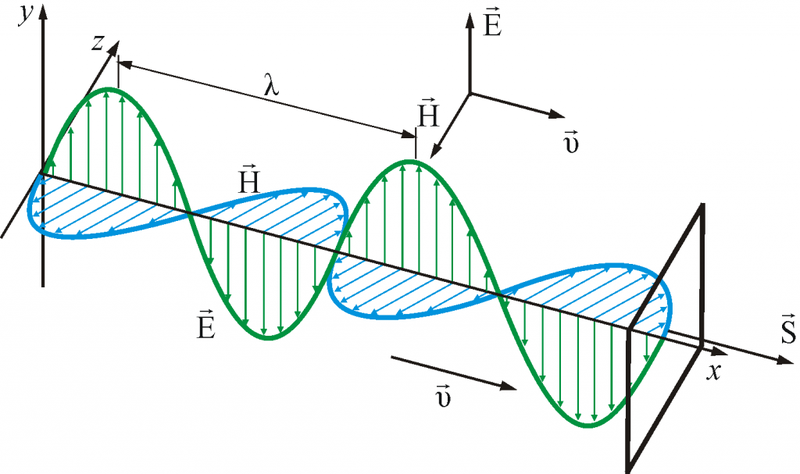
Свет – это электромагнитная волна, которая характеризуется векторами напряженности электрического поля E и вектором напряженности магнитного поля Н. Кстати, интересные факты о природе света можно узнать из нашей статьи.
Согласно теории Максвелла, световые волны поперечны. Это значит, что векторы E и H взаимно перпендикулярны и колеблются перпендикулярно вектору скорости распространения волны.
Поляризация наблюдается только на поперечных волнах.
Для описания поляризации света достаточно знать положение только одного из векторов. Обычно для этого рассматривается вектор E.
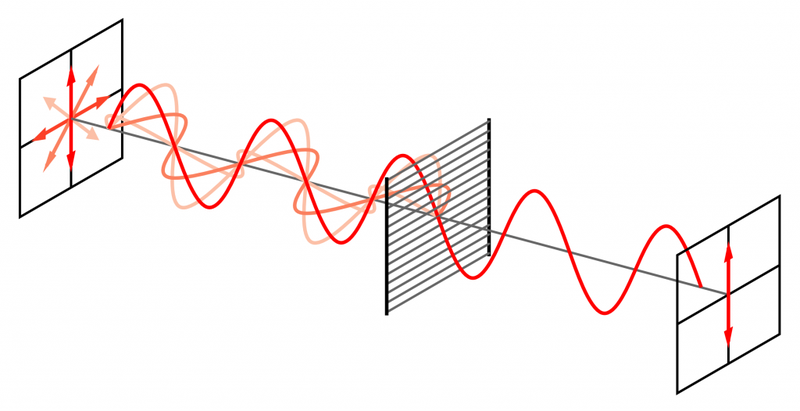
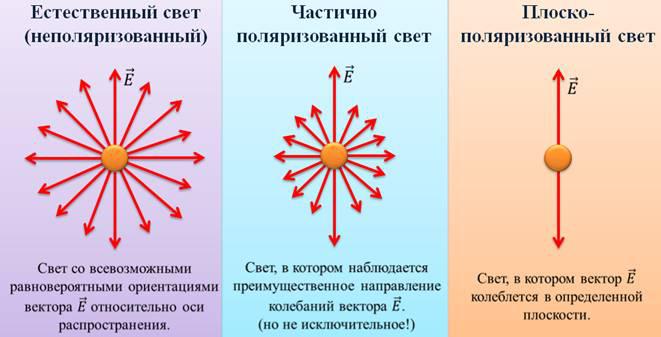
Если направления колебаний светового вектора каким-то образом упорядочены, свет называется поляризованным.
Возьмем свет на рисунке, который приведен выше. Он, безусловно, поляризован, так как вектор E колеблется в одной плоскости.
Если же вектор E колеблется в разных плоскостях с одинаковой вероятностью, то такой свет называется естественным.
Поляризация света по определению – это выделение из естественного света лучей с определенной ориентацией электрического вектора.
Кстати! Для наших читателей сейчас действует скидка 10% на любой вид работы
Откуда берется поляризованный свет?
Свет, который мы видим вокруг себя, чаще всего неполяризован. Свет от лампочек, солнечный свет – это свет, в котором вектор напряженности колеблется во всех возможных направлениях. Но если вам по роду деятельности приходится весь день смотреть в ЖК-монитор, знайте: вы видите поляризованный свет.
Чтобы наблюдать явление поляризации света, нужно пропустить естественный свет через анизотропную среду, которая называется поляризатором и «отсекает» ненужные направления колебаний, оставляя какое-то одно.
Анизотропная среда – среда, имеющая разные свойства в зависимости от направления внутри этой среды.
В качестве поляризаторов используются кристаллы. Один из природных кристаллов, часто и давно применяемых в опытах по изучению поляризации света — турмалин.
Связь между углом падения и степенью поляризации света выражается законом Брюстера.
Когда свет падает на границу раздела под углом, тангенс которого равняется относительному показателю преломления двух сред, отраженный луч является линейно поляризованным, а преломленный луч поляризован частично с преобладанием колебаний, лежащих в плоскости падения луча.
Практическое применение явления поляризации света
Поляризация света – не просто явление, которое интересно изучать. Оно широко применяется на практике.
Пример, с которым знакомы почти все – 3D-кинематограф. Еще один пример – поляризационные очки, в которых не видно бликов солнца на воде, а свет фар встречных машин не слепит водителя. Поляризационные фильтры применяются в фототехнике, а поляризация волн используется для передачи сигналов между антеннами космических аппаратов.
Чтобы не терять время и преодолеть трудности максимально быстро, обратитесь за советом и помощью к нашим авторам. Мы поможем выполнить реферат, лабораторную работу, решить контрольные задания на тему «поляризация света».
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.