Что значит шоковое состояние
Что значит шоковое состояние
Синдромный диагноз «шок» ставится у больного при наличии острого нарушения функции кровообращения, которое проявляется следующими симптомами:
• холодная, влажная, бледно-цианотичная или мраморная кожа,
• резко замедленный кровоток ногтевого ложа,
• затемненное сознание,
• диспноэ,
• олигурия,
• тахикардия,
• уменьшение артериального и пульсового давления.
В тех случаях, когда у больного имеются бесспорные признаки кровопотери, но еще отсутствует гипотония, нужно решить вопрос, развился шок или нет. В данной ситуации удобно пользоваться патогенетической классификацией Г. А. Рябова. Исходя из патогенеза, автор предлагает выделять три стадии в развитии гипо-волемического (геморрагического) шока (см. табл. 18):
1. Компенсированный обратимый шок (синдром малого выброса).
2. Декомпенсированный обратимый шок.
3. Необратимый шок.
Острая кровопотеря в объеме до 500 мл у взрослого человека протекает практически бессимптомно и не требует проведения интенсивной терапии.
Таблица 18. Патогенетическая классификация, основные клинические симптомы и компенсаторные механизмы гиповолемического шока (по Г. А. Рябову).
| Кровопотеря % и объем (мл) | Состояние | Клинические симптомы | Компенсаторные и патологические механизмы |
| 10% 450-550 | Норма | Отсутствуют | Гемодилюция, юные эритроциты |
| 15-25% 700-1300 | Шок 1 ст. | 1. Умеренная тахикардия 2. Незначительная артериальная гипотония 3. Умеренная олигурия | Перестройка ССС, катехоламины, начинает формироваться централизация кровообращения |
| 25-45% 1300-1800 | Шок II ст. | 1. ЧСС 120-140 2. АД 140 2. Гипотония более 12 ч. 3. Гипостаз 4. Анурия | Сладж, феномен некроза и отторжения слизистой кишечника |
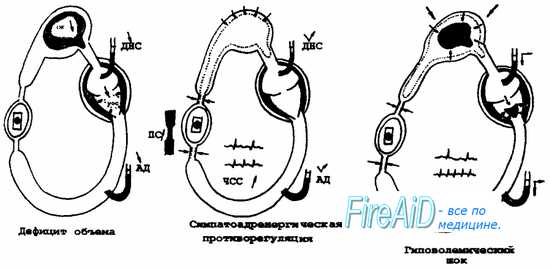
При шоке ПЕРВОЙ СТАДИИ организм хорошо компенсирует острую кровопотерю физиологическими изменениями деятельности ССС. Сознание полностью адекватное, иногда отмечается некоторое возбуждение. При осмотре обращают на себя внимание незначительная бледность кожных покровов и наличие запустевших, нитевидных вен на руках. Верхние и нижние конечности на ошупь прохладные. Пульс слабого наполнения, умеренная тахикардия. АД, несмотря на снижение сердечного выброса, остается в пределах нормы, а иногда даже отмечается его увеличение. ЦВД на уровне нижней границы нормы или еще ниже, умеренная олигурия. Незначительные признаки субкомпенсированного ацидоза. С патогенетической точки зрения, первую стадию шока можно расценивать как начало формирования централизации кровообращения.
Для шока ВТОРОЙ СТАДИИ ведущим клиническим симптомом является снижение системного давления. В основе этого явления лежит истощение возможностей организма при помощи спазма периферических сосудов компенсировать малый сердечный выброс. В результате нарушения кровоснабжения сердца падает его сократительная способность. Это в еще большей степени нарушает органную перфузию и усиливает ацидоз. В системе микроциркуляции развивается стаз. Клинически вторая стадия проявляется спутанностью сознания, компенсаторными тахикардией (ЧСС 120—140) и одышкой, низким пульсовым АД, венозной гипотонией, низким или отрицательным ЦВД. Компенсаторная одышка появляется в ответ на метаболический ацидоз и как ответная реакция на формирующиеся шоковые легкие. Прогностически плохими предвестниками в данной стадии шока является появление у больного акроцианоза на фоне общей бледности в сочетании с гипотонией и олигоанурией.
Шок ТРЕТЬЕЙ СТАДИИ начинает формироваться, если некомпенсированная гипотония держится у больного 12 и более часов. С точки зрения патогенеза, принципиальным отличием третьей фазы шока от второй является переход стаза в системе микроциркуляции в сладж-синдром. Это сопровождается, помимо начала первой фазы ДВС-син-дрома, феноменом некроза и отторжения слизистой оболочки кишечника. В основе данного явления лежит переполнение сосудов кишечника кровью, выходом плазмы в интерстиций и последующим отторжением. Клинически состояние больного характеризуется как крайне тяжелое. Сознание отсутствует. Отмечаются резкая бледность кожных покровов, холодный пот, низкая температура тела, олигоанурия. Пульс на периферии определяется с большим трудом или вообще отсутствует, ЧСС более 140, АД менее 60 мм рт. ст. или совсем не определяется.
Что значит шоковое состояние
Автор: врач, научный директор АО «Видаль Рус», Жучкова Т. В., t.zhutchkova@vidal.ru
Общие сведения
Шок – это тяжелое состояние, когда сердечно-сосудистая система не справляется с кровоснабжением организма, обычно это связано с низким кровяным давлением и повреждением клеток или тканей.
Причины шока
Шок может быть вызван состоянием организма, когда опасно снижается кровообращение, например, при сердечно-сосудистых заболеваниях (инфаркт или сердечная недостаточность), при большой потере крови (сильное кровотечение), при обезвоживании, при выраженных аллергических реакциях или заражении крови (сепсисе). Классификация шока включает: кардиогенный шок (связан с сердечно-сосудистыми проблемами), гиповолемический шок (вызван низким объемом крови), анафилактический шок (вызван аллергическими реакциями), септический шок (вызван инфекциями), нейрогенный шок (нарушения со стороны нервной системы).
Шок является жизненно-опасным состоянием и требует немедленного медицинского лечения, не исключена и неотложная помощь. Состояние больного при шоке может быстро ухудшаться, будьте готовы к первичным реанимационным действиям.
Cимптомы
Симптомы шока могут включать чувство страха или возбуждения, синюшные губы и ногти, боль в груди, дезориентацию, холодную влажную кожу, сокращение или прекращение мочеиспускания, головокружение, обморочное состояние, низкое артериальное давление, бледность, избыточное потоотделение, учащенный пульс, поверхностное дыхание, беспамятство, слабость.
Что можете сделать Вы. Первая помощь при шоке
Проверьте дыхательные пути пострадавшего, в случае необходимости следует провести искусственное дыхание.
Если больной в сознании и у него нет травм головы, конечностей, спины, уложите его на спину, при этом ноги должны быть подняты на 30 см; не поднимайте голову. Если же больной получил травму, при которой поднятые ноги вызывают чувство боли, то не надо их приподнимать. Если больной получил сильное повреждение позвоночника – оставьте его в том положении, в котором нашли, не переворачивая, и окажите первую помощь, обработав раны и порезы (если они есть).
Человек должен оставаться в тепле, ослабьте тесную одежду, не давайте больному ни есть, ни пить. Если у больного рвота или слюнотечение, поверните ему голову на бок для обеспечения оттока рвотной массы (только если нет подозрения на спинномозговую травму). Если все-таки есть подозрение на повреждение позвоночника и у больного рвота, необходимо его переворачивать, фиксируя шею и спину.
Вызовите скорую помощь и продолжайте наблюдать за основными показателями жизнедеятельности (температура, пульс, частота дыхания, артериальное давление), пока помощь не подоспеет.
Профилактические меры
Предупредить состояние шока легче, чем его лечить. Быстрое и своевременное лечение первопричины снизит риск развития тяжелой формы шока. Скорая первая помощь поможет проконтролировать состояние шока.
Общие принципы лечения шока
Основная цель терапии шока – оптимизация транспорта кислорода. Это направление лечения реализуется с помощью гемодинамической и респираторной поддержки. Лечение шока должно включать в себя широкий комплекс интенсивных лечебных мероприятий, направленных на коррекцию патофизиологических нарушений, лежащих в основе развития шока: абсолютной или относительной гиповолемии, расстройства насосной функции сердца, симпатоадренергической реакции и гипоксии тканей. У всех пациентов должны применяться меры, направленные на предотвращение гипотермии и связанных с ней последствий.
Лечебные действия при шоке должны быть направлены на:
Инфузионная терапия
Центральное место в лечении шока занимает инфузионная терапия. Она оказывает влияние на основные звенья патогенеза шока и позволяет:
Увеличение ОЦК – неотложное жизненно важное мероприятие при всех формах шока, кроме кардиогенного. Только при этом условии обеспечивается оптимальное кровенаполнение желудочков сердца, адекватно увеличивается СВ, повышается АД, улучшается доставка кислорода к тканям, восстанавливаются нарушенные обменные процессы и больной может быть выведен из критического состояния.
Восполнение ОЦК должно проводиться быстро через катетеры большого диаметра, введеные в крупные периферические или центральные вены. Если нет признаков застойной сердечной недостаточности, первые 500 мл раствора вводят струйно. Затем инфузию продолжают до тех пор, пока не будут достигнуты адекватные АД, ЦВД, давление наполнения желудочков, ЧСС и мочеотделение.
Инфузионные растворы
Большинство современных специалистов при лечении шока используют комбинацию кристаллоидных и коллоидных растворов. Это позволяет быстро и эффективно восполнить ОЦК, устранить дефицит внесосудистой жидкости и помогает поддерживать нормальные онкотические градиенты между внутрисосудистыми и интерстициальными пространствами. Выбор соотношения кристаллоидных и коллоидных растворов при проведении инфузионной терапии у больного с шоком звисит от конкретной клинической ситуации, оценки степени нарушений, четкого понимания механизма действия препарата и цели лечения.
Кристаллоидные (солевые) растворы (растворы Рингер-Локка, Рингер-лактата, лактасол, физиологический раствор и др. ) восполняют как внутрисосудистый объем крови, так и объем и состав интерстициальной и внутриклеточной жидкости. Следует помнить, что три четверти объема кристаллоидных растворов быстро покидают сосудистое русло и увеличивают объем внеклеточной жидкости. Эти потенциально вредные эффекты кристаллоидных растворов, далеко не всегда компенсируются увеличением лимфоотока, и могут приводить к переполнению межклеточного пространства. Гемодинамическая стабильность, достигаемая с помощью большого объема инфузии кристаллоидных растворов всегда будет сопровождаться повышением экстравазации жидкости и формированием отека тканей. Особенно это выражено в условиях «капиллярной утечки». Генерализованный отек тканей ухудшает транспорт кислорода к клеткам и усиливает органную дисфункцию. При этом более всего страдают легкие, сердце и кишечник. Вот почему необходима параллельная инфузия коллоидных средств.
Уменьшить риск развития гипергидратации тканей при использовании кристаллоидов и быстро повысить АД возможно при использовании гипертонического солевого раствора. Однако, при этом возникает опасность дисбаланса электролитов, гипернатриемии, гиперосмотической комы и ухудшения клеточного метаболизма.
Применение коллоидных растворов сопряжено с меньшим риском экстравазации и развития отека тканей, они эффективно поддерживают коллоидно-осмотическое давление плазмы и быстрее стабилизируют гемодинамику по сравнению с кристаллоидными растворами. Поскольку коллоиды более длительно циркулируют в сосудистом русле, требуется меньший объем вводимой жидкости для стабилизации гемодинамики по сравнению с объемом кристаллоидных растворов. Это значительно снижает опасность перегрузки организма жидкостью.
Вместе с тем коллоидные растворы дороже, могут связывать и уменьшать ионизированную фракцию плазменного кальция, снижать уровень циркулирующих иммуноглобулинов, уменьшать эндогенную выработку белка и влиять на систему гемостаза. Инфузия коллоидных растворов повышает онкотическое давление плазмы и может приводить к перемещению внутритканевой жидкости в сосудистое русло. При этом возникает потенциальный риск увеличения дефицита объема интерстициальной жидкости. Для профилактики подобных нарушений и поддержания нормального онкотического градиента между внутрисосудистым и интерстициальным пространствами целесообразно одновременно вводить коллоидные и кристаллоидные растворы.
Не все коллоидные растворы в равной степени отвечают современным требованиям лечения шока. По традиции свежезамороженная плазма до сих пор используется как источник коллоидов. Но на сегодняшний день переливание плазмы представляет достаточно большую опасность для реципиента, так как она может быть контаминирована вирусами гепатита и иммунодефицита человека. Аллергические и анафилактические реакции, возможные острые поражения легких и почек, иммунодефицитные и другие состояния дополняют картину. Поэтому в настоящее время не рекомендуется использовать плазму в качестве коллоидного кровезаменителя. Чрезмерное использование препаратов альбумина в лечении шока должно быть также ограничено. Исследования показали, что применения альбумина при критических состояниях способствует повышению летальности больных. Установлено, что увеличение коллоидно-осмотического давления плазмы после введения альбумина носит кратковременный характер, а затем происходит его экстравазация в интерстициальное пространство. Поэтому назначение альбумина с целью коррекции гипоальбуминемии называют «большим метаболическим недоразумением». Разумной альтернативой препаратам альбумина служат растворы гидроксиэтилированного крахмала и декстраны.
Растворы гидроксиэтилированного крахмала снижают проницаемость эндотелиальной стенки капиллярных сосудов, улучшают реологические свойства крови, их отличает стойкий волемический эффект, быстрый метаболизм, а также значительно меньшее влияние на функцию почек. Устранение острой гиповолемии растворами гидроксиэтилированного крахмала приводит к быстрому улучшению центральной гемодинамики, микроциркуляции и транспорта кислорода, что в конечном итоге восстанавливает биоэнергетические процессы на клеточном уровне. В отличие от других коллоидных растворов препараты гидроксиэтилированного крахмала не блокируют синтез белка и не оказывают побочного действия на функции иммунной и лимфоидной систем. Частицы крахмала способствуют снижению активации эндотелиальных клеток и уменьшают «капиллярную утечку».
Клинические результаты свидетельствуют, что препараты крахмала при шоке имеют значительные преимущества по сравнению с растворами альбумина:
При анализе обширного многолетнего клинического опыта выявлены особенности и преимущества коллоидных растворов на основе гидроксиэтилированного крахмала, особенно их второго поколения. В первую очередь это касается безопасности применения и исключительно низкой частоты возникновения побочных реакций по сравнению с другими коллоидными инфузионными растворами. Это обусловлено структурным сходством гидроксиэтилированного крахмала с гликогеном. Накопленный на сегодняшний день опыт применения коллолидных растворов позволяет рекомендовать использование растворов гидроксиэтилированного крахмала второго поколения как препаратов первого выбора при возмещении ОЦК у больных шоком.
Борьба с гипоксией
Главное при шоке устранить гипоксию тканей, поскольку это является центральным звеном патогенеза данного патологического состояния. Потребление кислорода зависит от метаболических потребностей и с трудом поддается коррекции. Снизить потребности организма в кислороде можно только устранив гипертермию или исключив деятельность мышц участвующих в дыхании и возложив их функцию на аппарат искусственной вентиляции легких (ИВЛ).
Доставка кислорода к тканям определяется главным образом величиной СВ и кислородной емкостью крови. Оптимальный уровень насыщения крови кислородом (выше 90%) и оксигенацию тканей можно поддерживать с помощью различных методов кислородной терапии – ингаляции кислорода через лицевую маску или носовые катетеры. Если при ингаляции кислорода сохраняется дыхательная недостаточность, то следует проводить ИВЛ, которую можно осуществлять через широкую маску или интубационную трубку. Эндотрахеальная интубация предпочтительна при обтурации и повреждении дыхательных путей, а также при необходимости длительной ИВЛ. Показания к применению ИВЛ: выраженное тахипноэ (частота дыханий более 35 в 1 минуту), цианоз кожи и слизистых оболочек, участие в акте дыхания вспомогательных мышц, изменение психического статуса пациента, снижение напряжения кислорода в артериальной крови ниже 70 мм рт. ст. и повышение напряжения углекислоты выше 50 мм рт. ст. при дыхании кислородом.
Повышение сократимости миокарда и регуляция сосудистого тонуса
В основе стратегии лечения всех форм шока лежит регулирование величины ОЦК, уровня общего сосудистого сопротивления и сократимости миокарда. Первоначально обычно корригируют величину ОЦК. При отсутствии положительного эффекта инфузионной терапии необходимо немедленное применение адренергических средств.
Адренергические лекарственные препараты
Средства, влияющие на сосудистый тонус и сократимость миокарда отличаются различной степенью воздействия на альфа- и бета-адренергические и допаминэргические рецепторы, обладают различным хронотропным эффектом и влиянием на потребление кислорода миокардом. К их числу относятся допамин, добутамин, эпинефрин, норэпинефрин и другие препараты. Препаратом первого ряда при шоке является допамин.
Норэпинефрин обладает преимущественно альфа-адренергическим действием, ведущим к сужению периферических сосудов, и в меньшей степени – положительным хроно- и инотропным действием на миокард. Норэпинефрин повышает АД и улучшает функцию почек без применения низких доз допамина и фуросемида.
Эпинефрин, эндогенный катехоламин, выделяемый надпочечниками в ответ на стресс, имеет широкий спектр отрицательных системных эффектов, включающих сосудосуживающее действие на почечные сосуды, аритмогенное воздействие на сердце и повышение потребности миокарда в кислороде. Поэтому применение эпинефрина ограничивается случаями полной рефрактерности к другим катехоламинам и анафилактическим шоком.
Применение адренергических лекарственных средств с целью увеличения АД показано при истинном кардиогенном и анафилактическом шоках, а также при шоке, невосприимчивом к интенсивной инфузионной терапии.
Сосудорасширяющие средства
Нитроглицерин и связанные органические нитраты в отличие от нитропруссида натрия действуют преимущественно на венозную часть кровеносного русла снижая возврат крови к сердцу, и тем самым понижают нагрузку на миокард при сердечной недостаточности.
Коррекция нарушений метаболизма
При необходимости проводят экстренную коррекцию электролитных нарушений, особенно уровня калия и кальция, а также гипергликемии. После первоначальной стабилизации больных уровень глюкозы поддерживают ниже 8, 3 ммоль/л. Используют постоянную инфузию инсулина и глюкозы. До стабилизации уровня глюкозы необходим мониторинг каждые 30-60 минут, в дальнейшем мониторинг следует осуществлять каждые 4 часа.
Хотя метаболический ацидоз и уменьшает эффективность вазопрессорных средств, его коррекцию раствором гидрокарбоната натрия следует проводить лишь при рН крови ниже 7, 2. Неоправданное назначение гидрокарбоната натрия ведет к уменьшению поступления кислорода в ткани и усиливает ацидоз в ЦНС.
Почти при всех видах шока используют малые дозы глюкокортикоидов, а при признаках надпочечниковой недостаточности и низком уровне кортизола их применение обязательно. Антибиотики с широким спектром действия при шоке назначают эмпирически при открытых или потенциально инфицированных ранах, множественных повреждениях органов брюшной полости и в тех случаях, когда предполагают сепсис. Для профилактики тромбоза глубоких вен используют низкие дозы нефракционированного либо низкомолекулярных гепаринов, эластическую компрессию и перемежающуюся пневматическую компрессию нижних конечностей.
При шоке часто возникает необходимость в лечении и других патологических синдромов. Наиболее частыми следствиями шока являются острая сердечная, почечная и печеночная недостаточность, респираторный дистресс-синдром, ДВС-синдром и вторичные желудочно-кишечные кровотечения из острых эрозий.
Нарушения функций органов при шоке и принципы их лечения
Органы, больше всего страдающие при шоке от нарушения перфузии, принято называть «шоковыми органами», или органами-мишенями. В первую очередь это легкие и почки, повреждение которых является наиболее характерной чертой любого шока. Слабым звеном также бывает орган, поврежденный еще до развития шока. Основные диагностические критерии дисфункции органов и систем приведены в табл. 15. 3.
Почки
Почки одними из первых страдают при шоке. Вазоконстрикция почечных сосудов развивается на ранних стадиях этого патологического состояния, что приводит к резкому снижению почечной фильтрации и мочевыделения вплоть до анурии. Развивается преренальная острая почечная недостаточность. Ауторегуляторные механизмы в состоянии поддерживать постоянный почечный кровоток лишь при уровне системного АД выше 80 мм рт. ст. Продолжительное снижение почечной перфузии ведет к повреждению канальцевого эпителия, гибели части нефронов и нарушению выделительной функции почек. При синдроме длительного сдавления и гемотрансфузионном шоке к тому же происходит и обтурация почечных канальцев выпадающими белковыми преципитатами. В исходе развивается острая ренальная почечная недостаточность.
Нарушение функции почек при шоке проявляется резким снижение объема выделяемой мочи вплоть до анурии, увеличением концентрации креатинина, мочевины, калия в крови, метаболическим ацидозом. При лечении шока следует стремиться, чтобы почасовой диурез составлял не менее 40 мл/час. На фоне проводимой инфузионной терапии и восстановленного ОЦК для стимуляции диуреза могут быть использованы фуросемид и малые дозы допамина, улучшающие почечное кровообращение и тем самым снижающие риск развития острой почечной недостаточности. При отсутствии эффекта от диуретиков и допамина применяют гемодиализ.
Легкие
Легкие всегда повреждаются при шоке. Дыхательная система стандартно реагирует как на прямое повреждение легких (аспирация желудочного содержимого, ушиб легкого, пневмоторакс, гидроторакс), так и на шок и другие патологические факторы. Эндотоксины и липосахариды оказывают прямой повреждающий эффект на легочные эндотелиальные клетки, увеличивая их проницаемость. Другие активные медиаторы, такие как фактор активации тромбоцитов, фактор некроза опухоли, лейкотриены, тромбоксан А2, активированные нейтрофилы, также патологически воздействуют на легкие.
Агрессивные метаболиты, медиаторы воспаления и агрегаты клеток крови, образующиеся при шоке, поступают в системную циркуляцию, повреждают альвеоло-капиллярную мембрану и приводят к патологическому повышению проницаемости легочных капилляров. При этом даже в отсутствие повышенного капиллярного гидростатического или уменьшенного онкотического давления через стенку легочных капилляров интенсивно проникает не только вода, но и плазменный белок. Это приводит к переполнению интерстициального пространства жидкостью, оседанию белка в эпителии альвеол и эндотелии легочных капилляров. Изменения в легких особенно быстро прогрессируют при проведении неадекватной инфузионно-трансфузионной терапии. Эти нарушения приводят к некардиогенному отеку легких, потери сурфактанта и спадению альвеол, развитию внутрилегочного шунтирования и перфузии плохо вентилируемых и невентилируемых альвеол с последующей гипоксией. Легкие становятся «жесткими» и плохо растяжимыми. Эти патологические изменения не сразу и не всегда определяются рентгенологически. Рентгенограммы легких первоначально могут быть относительно нормальными и часто ренгенологические проявления отстают от истинных изменений в легких на 24 часа и более.
Подобные изменения в легких первоначально упоминались как «шоковое легкое», а теперь обозначают терминами – «синдром острого повреждения легких» (ОПЛ) и «острый респираторный дистресс-синдром» (ОРДС). Между собой эти синдромы различаются лишь степенью выраженности дыхательной недостаточности. В хирургической практике они чаще всего развиваются у больных с септическим, травматическим и панкреатогенным шоком, а также при жировой эмболии, тяжелых пневмониях, после обширных хирургических вмешательств и массивных гемотрансфузий, при аспирациях желудочного содержимого и применении ингаляций концентрированного кислорода. Для острого респираторного дистресс-синдрома характерны следующие признаки:
При острых респираторных синдромах необходимо выявлять и лечить основное заболевание и проводить респираторную поддержку, направленную на эффективную оксигенацию крови и обеспечение тканей кислородом.
Мочегонные средства и ограничение объема вводимой жидкости у больных с острым респираторным дистресс-синдромом не оказывают никакого воздействия на степень отека легких и не дают положительного эффекта. В условиях патологической проницаемости легочных капилляров, введение таких коллоидных растворов как альбумин также не приводит к эффективному уменьшению внесосудистой воды в легких. Частота развития острых повреждений легких не изменилась и при использовании противоспалительных препаратов (ибупрофен) и антицитокиновой терапии (антагонисты рецептора ИЛ-1 и моноклональные антитела к фактору некроза опухоли).
Патологические изменения в легких можно уменьшить, если поддерживать минимальный уровень легочно-капиллярного давления, достаточный лишь для поддержания адекватного СВ, а ОЦК восполнять препаратами крахмала, которые уменьшают «капиллярную утечку». При этом уровень гемоглобина крови должен оставаться не ниже 100 г/л, чтобы обеспечить требуемую доставку кислорода к тканям.
Искусственная вентиляция легких (ИВЛ) с умеренным положительным давлением в конце выдоха позволяет поддерживать уровень PaO 2 выше 65 mm рт. ст. при концентрации кислорода во вдыхаемой смеси ниже 50%. Ингаляция через эндотрахеальную трубку более высоких концентраций кислорода может привести к вытеснению из альвеол азота и вызвать их спадение и ателектазы. Она может вызвать токсическое воздействие кислорода на легкие, ухудшать оксигенацию и приводить к образованию диффузных легочных инфильтратов. Положительное давление на выдохе предотвращает спадение бронхиол и альвеол и повышает альвеолярную вентиляцию.
Желудочно-кишечный тракт
Перераспределение кровотока, вызванное шоком, приводит к ишемии слизистой оболочки желудка и разрушению защитного барьера, предохраняющего ее от действия соляной кислоты. Обратная диффузия ионов водорода в слизистую оболочку желудка приводит к ее изъязвлению и часто сопровождается вторичным желудочным кровотечением. Для профилактики кровотечений необходимо остановить разрушение защитного барьера слизистой оболочки, проводя лечение шока и улучшая доставку кислорода к тканям. Кроме этого следует увеличить рН содержимого желудка. Уровень этого показателя выше 4 эффективно предотвращает желудочные кровотечения, а при рН выше 5 они почти никогда не возникают. С этой целью назначают блокаторы Н2-рецепторов гистамина и ингибиторы протонной помпы.
Целостность слизистой оболочки, без изменения кислотности содержимого желудка, поддерживают цитопротекторы. Суспензию сукральфата (1 г препарата растворяют в 10-20 мл стерильной воды) вводят в желудок через назогастральный зонд каждые 6-8 часов. Сукральфат сопоставим по эффективности с Н2-блокаторами и антацидами, в то же время препарат не влияет на бактерицидную активность желудочного сока, зависящую от величины рН. Большую роль в предотвращении образования стресс-язв в желуде играет зондовое энтеральное питание, особенно при введении препаратов непосредственно в кишечник.
Ишемия пищеварительного тракта ведет к повреждению энтероцитов и функциональной недостаточности кишечника. Следствием угнетения моторики служат нарушения эвакуации и скопление в просвете кишечника больших количеств жидкости и газов. Замедление пассажа химуса сопровождается резким изменением состава кишечной микрофлоры и интенсивным образованием токсических продуктов. Перерастяжение кишечной стенки усугубляет нарушения, вызванные ишемией энтероцитов, и сопровождается повышением кишечной проницаемости, транслокацией бактерий и токсинов через гликокаликс мембраны в кровь и лимфу. Кроме того, депонирование жидкости в просвете кишечника ведет к снижению ОЦК, усугубляя нарушения гемодинамики, свойственные шоку. Тем самым кишечник играет особо важную роль в патогенезе развития полиорганной дисфункции и несостоятельности у больных с шоком.
Основная функция кишки – всасывание питательных веществ – нарушается в тяжелых случаях до полного отсутствия. В этих условиях энтеральное питание не только не приводит к поступлению в кровь необходимых веществ, но усугубляет перерастяжение кишечной стенки и ее гипоксию.
Основные принципы лечения функциональной недостаточности кишечника:
Печень
Основные принципы лечения печеночной недостаточности:
Кровь
Кровь как ткань также повреждается при шоке. Нарушаются ее транспортная, буферная и иммунная функции, страдают системы свертывания и фибринолиза. При шоке всегда развивается гиперкоагуляция и происходит интенсивное формирование внутрисосудистых кровяных сгустков, образующихся преимущественно в микроциркуляторном русле. При этом потребляются ряд факторов свертывания крови (тромбоциты, фибриноген, фактор V, фактор VIII, протромбин) и их содержание в крови снижается, что приводит к значительному замедлению свертываемости крови. Одновременно с данным процессом в уже образовавшихся сгустках начинается ферментативный процесс распада фибриногена с образованием продуктов деградации фибриногена (ПДФ), которые обладают мощным фибринолитическим действием. Кровь совсем перестает свертываться, что бывает причиной значительных кровотечений из мест пункций, краев раны и слизистой оболочки желудочно-кишечного тракта.
Важную роль в нарушениях гемокоагуляции играет снижение концентрации антитромбина III и протеина С, поэтому целесообразна коррекция их дефицита. Коагулопатию корригируют введением свежезамороженной плазмы или отдельных факторов свертывания. Тромбоцитопения (менее 50 х 10 9/л) тре6ует переливания тромбоцитарной массы.
Прогрессирующее снижение содержания фибриногена и тромбоцитов в сочетании с повышением уровня продуктов деградации фибриногена и растворимых фибрин-мономеров, а также соответствующей клинической симптоматикой, должно быть основанием для диагноза синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдром) и начала специальной терапии. ДВС-синдром устранить очень трудно и более 50% больных погибают от продолжающегося кровотечения. Высокая летальность от данного феномена заставляет проводить профилактическую антикоагулянтную терапию у больных с шоком. Принципы лечения ДВС-синдрома изложены в отдельной главе.
Центральная нервная система.
Сердце
При шоке сердце является одним из органов, на которые ложится повышенная нагрузка по компенсации развивающихся нарушений. Увеличение интенсивности сердечной деятельности требует возрастания коронарного кровотока и доставки кислорода к самому миокарду. Между тем, длительная гипотензия и выраженная тахикардия всегда приводят к ухудшению перфузии венечных артерий, это в сочетании с метаболическим ацидозом и выделением специфических кардиальных депрессантов, ухудшает сократимость миокарда и вызывает дальнейшее понижение насосной функции сердца и развитие необратимого шока. Быстрее это развивается у больных с сопутствующей ишемической болезнью сердца. Развитие сердечной недостаточности требует применения инотропной поддержки.
Синдром полиорганной недостаточности
Чаще всего при шоке происходит серьезное нарушение функции не одного «органа-мишени», а сразу нескольких. Синдром, развивающийся при поражении двух и более жизненно-важных органов, носит название синдрома полиорганной недостаточности. Этим термином обозначают нарушение функций жизненно важных органов, при котором самостоятельное без медикаментозной коррекции поддержание гомеостаза невозможно. Его клинико-лабораторные проявления представлены сочетанием признаков повреждения отдельных органов, описанных выше. Вместе с тем полиорганная недостаточность не является простой суммой недостаточности различных органов. Нарушения деятельности отдельных органов и систем усугубляют друг друга, образуя новые «порочные круги» и ускоряя декомпенсацию. Нарушения гомеостаза при полиорганной недостаточности очень быстро принимают необратимый характер, поэтому развитие этого синдрома всегда является признаком терминальной стадии любого вида шока.
Критические резервы отдельных органов различны. Больной выживает при сохранении 15% нормальной функции печени, 25% функции почек, 35% количества эритроцитов и только 45% легочной ткани. Очень чувствителен человек к потере плазмы: потеря более чем 30% ее начального объема приводит к смерти. Поэтому инфузия жидкости особенно важна в начале лечения шока.
Источник: Основы клинической хирургии Практическое руководство под редакцией профессора Н.А.Кузнецова Издание 2-е, переработанное и дополненное Москва Издательская группа «ГЭОТАР-Медиа» 2009