Что значит протеолитические свойства
Когда желудку и кишечнику не хватает ферментов
Основным инструментом пищеварения являются ферменты, именно они выполняют всю основную работу. Логично, что при их недостатке процесс пищеварения нарушается, и организм начинает нам сообщать о проблемах, сигнализируя различными симптомами. Такие привычные всем симптомы как изжога, тяжесть в животе, боль, метеоризм, диарея или запор – являются прямым указанием на проблемы с пищеварением.
Ферменты поджелудочной железы – виды и функции
Пора узнать, что представляют собой ферменты, и как они влияют на пищеварение. Ферменты поджелудочной железы – это белковые комплексы или катализаторы, основной задачей которых является расщепление питательных веществ на простые, легкоусвояемые соединения. Таким образом, организм легко усваивает все необходимые элементы и витамины.
Какие ферменты вырабатывает поджелудочная железа и какие у них функции?
Особо интересно то, что организм может регулировать выработку тех или иных ферментов в зависимости от характера потребляемой пищи. То есть, если вы потребляете много хлебобулочных изделий, то упор в выработке будет сделан на амилазе, если потребляется жирная пища, то поджелудочная железа отправит в кишечник больше липазы.
Кажется, что работа полностью налажена, и сбоев быть не может. Но сбои случаются и достаточно часто: слишком тонкий механизм работы, который легко нарушить. Даже большой приём пищи с преобладанием жиров может сломать систему, и поджелудочная железа не сможет обеспечить нужное количество ферментов.
Появление проблем с пищеварением
Мы выяснили, что проблемы с пищеварением могут возникать из-за недостатка ферментов. Существует два основных механизма, при которых организму не хватает ферментов поджелудочной железы. В первом варианте проблема с выработкой ферментов кроется в самой поджелудочной железе, т.е. сам орган функционирует неправильно.
Во втором варианте нарушаются условия, при которых ферменты могут правильно работать. Подобное возможно в результате изменения кислотности среды кишечника, например, при воспалении или при изменении стандартной температуры окружения (36-37° С). Воспалительный процесс в кишечнике может возникать при различных состояниях: кишечные инфекции, аллергические реакции (пищевая аллергия, атопический дерматит).
Основные признаки нехватки ферментов поджелудочной железы
Выявить недостаток ферментов достаточно просто. Ключевыми симптомами являются тяжесть после еды, чувство распирания в животе и дискомфорт в животе. Нередко эти симптомы сопровождаются вздутием, урчанием, метеоризмом, диареей. Чаще всего такие симптомы могут возникать в рядовых ситуациях: при употреблении тяжелой, жирной пищи или при переедании, когда удержаться от множества вкусных блюд попросту не удалось. В этом случае не стоит бояться неполадок с поджелудочной железой или других заболеваний ЖКТ. Поджелудочная железа просто не справляется с большим объемом работы, и ей может потребоваться помощь.
Если нехватка ферментов и проблемы с пищеварением сохраняются длительное время, то это не остается незаметным для организма. Симптомы могут усугубляться и носить уже не эпизодический, а регулярный характер. Постоянная диарея дает старт авитаминозу, могут развиваться: белково-энергетическая недостаточность и обезвоживание во всем организме. Может наблюдаться значительное снижение массы тела. Помимо этого при тяжелых стадиях могут наблюдаться следующие симптомы недостатка ферментов поджелудочной железы 8 :
Поддержание пищеварения и лечение ферментной недостаточности
При проблемах с пищеварением могут помочь ферментные препараты (чаще они называются препаратами для улучшения пищеварения), основная задача которых компенсировать нехватку собственных ферментов в организме. Не зря такая терапия называется «ферментозаместительная». Критически важно, чтобы ферментный препарат максимально точно «имитировал» физиологический процесс.
На сегодняшний момент существуют различные препараты для улучшения пищеварения. Как же ориентироваться в многообразии средств и сделать правильный выбор?
Эффективный ферментный препарат должен соответствовать следующим критериям 5,6 :
ПРОТЕОЛИТИ́ЧЕСКИЕ ФЕРМЕ́НТЫ
Том 27. Москва, 2015, стр. 625
Скопировать библиографическую ссылку:
ПРОТЕОЛИТИ́ЧЕСКИЕ ФЕРМЕ́НТЫ (протеазы), группа ферментов класса гидролаз, катализируют внутри- и внеклеточное расщепление (протеолиз) пептидных связей C(O) ─ NH в белках и пептидах живых организмов. Выделяют две подгруппы П. ф.: экзопептидазы (пептидазы), отщепляют аминокислоты с аминного ( аминопептидазы ) или карбоксильного ( карбоксипептидазы ) конца молекулы белка или пептида; эндопептидазы (протеиназы; этот термин иногда используется также как синоним термина «П. ф.»), гидролизуют преим. внутр. пептидные связи. Большинство изученных П. ф. синтезируются в виде неактивных предшественников – проферментов, или зимогенов. Их активация происходит путём ограниченного протеолиза – избирательного гидролиза определённых пептидных связей, протекающего либо автокаталитически, либо под действием др. протеиназ, и обычно сопровождается отщеплением пептидов. П. ф. разнообразны по физико-химич. свойствам. В зависимости от локализации П. ф. протеолиз происходит при разл. значениях pH. Напр., пепсин и гастриксины желудка – при pH 1,5–2, ферменты лизосом – при pH 4–5, П. ф. сыворотки крови, тонкого кишечника – при нейтральных или слабощелочных значениях. Некоторые П. ф. в качестве кофактора используют ионы металлов (в т. ч. коллагеназа, термолизин). П. ф. имеют разную субстратную специфичность, которая определяется в осн. особенностями боковых групп аминокислот. Так, напр., трипсин гидролизует связи, образованные карбоксильной группой осно́вных аминокислот – лизина и аргинина, а эластаза – аминокислот с небольшими боковыми цепями – аланина и серина. На расщепление пептидных связей влияет также их доступность при наличии пространственной структуры гидролизуемого субстрата. Ферменты с узкой субстратной специфичностью (напр., коллагеназа, калликреин) гидролизуют пептидные связи, образованные строго определёнными аминокислотными остатками, ферменты с широкой субстратной специфичностью (в т. ч. пепсин, папаин) – связи, образованные многими аминокислотами. В плазме крови и др. биологич. жидкостях, а также в разных клетках и тканях присутствуют белковые ингибиторы П. ф., которые могут блокировать активность отд. ферментов или групп ферментов. Благодаря им осуществляется регуляция активности П. ф. в физиологич. условиях, что предохраняет белки от неконтролируемого расщепления.
Что значит протеолитические свойства
Одной из основных задач Национальной программы «Здоровье» основателем которого является Президент Туркменистана Гурбангулы Беодымухамедов – обеспечение населения страны лекарственными препаратами за счет лекарств отечественного производства,изучение возможности выращивания ценных лекарственных растений в условиях Туркменистана, разработка агротехники возделывания и обеспечение страны медицинскими препаратами и ценным сырьем для промышленности [1].
В современном мире большое внимание уделяется использованию в медицинской практике биологически активных препаратов растительного происхождения.
Мировая медицина ограничиваются от использования антибиотиков, так как снижается иммунная система и приводит к другим сложным последствиям. Ученые полагают, что в будущем антибиотики могут быть заменены супер-антителами, для которых не будет препятствием клеточная стенка, которые смогут проникать внутрь клеток и уничтожать болезнетворные бактерии, вирусы и токсины. Они испытывают технологию модификации антител, которая позволяет им свободно проникать в клетки и покидать их [1, 2–9, 12].
Авторы осознают, что при написании статьи не все задуманное удалось реализовать в полном объеме. Прекрасно понимают, что делают научный обзор по использованию лекарственных энзимов растительного происхождения в широком направлений, поэтому имеется недостатки как в теоретическом плане, так в прикладной, практической части. Но тем не мене вопрос использования нанотехнологии в генной инженерий и, прежде всего расшифровка геном человека позволяют создавать новые лекарственные препараты. Если будем лучше понимать роль генов в развитии болезней и то, как протекают процессы в наших клетках на наноуровне, сможем более целенаправленно вести исследования. С помощью генетики и биотехнологии сможем в будущем более эффективно выявлять причины заболеваний; тем самым исследования в области фармакология – это существенный шаг будет в деле создания инновационных лекарственных средств, устраняющих саму почину болезни. Большой интерес в этом предоставляют протеолитические ферменты растительного происхождения дынного древа [1–4].
Сделанный научно-информационый обзор, собранные материалы и методика подхода могут быть полезны для применения их не только в клинической медицине Туркменистана, но и в других странах мира.
Биотехнологические особенности дынного дерева
Лекарственное сырье. В качестве лекарственного сырья используют высушенный млечный сок – латекс. Коагулированные комья латекса крошат и высушивают на солнце или при легком искусственном подогревании (в последнем случае получают папаин более высокого качества). Полученный латекс растворяют в воде и осаждают спиртом для очистки папаина. В меньших количествах папаин содержится и в других частях растения, в частности в листьях (Folia Caricae Papayae) [2–4, 8–11].
Биологически активные вещества. Методом электрофореза в кислой среде в латексе Carica papaya L. идентифицировано 7 белков: липаза, хитиназа, лизоцим и комплекс протеолитических ферментов:
Папаин (EC 3.4.22.2) – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН 5) [2–4, 8–11, 17–20].
Химопапаин (EC 3.4.22.6) – монотиоловая цистеиновая протеиназа. Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью [2–4, 12, 13].
Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка (Buttle D. J. etc., 1989).Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Загрязнение этим ферментом химопапаина является причиной его гетерогенности в ходе исследований. M.P. Thomas и соавт. (1994) относят этот фермент к фракции химопапаина М [2–4, 8–11, 15, 16].
Карикаин (EC 3.4.22.30) – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, он сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Строение протеиназ папайи изучено с помощью рентгенструктурного анализа (Maes D. etc., 1996) [2–4, 11–18].
Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре (Dubois T. etc., 1988). Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Расщепление происходит тогда, когда в следующей позиции находятся лейцин, валин или треонин. Пептидаза ІІ – щелочная монотиоловая цистеиновая протеиназа. В каталитическом центре содержит дитиоацильную группу.
В латексе неспелых плодов папайи содержатся также ингибиторы протеолитических ферментов: цистатин (ингибитор протеиназ с молекулярной массой 11 262 Да) и белок со свойствами ингибитора цистеиновых протеиназ, молекула которого состоит из 184 аминокислотных остатков, содержит 2 дисульфидные связи и 2 углеводных остатка в позициях Asp84 и Asp90 (Odani S. etc., 1996) [2–4, 12–19].
В спелых плодах дынного дерева содержится 8–12 % сахара, значительное количество витаминов А, В1, В2, С и D, тонизирующие вещества. В листьях папайи выявлены свободные и связанные фенольные соединения, танины, органические кислоты и алкалоиды.
В листьях имеются свободные и связанные фенольные соединения, танины, органические кислоты, стероидные и тритерпеновые сапонины, флавониды, липиды, кумарины, глюкозы, альколоиды, применяемые при лечении туберкулеза и обладающие желче- и мочегонными свойствами [2–4, 11–20].
Фармакологические свойства. Эти протеолитические ферменты растительного происхождения обладают противовоспалительными, антикоголяционными, диградрационными, болеутоляющими, бактерицидными, гемолитивными свойствами. Данные ферменты широко применяются в медицинской практике: офтомологии, хирургии, нейрохирургии, ортопедии, урологии, гастроэнтрологии и др. Они способствуют разрушать белки полупепдидов и аминокислот, растворяют мертвые клетки, при этом не влияя на нормальные.
Модификация комплекса протеиназ папайи синтетическими полимерами. Изучение деструкции ферментных препаратов
Проблема повышения эффективности терапии во многом решается благодаря поиску новых лекарственных средств, важное место среди которых отводится модифицированным производным биокатализаторов с пролонгированным терапевтическим действием [6–8]. Как правило, модификацию ферментов выполняют с использованием растворимых полимеров. В Институте молекулярной биологии и биологической физики АН Грузинской ССР получены водорастворимые и биосовместимые производные полиуретанов и полиамидов [6]. Ранее уже была показана их пригодность для использования в качестве стабилизирующих фермент (трипсин, химотрипсин) носителей [12]. В настоящей работе изучена модификация этими полимерами терапевтически значимого ферментного препарата – комплекса протеиназ папайи [12, 13].
С целью определения целесообразности дальнейшего медико-биологического испытания модифицированных ферментов проведено сравнительное изучение их деструкции под действием экстремальных рН и протеаз. Сопоставление данных о целостности набора молекул ферментного препарата (на основе результатов молекулярно-массового распределения и его каталитической активности) позволяет не только оценить влияние носителя на лекарственный агент, но и сформулировать рекомендации для фармакологического исследования модифицированных препаратов биокатализаторов.
В своей научной статье А.В. Максименко, Л.А. Надирашвили, В.В. Абрамова, Г.С. Еркомаишвили, Р.Д. Кацарава, В.П. Торчилин «Модификация комплекса протеиназ папайи синтетическими полимерами. Изучение деструкции ферментных препаратов» проведённых в Институт экспериментальной кардиологии Всесоюзного кардиологического научного центра АМН СССР и Институт фармакохимии имени И.Р. Кутателадзе АН Грузинской ССР, Тбилиси.
В статье авторами описана химическая модификация комплекса протеиназ папайи синтетическими полимерами – полиамидом, полиуретаном. Изучены свойства модифицированных ферментных препаратов: показана их устойчивость к протеолизу при физиологических условиях и деструкция в щелочной области рН. Модификация комплекса протеиназ папайи усиливает влияние цистеина на стабильность модифицированных препаратов. Осаждение их при кислых значениях рН позволяет легко отделять биокатализатор от реакционной смеси. Обсуждаются перспективы дальнейшего исследования полученных производных.
Условия проведения эксперимента
Реагенты. Нативный препарат комплекса протеиназ папайи (КПЛ) из млечного сока дынного дерева был выделен и охарактеризован по описанному методу [6, 7]. Полимерные носители были получены из Института физиологии им. И.С. Бериташвили АН Грузинской ССР. Ими были водорастворимый полиамид с молекулярной массой 50–60 кД.
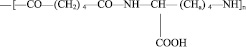
и полиуретан с молекулярной массой 45–50 кД [4]
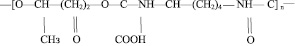
Этиловый эфир N-бензол-L-аргинина (ВАЕЕ), L-цистеин, «субтилизин Карлсберг» произведены фирмой Sigma (США). Проназа Е, N-этил-3-(3-диметиламинопропил) карбодиимид, 3-меркапто-1,2-пропандиол – производства фирмы Serva (ФРГ); сефадексG-75 superfine получен от фирмы Pharmacia (Швеция). Все остальные реагенты – продукты производства «Реахим» (СССР) аналитической степени чистоты.
Ковалентное присоединение КПЛ к полимерным носителям. Связывание ферментного препарата с карбоксилсодержащими полимерами проводили через карбодиимидную активацию в соответствии с [8]. 20 мг носителя (полиамида или полиуретана) растворяли в 2 мл 0,01 М раствора трис-буфера, рН 8,0. Затем добавляли 1 мл того же буферного раствора, содержащего 2,5 мг карбодиимида. Смесь инкубировали в течение 30 мин при 4°, после чего добавляли 1 мл раствора того же буфера, содержащего 10 мг нативного КПЛ и 2,5 мг цистеина (для сравнения были выполнены эксперименты и без цистеина в реакционной смеси). Дальнейшую инкубацию проводили в течение 20 ч при 4°. Препараты выделяли методом ультрафильтрации на установке «Amicon» (США) с фильтром ХМ-30, проводя отмывку дистиллированной водой до постоянной оптической плотности промывных вод (220 нм). После этого препараты лиофилизовали. Сравнительное определение молекулярной массы производных проводили методами гель-хроматографии и электрофореза.
Изучение деструкции ферментных препаратов. За деструкцией полимерных образцов cледили, сопоставляя профили элюции проб инкубационной смеси с колонки сефадекса G-75 [9]. Инкубацию препаратов проводили в 0,1 М трис-буфере, рН 7,4 и 0,1 М боратном буфере, рН 9,6, при 30° как в отсутствие, так и в присутствии протеаз – проназы или субтилизина. Концентрация в инкубационной смеси нативного препарата 1 мг/мл, модифицированных – 1–3 мг/мл; проназы 0,2 мг/мл, субтилизина 0,1 мг/мл; носителей (1 мг/мл). Оптическую плотность проб элюата для нативного и модифицированных препаратов регистрировали при 280 нм, для полимерных носителей – при 208 нм.
Определение каталитической активности. Каталитическую активность ферментных препаратов определяли методом измерения начальных скоростей гидролиза 0,05 М раствора ВАЕЕ с 0,1 М КС1 на рН-стате «Radiometer» (Дания) при рН 7,0 и комнатной температуре.
Влияние сульфгидрильных реагентов на каталитическую активность ферментных препаратов исследовали измерением последней до и после (в течение 5 ч) добавления 10 мг/мл меркапто-пропандиола (1 мМ) к растворам биокатализаторов [6].
Измерение термостабильности ферментных препаратов. Растворы нативного и модифицированного полиамидом или полиуретаном (10 мг/мл) комплекса протеиназ папайи инкубировали при 37 °С в 0,1 М буферных растворах, рН 7,4 или рН 9,6, в присутствии 6 мг/мл и в отсутствие цистеина. Периодически отбирали пробы из инкубационной смеси (0,2 мл) и определяли на рН-стате их каталитическую активность, как описано выше.
Титрование сульфгидрильных групп ферментных препаратов. Эксперимент проводили по методу Эллмана [10], как описано ранее [7]. Титрант – 5,5-дитио-бис-2-нитробензойная кислота (получен от фирмы Calbiochem, США), коэффициент экстинкции 13 600 М•см–1 [6, 7, 12. 13].
В результате получены:
Свойства препаратов комплекса протеиназ папайи, модифицированного синтетическими полимерами. В результате ковалентного присоединения КПЛ к полиамиду или полиуретану с носителем связывается около 90 % исходного количества белка (как в присутствии, так и в отсутствие цистеина в инкубационной смеси). Однако проведение модификации в присутствии цистеина обеспечивает получение препаратов с большей величиной остаточной каталитической активности, чем без этой аминокислоты. Так, для препаратов КПЛ-полиамид, полученных с цистеином и без него, остаточная каталитическая активность составляет 70 и 50 %, соответственно, а для КПЛ-поли- уретан – 70 и 20 %. Данные титрования сульфгидрильных групп в ферментных препаратах показывают, что, по-видимому, ковалентного присоединения цистеина к полимерной матрице не происходит (табл. 1). Цистеин способствует только реактивации обратимо инактивированных ферментов [6], повышая, как уже говорилось, остаточную каталитическую активность модифицированных препаратов.
Каталитические параметры – ферментативного гидролиза ВАЕЕ нативным и модифицированным комплексами протеиназ папайи (0,1 М KCI, рН 7,0, комнатная температура)
Протеолитические ферменты
Содержание
Протеолитические ферменты в спортивной медицине (обзор литературы) [ править | править код ]
Протеолитические ферменты на медицинском и фармацевтическом рынке [ править | править код ]
Наиболее часто встречаемые на рынке варианты комбинированных составов с протеазами приведены в таблице 1.
Таблица 1. Основные активные ингредиенты некоторых типовых комбинированных препаратов протеолитических ферментов на фармацевтическом рынке США и Европы [5]
Примечания: *1 μkat – количество фермента, которое превращает более 1 μM субстрата в секунду при стандартных условиях. Это соответствует 60 F.I.P – единиц. Ph. Eur.-ед протеиназы – протеиназные единицы действия по Европейской Фармакопее. Рутозид (рутин, кверцетин-3-О-рутинозид, софорин) — гликозид флавоноида кверцетина.
Как видно из таблицы 1, в большинстве случаев при формировании состава комбинированных протеолитических препаратов используются растительные протеазы цистеина – бромелайн (обязательный компонент) и папаин, а также протеазы серина животного происхождения – трипсин и химотрипсин. Некоторые составы включают панкреатин, амилазу, липазу и/или рутозид. Популярной формой выпуска являются кишечнорастворимые таблетки, покрытые оболочкой, для обеспечения наибольшей концентрации активных веществ в кишечнике (предотвращение распада таблетки в кислой среде желудка). Дозировки ферментов варьируют в диапазоне от 1 до 200 мг/таблетку. Количество протеаз в дозе на прием соответствует ферментной активности, описанной в F.I.P. (F.I.P.-units of the Federation Internationale Pharmaceutique). Одна F.I.P.-единица – количество фермента, которое способно конвертировать более 1 мкмол субстрата за 1 минуту при стандартных условиях.
Происхождение, химическая структура, классификация и свойства протеолитических ферментов [ править | править код ]
Растительные протеазы. [ править | править код ]
Протеазы дынного дерева [ править | править код ]
В соответствии с данными А.М.Пенджиева и А.Абдуллаева [2] «высушенный млечный сок (латекс) дынного дерева содержит ряд протеаз: Папаин – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН=5), что важно при часто встречающихся у спортсменов нарушениях кислотного состава желудка. Химопапаин – монотиоловая цистеиновая протеиназа. Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью. Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка. Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Карикаин – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, карикаин сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре. Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Для стабилизации комплекса протеиназ папайи с практическими целями используются специальные полимеры, разработанные еще во времена существования СССР.
Протеазы ананаса [ править | править код ]
Протеазы животного происхождения [ править | править код ]
Фармакокинетика протеолитических ферментов [ править | править код ]
Абсорбция ПФ в желудочно-кишечном тракте и их биологическая активность [ править | править код ]
В обзорной работе G.Lorkowski [5] суммированы имеющиеся данные по абсорбции протеолитических ферментов в ЖКТ после их перорального приема, фармакокинетике ПФ и даны возможные объяснения механизмам этих процессов. Ранние исследования абсорбции протеаз у животных были выполнены путем перорального приема ферментных субстратов, меченых радиоактивными изотопами. Другим методом было количественное определение в плазме крови собственной эстеразной активности протеаз в отношении специфических субстратов, например, этилового эфира N-бензолил-L-аргинина (BAEE) как субстрата для трипсина, а этилового эфира N-ацетил-L-тирозина (ATEE) как субстрата для химотрипсина, а уровня гемоглобина – для оценки общей протеолитической активности. Экспериментальные исследования показали, что абсорбция протеолитических ферментов зависит от множества факторов, среди которых наиболее важным является размер молекулы. В серии экспериментальных работ J.Seifert и соавторов [15] [16] было показано, что после перорального приема (рис.1) меченых йодом-123 таких протеолитических ферментов как трипсин, химотрипсин, панкреатин и папаин, наблюдается постепенное нарастание концентрации протеолитических ферментов в крови, дифференцированное по времени и количественным параметрам в зависимости от конкретного протеолитического фермента. Прием панкреатина вызывал наибольший прирост концентрации фермента в сыворотке крови с максимумом в течение часа. В течение последующих 6-и часов происходило плавное снижение его концентрации. Для других протеолитических ферментов (трипсин, химотрипсин и папаин) максимальная концентрация в сыворотке крови достигалась только к 3-ему часу после перорального применения и была существенно ниже (в 3 и более раз) по сравнению с панкреатином. Характерно, что через 6 часов для всех ферментов уровень их концентрации в крови (в процентном соотношении с их введенной дозой на 1 г крови) был примерно одинаковым.
Детальные количественные характеристики изменений показателей ПФ в крови даны в таблице 2.
Таблица 2. Количественный анализ абсорбции ферментов в кишечнике крыс в сыворотку крови и лимфу (из J.Seifert и соавт., 1990).
Общий уровень абсорбции, (%) *
Общий уровень абсорбции (мг)
Низкомолекулярная часть (мг)
Абсорбция бромелаина при интрадуоденальном введении в экспериментах на крысах существенно отличалась от таковой других протеолитических ферментов. Как видно из рис.2, происходит медленное (по сравнению с другими ПФ) нарастание концентрации бромелаина в сыворотке крови и лимфе в течение 4 часов (максимум) и поддержание этих величин до 6-и часов наблюдения. В данной работе уровень абсорбции бромелаина определен в 50% от введенной дозы за 6 часов, при этом 80% составила высокомолекулярная фракция.
Фармакокинетика ПФ у человека [ править | править код ]
Таблица 4. Линейная зависимость максимальных уровней ПФ в плазме крови испытуемых в соответствии с перорально принимаемой суточной дозой ферментных препаратов [20] [21] [22]
Примечания: ДД – дневная доза (г); МКП – максимальная концентрация в плазме (нг/мл).
15 добровольцев получали кишечно-растворимые таблетки, каждая из которых содержала 200 мг бромелайна. Четверо испытуемых служили контролем (плацебо). В течение 1-го дня осуществлялось шесть приемов бромелаина: 3 таблетки в 8.00 утра (время «ноль» для исследования); в 11.00; 14.00; 17.00 и 20.00, а затем 5 таблеток в 23.00. Такой же режим соблюдался на 2-ой день. На 3-ий день осуществлялся только дин прием 3-х таблеток в 8.00. Стандартные приемы пищи производились в: 9.00; 12.00; 15.30 и 18.30. Образцы крови (12 мл) брались каждый раз перед приемом бромелаина. У большинства участников Смакс отмечалась через 48 часов и составляла в среднем 5 нг/мл, Т1/2 в плазме около 6 часов. AUC за период 3-51 часов составила 82,2 нг/час/мл.
В другой работе коллективом авторов из Института клинической фармакологии в Берлине (Германия) [20] [21] [22] (табл.4) выявлена четкая дозозависимость концентрации бромелаина, трипсина и папаина в плазме крови от введенной суточной дозы фермента, что еще раз подчеркивает, что протеолитические ферменты являются фармаконутриентами, т.е. сочетают способность влиять на нутритивные процессы подобно фармакологическим агентам.
Подводя итоги выполненным исследованиям фармакокинетики протеолитических ферментов, G.Lorkowski [5] в своем аналитическом обзоре делает следующее заключение: «Прием протеолитических ферментов обеспечивает усвоение организмом физиологически активных протеинов с высоким молекулярным весом. Фармакокинетические исследования показывают дозозависимое линейное нарастание концентрации протеаз в различных средах организма, варьирующее в достаточно широких индивидуальных пределах, медленную динамику абсорбции в кишечнике, быстрое и 100% связывание в организме с антипротеазными комплексами. Пероральный прием протеолитических ферментов увеличивает протеазную активность сыворотки крови с параллельным возрастанием концентрации в плазме крови соответствующих антипротеаз. Биологическая протеолитическая активность пероральных ПФ определяется взаимодействием с соответствующими рецепторами на поверхности клеток (протеаз-активируемые рецепторы) как в виде свободных протеаз, так и в комплексной форме с антипротеазами. Такой комплекс «протеаза-антипротеаза» вызывает возрастание плазменных концентраций антипротеаз и элиминацию самих комплексов и цитокинов. Эти механизмы реализуются при приеме внутрь протеолитических ферментов в виде кишечнорастворимых таблеток с содержанием растительных и животных протеаз, и обеспечивают стабилизацию и, возможно, улучшение физиологических и иммунологических процессов даже у здоровых лиц. Последнее обстоятельство приобретает особый смысл в спортивной медицине.
Протеолитические ферменты – катализаторы высвобождения аминокислот (АК) из протеинов [ править | править код ]
Сходным образом (рис.5), 150 мг Игнитора в 2 раза усиливает высвобождение лейцина из WPC по сравнению со смесью пепсина и панкреатина, и в 2,5 раза – по сравнению только с эндогенными ферментами. Почти такое же преимущество (рис.6) имел Игнитор и в плане высвобождения ВСАА в целом: в 2 раза активнее смеси пепсина и панкреатина, и в 2,25 раза – эндогенных ПФ.
Замена WPC на изолят (WPI) привела примерно к таким же результатам: 100 мг Игнитора высвобождало в 4 раза больше лейцина, в 3,25 раза больше ВСАА и в 2,25 раза больше глутамина по сравнению с эндогенными ПФ.
Таким образом, смесь протеаз различного происхождения при совместном приеме с whey-протеинами (WPC, WPI) увеличивает и оптимизирует во времени высвобождение из белков ВСАА и глутамина с последующей активацией mTOR, что определяет анаболическую эргогенную активность протеолитических ферментов (ПФ). Эргогенное действие ПФ носит опосредованный характер и проявляется при выборе оптимального соотношения общего количества и качества поступающего белка, собственной активности эндогенных ПФ и количества и протеолитических свойств экзогенных ПФ в составе препаратов и БАДов. Конечным эффектом оптимального приема пищевых добавок протеинов и ПФ в сочетании с силовыми тренировками является увеличение синтеза белка в скелетных мышцах, увеличение размеров мышечных волокон, повышение силы и мощности мышц.
Для повышения эффективности высвобождения ВСАА и глутамина из белка делают комбинированные формы WP и ПФ, в котором уже рассчитаны дозы ферментов, необходимые для оптимального расщепления протеинов (например, Isoject – сочетание изолята WP и Игнитора).
Протеолитические ферменты как фармаконутриенты для предупреждения и лечения EIMD и DOMS [ править | править код ]
В более ранней работе P.C.Miller и соавторов [29] изучено влияние добавок ПФ на DOMS и функцию мышц у бегунов-мужчин (возраст 18-29 лет) в параллельных группах сравнения в холмистой местности (бег под уклон). Комбинированный БАД с протеолитическими и другими ферментами применялся в виде капсул. Каждая капсула содержала 325 мг ферментов поджелудочной железы, 75 мг трипсина, 50 мг папаина, 50 мг бромелаина, 10 мг амилазы, 10 мг липазы, 10 мг лизозима и 2 мг химотрипсина и принималась испытуемыми в течение 4-х дней по 2 капсулы 4 раза в день на пустой желудок за 30 минут до приема пищи в 200 мл воды. В контрольной группе участники получали плацебо в капсулах идентичного вида. Весьма важно, что данный вид бега вызывает достаточно ощутимые микроповреждения мышечных волокон и DOMS. Авторы работы показали, что пероральный прием протеаз редуцирует отсроченные мышечные боли, вызванные физическими нагрузками, что сопровождается ускорением восстановления и улучшением общего настроения и самочувствия у физически активных мужчин. При этом выявлена определенная закономерность: восстановление контрактильной способности мышц происходит быстрее при низкой и средней скоростях бега, чем при высокой скорости. Исследования P.C.Miller и соавторов [29] имеют вполне конкретную прикладную направленность. Лица, впервые начинающие тренировочный процесс без опыта физической подготовки, или пациенты, проходящие курс реабилитации после хирургического вмешательства, особенно при отсутствии консультаций специалиста по ОФП, имеют высокую вероятность развития DOMS. Последняя, в свою очередь, прерывает процесс восстановления или существенно его замедляет. Пищевые добавки ПФ – один из оптимальных способов лечения таких состояний, который снижает боли, ускоряет восстановление мышц. В результате возрастает объем и эффективность тренировочной работы, ускоряется восстановление после травм и операций.
Побочные эффекты перорального приема протеолитических ферментов [ править | править код ]
Грибковые протеазы – новое направление в создании ферментных фармаконутриентов для спортивной медицины [ править | править код ]
Развитие данного направления связано с выделением и изучением группы протеаз грибкового происхождения (Aspergillus niger и Aspergillus oryzae) в виде патентованной формулы Aminogen®. J.Oben и соавторы [33] провели исследование в двух группах здоровых мужчин (n=21, возраст 19-35 лет, ИМТ 20-24, физическая активность в рамках программы бодибилдинга). В течение первых 9 дней участники принимали (на фоне стандартизированной сбалансированной диеты в 2200 ккал/день, 40% углеводов, 25% белка и 35% жиров) 50 г концентрата WP (WPC), затем 50 г WPC с добавлением либо 2,5 г, либо 5 г Аминогена (Aminogen®, Triarco Industries,Wayne, NJ). WPC представлял собой порошок с содержанием 85% протеина, 6% жира, 3% неорганических веществ и 6% лактозы. На каждом этапе исследования (каждые 30-60 минут) брались образцы крови для оценки уровней аминокислот и С-реактивного белка в крови. Результаты показали, что в группах, получавших дополнительно грибковые протеазы, уровень всех аминокислот был через 4 часа после приема пищевых добавок достоверно выше, чем в контроле (увеличение площади под кривой AUC – «время-концентрация»). На фоне ферментов достоверно снижался С-реактивный белок по сравнению с контрольной группой, улучшался азотистый баланс. Авторы сделали заключение, что Аминоген усиливает переваривание белка в ЖКТ и скорость всасывания аминокислот (в 2,2-3,5 раза). Не прослеживалось достоверной связи между дозой ферментов и конечным результатом, что позволяет рассматривать дозу Аминогена 2,5 г как адекватную и достаточную. С практической точки зрения это означает, что грибковые протеазы, с одной стороны, повышают эффективность переваривания белка и всасывание аминокислот в среднем в 2,5 раза (растет уровень аминокислот в плазме крови), а с другой, организм получает возможность потребления дополнительного количества белка, который в обычных условиях не может быть переработан и усвоен собственными эндогенными протеазами (адекватный, т.е. усвояемый, однократный объем белка в обычных условиях – 15 г, на фоне ферментов – 30 г и более). В свою очередь, это приводит к снижению риска белковой перегрузки и вероятности диспептических явлений и желудочно-кишечного дискомфорта. Снижение уровней С-реактивного белка может вносить вклад в торможение процессов воспаления при физических нагрузках, уменьшение негативных последствий чрезмерного мышечного напряжения и ускорение восстановления в постнагрузочный период.
Исследования последних десяти лет позволили сформулировать концепцию полимодальности механизма действия протеолитических ферментов (ПФ) животного, растительного и комбинированного происхождения в спортивной медицине. Условно этот механизм складывается из двух взаимодополняющих частей: усиление и ускорение переваривания белка в ЖКТ и системное антипротеолитическое действие (снижение воспаления, уменьшение EIMD и DOMS. Основные положения этих направлений могут быть сформулированы следующим образом:
Применение ферментов позволяет использовать более приятные по органолептическим свойствам белковые смеси, содержащие нативные высококачественные протеины (например, WP, а не гидролизаты WPH). Такой подход (ферментирование белков «in vivo») является альтернативой промышленной ферментативной обработке белков до поступления в организм. При этом образование и абсорбция ВСАА (в частности, лейцина) в количественном плане идентичен эффективности уже ферментированных белков или добавок ВСАА в составе смесей.
В спорте высших достижений, где в подавляющем большинстве случаев имеет место относительная ферментная недостаточность, обусловленная большим объемом поступления белка (в составе диеты, функциональной пищи или добавок протеинов различного происхождения), задачей ферментных препаратов является адекватное переваривание дополнительных протеинов. Соответственно, расчет потребности в экзогенно вводимых ферментах осуществляется, исходя из имеющегося превышения возрастной нормы потребления белка, антропометрических показателей спортсмена и реальной физической нагрузки в процессе тренировок и соревнований, функционального состояния кислотообразующей и ферментообразующей функции ЖКТ.








