Что значит пространственная конфигурация
Пространственная конфигурация молекул и ионов



Молекула должна иметь пирамидальную форму: в вершине пирамиды – атом азота, угол между связями – 90°. Однако экспериментально измеренный угол составляет
Перекрывание орбиталей в молекуле NH3 показано на рис. 14.
46.Фосфор, нахождение в природе. Электронная конфигурация атома в основном и валентно-возбуждённом состоянии. Получение элементарного фосфора. Отношение фосфора к кислотам и щелочам. Фосфины.
Электронная конфигурация фосфора:[Ne] 3s2 3p3, в возбужд состоянии [Ne]3s1 3p3 3d1
Получение: Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Са3(РО4)2 + 5С + 3SiO2 = 2P + 5СО + 3СаSiO3
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту: 4HPO4+10C=P4+2H2O+10CO
Отношение фосфора к кислотам и щелочам:
1. P+H2SO4=H3PO4+SO2(c р-й не реагирует)
3. Ba(OH)2 + P= PH3 + Ba(H2PO2)2 +H2O
4.Окисление Р при поджигании спичек 6Р+5KClO3=5KCl+3P2O5
Получают PH3 взаимод. фосфидов (напр., Cu3P2) с водой или к-той; наряду с PH3 образуются небольшие кол-ва P2H4. Его синтезируют также р-цией белого P с р-ром щелочи при нагр., взаимод. KOH с PH4I в водном р-ре. PH3 образуется при получении белого и красного P; при действии к-т на фосфиды металлов (напр., при травлении сталей, содержащих заметную примесь P); при использовании цианамида Ca, загрязненного Ca3(PO4)2, и ацетилена, полученного из фосфорсодержащего карбида (содержание PH3 в C2H2 иногда достигает 0,02-0,06%); при применении вместо извести карбидных отходов от получения ацетилена. Используют PH3 для синтеза фосфорорг. соед., для получения фосфора особой чистоты (2PH3+ 2PCl3 
47. Фтор. Нахождение в природе. Получение в промышленных и лабораторных условиях. Соединения фтора и их свойства. Гидрофториды.
Нахождение в природе: в минерале флюорите (CaF2) плавиковый шпат.
Получение в промышленности: электролизом расплава кислого фторида калия KF•2HF
2KHF2=(электролиз) Н2 + F2 + 2KF
Встречается в виде малорастворимых солей апатита, топаза, полевого шпата
Получение в лабораторных условиях:
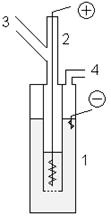
1) электролизом: В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
2) Метод Карла Кристе: 2K2MnF6 + 4SbF5 = 4KSbF6 + 2MnF3 + F2↑
(данный метод не имеет практического применения)
3)можно использовать нагрев фторида кобальта (III) до 300 °С
4)разложение фторидов серебра (слишком дорого)
Соединения фтора и их свойства:
Свойства: а) при высокой температуре подвергается гидролизу
CaF2 + H2O = CaO + 2HF
б) разлагается концентрированной серной кислотой
СaF2 + H2SO4 = CaSO4 + 2HF↑
в)при избытке HF образует сложный кристаллогидрат:
CaF2 + 2HF + 6H2O = Ca(HF2)2 * 6H2O
Свойства :а) фторбораты металлов разлагаются при нагреве по реакции:
H(BF4) + MeCO3 = Me(BF4) + CO2 + H2O
2. С неметаллами (Р, S):
1. С азотом и кислородом напрямую фтор не реагирует.
2. От водородных соединений фтор отнимает протон:
Фтористый кислород может быть получен по реакции:
Гибридизация атомных орбиталей. Геометрия молекул
Урок 10. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Гибридизация атомных орбиталей. Геометрия молекул»
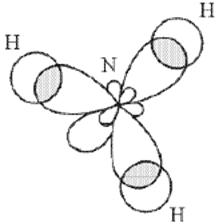
В образовании ковалентных связей принимают участие как эс-, так и пэ-электроны, орбитали которых имеют различную форму и направленность в пространстве.
Связи, которые образуются между ними, являются равноценными и расположены симметрично.
Это явление объясняется на основе концепции гибридизации атомных валентных орбиталей. Согласно концепции, в образовании химической связи принимают участие гибридные орбитали, то есть это орбитали, усреднённые по форме и размерам, а, следовательно, и по энергии. Число гибридных орбиталей равно числу исходных.
Гибридные орбитали более вытянуты в пространстве, а это обеспечивает их более полное перекрывание с орбиталями соседних атомов.
Из-за своей симметрии гибридные орбитали не участвуют в образовании пи-связи, так как не могут обеспечить перекрывание между собой в двух областях пространства.
Основными условиями устойчивой гибридизации являются:
Первое, в гибридизации могут участвовать орбитали с близкими значениями энергий, то есть эс-, пэ-орбитали внешнего энергетического уровня и дэ-орбитали внешнего или предвнешнего уровня;
второе, гибридная атомная орбиталь должна более плотно перекрываться с орбиталями другого атома при образовании связи;
третье, в гибридизации участвуют орбитали с достаточно высокой электронной плотностью, которыми в большинстве случаев являются орбитали элементов начальных периодов;
четвёртое, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга.
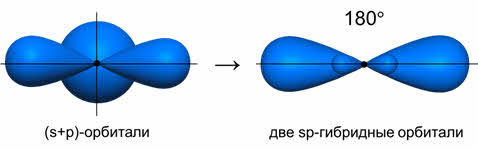
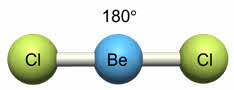
Ориентация гибридных орбиталей определяет геометрическую структуру молекулы. При комбинации одной эс- и одной пэ-орбитали возникает две эс-пэ-гибридные орбитали, расположенные симметрично под углом сто восемьдесят градусов.
Связи, образованные с участием электронов этих орбиталей, также располагаются под углом сто восемьдесят градусов.
Например, у атома бериллия эс-пэ-гибридизация орбиталей проявляется в молекуле хлорида бериллия, которая вследствие этого имеет линейную форму.
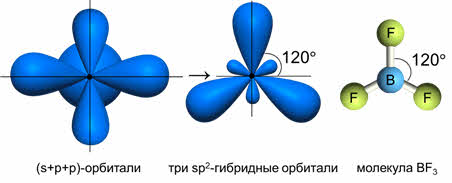
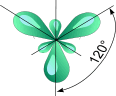
Комбинация трёх орбиталей (одной эс- и двух пэ-орбиталей) приводит к образованию трёх эс-пэ-два гибридных орбиталей, расположенных под углом сто двадцать градусов, как в молекуле фторида бора.
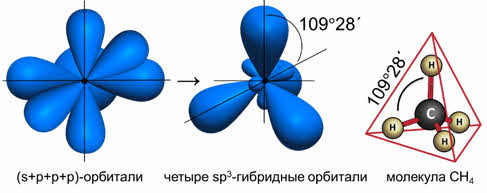
Комбинация четырёх орбиталей (одной эс- и трёх пэ-типа) приводит к эс-пэ-три гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырём вершинам тэтраэдра, то есть под углом сто девять градусов двадцать восемь минут, как в атоме углерода в молекуле метана.
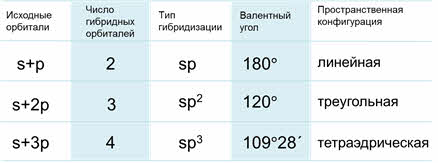
Таким образом, если исходными орбиталями являются эс- и пэ-, то образуется две гибридные орбитали, возникает гибридизация эс-пэ типа, связи при этом расположены под углом сто восемьдесят градусов, в пространстве молекула имеет линейное строение.
Если исходные орбитали одна эс и две пэ-орбитали, то образуется три гибридных орбитали, тип гибридизации при этом эс-пэ-два, валентный угол равен сто двадцать градусов, а форма молекулы треугольная.
Если в гибридизации участвуют одна эс и три пэ-орбитали
то образуется четыре гибридных орбитали, возникает эс-пэ-три гибридизация, валентный угол при этом сто девять градусов двадцать восемь минут, а форма молекулы тэтраэдрическая.
Основные характеристики разных типов гибридизации
Пространственное строение молекул или ионов зависит от типа гибридизации и взаимного расположения в пространстве гибридизированных орбиталей.
Часто в молекулах углы между связями отличаются от углов, соответствующих типу гибридизации. Почему же так происходит?
Во-первых, геометрическая конфигурация молекул определяется в основном пространственной направленностью сигма-связей. Устойчивому состоянию молекулы соответствует такое пространственное расположение электронных облаков валентного слоя, при котором их взаимное отталкивание минимально. Поэтому такие электронные пары стремятся максимально оттолкнуться друг от друга, располагаясь в пространстве под возможно большим углом.
Основными причинами отклонений углов связей от углов, соответствующих типу гибридизации являются:
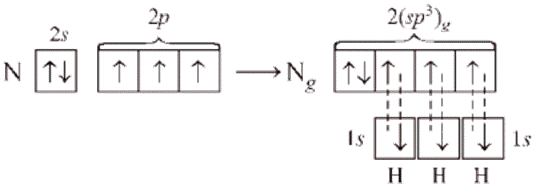
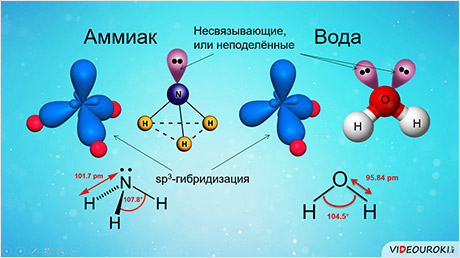
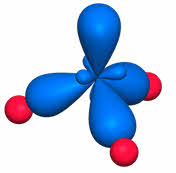
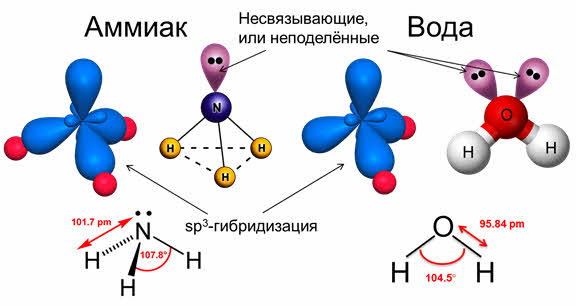
во-первых, не все гибридные орбитали участвуют в образовании связей, часть из них – несвязывающие. Электронные пары, находящиеся на этих орбиталях, называются несвязывающими, или неподелёнными. Так, в молекуле аммиака у атома азота одна пара электронов – не связывающая, в молекуле воды у атома кислорода две пары электронов являются несвязывающими.
Связывающая электронная пара локализована между атомами и поэтому занимает меньше пространства, чем электронное облако несвязывающей пары. Поэтому отталкивающее действие несвязывающей пары проявляется в большей мере, чем связывающей. В молекуле воды и аммиака у атомов азота, и кислорода один и тот же тип гибридизации атомных орбиталей – эс-пэ-три. Однако из-за наличия одной у азота и двух у кислорода несвязывающих пар электронов идеальный угол для этого типа гибридизации, равный сто девять градусов двадцать восемь минут, уменьшается до ста семи градусов у аммиака и ста четырёх с половиной у воды.
Второй причиной отклонений углов связей является наличие пи-связей, которые влияют на величину валентного угла, но это не сказывается на типе гибридизации и геометрии молекулы.
Предполагают, что электронные пары кратной связи занимают ту же область пространства, что и электронная пара простой связи. Суммарное электронное облако кратной связи занимает больший объём пространства, чем одинарной и поэтому обладает большим отталкивающим действием.
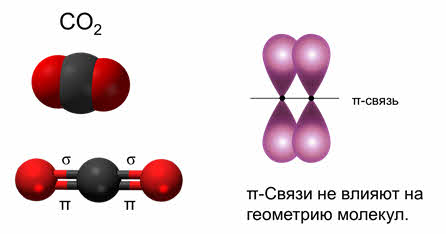
Так, в молекуле углекислого газа две ковалентные связи одинарные, так как являются сигма-связями, а две другие связи – это пи-связи. Пи-связи не влияют на геометрию молекул, поэтому в пространстве молекула углекислого газа имеет линейное строение, и здесь эс-пэ-тип гибридизации.
Виды геометрических конфигураций
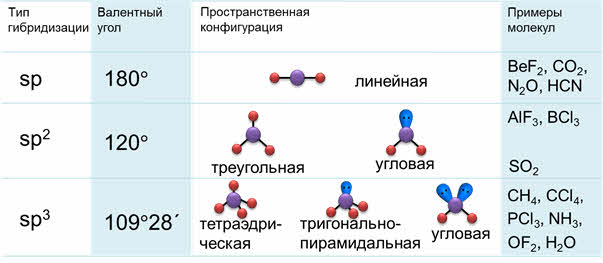
Молекулы с эс-пэ-гибридизацией имеют линейное строение. Валентный угол при этом сто восемьдесят градусов. К таким молекулам относятся фторид бериллия, молекула углекислого газа, оксида азота один, синильной кислоты.
В молекулах с эс-пэ-два-гибридизацией валентный угол сто двадцать градусов, форма молекулы может быть треугольной, как у фторида алюминия, хлорида бора, так и угловой, как у молекулы оксида серы четыре.
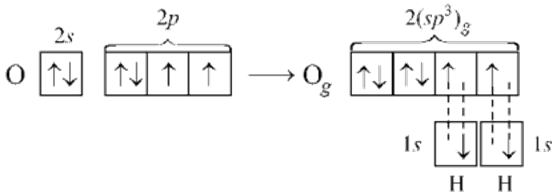
В молекулах с эс-пэ-три-гибридизацией валентный угол сто девять градусов двадцать восемь минут. Молекулы могут иметь тэтраэдрическое строение, как молекула метана, тэтрахлорметана, а также тригонально-пирамидальное строение, как у хлорида фосфора три, аммиака, или угловое строение, как у фторида кислорода и воды.
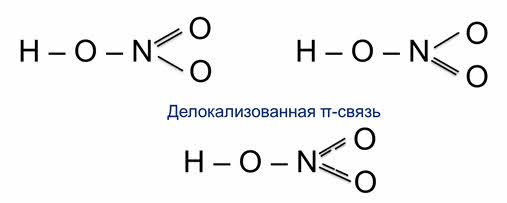
Иногда строение многих молекул нельзя изобразить такой одной графической формулой, потому что истинные свойства молекулы оказываются промежуточными между теми, которые отражаются в каждой отдельной схеме. Так, строение молекулы азотной кислоты можно изобразить двумя равнозначными графическими формулами. Так как в этой молекуле два атома кислорода равноценны, строение молекулы лучше отражает графическая формула с дэлокализованной пи-связью. Пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями. Эта электронная пара принадлежит не двум, а трём атомам, поэтому образованная таким образом связь является трёхцентровой.
Таким образом, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга. Гибридные орбитали участвуют в образовании только сигма-связи.
Геометрия любой молекулы определяется пространственной направленностью сигма-связью. На пространственное строение молекулы оказывают влияние несвязывающие пары электронов, которые уменьшают углы связей между сигма-связями.
Пространственная структура молекул



Пространственная структура молекул зависит от пространственной направленности перекрывания электронных облаков числом атомов в молекуле и числом электронных пар связей за счет неподеленных электронов. Существует несколько типов связи. Связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью. Сигма-связь может возникать при перекрывании s-орбиталей, s и р-орбиталей, d-орбиталей, а также d и s-орбиталей, d и p-орбиталей и f-орбиталей друг с другом и другими орбиталями. Сигма-связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью. Она имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов. Это исключает возможность образования пространственных изомеров.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью (дельта-связь). Соответственно s-элементы могут образовывать только σ-связи; р-элементы – σ и p-связи, d-элементы – δ, p и σ-связи, а f-элементы – δ-, p-, σ- и еще более сложные связи. В связи с меньшим перекрыванием атомных орбиталей прочность у p- и δ-связей ниже, чем у σ-связей.
При наложении p-связи на σ-связь образуется двойная связь, например в молекулах кислорода (О = О), этилена (СН2 = СН2), диоксида углерода (0 = С = 0). Хотя энергия p-связи меньше, чем энергия σ–связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи.
При наложении двух p-связей на σ-связь возникает тройная связь, например в молекулах азота (N ≡ N) и ацетилена (СН ≡ СН). Энергия тройной связи выше, а длина связи меньше, чем энергии и длины простой и двойной связей. Число связей между атомами называется кратностью связи. Каждая кратная связь всегда содержит только одну σ-связь. Число σ-связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. Например, в молекуле NH3 и ионе NH4 + для атома азота оно равно трем и четырем соответственно.
Образование σ-связей фиксирует пространственное положение атомов относительно друг друга, поэтому число σ-связей и углы между линиями связи, которые называют валентными, определяют пространственную геометрическую конфигурацию молекул и комплексных ионов, что находит отражение в соответствующих моделях.
Связи, образованные атомом за счет орбиталей с различным значением орбитального квантового числа, должны быть энергетически неравноценными, что, однако, не подтверждается экспериментом. Противоречие устраняется идеей гибридизации, предложенной Л. Полингом (1901). Гибридизацииейназывают образование одинаковых по энергии и форме орбиталей атома в результате сложения различных по энергии и форме орбиталей при возбуждении этого атома. При этом орбитали разной симметрии смешиваются и переходят в гибридные атомные орбиталиодинаковой формы и одинаковой усредненной энергии, что обеспечивает равноценность образуемых ими связей.
Возможность гибридизации определяют три условия:
1) Небольшая разница в энергии исходных атомных орбиталей, с увеличением этой разницы уменьшается устойчивость их гибридного состояния и прочность образуемых ими связей.
2) Достаточная плотность электродных облаков, что определяется значением главного квантового числа.
3) Достаточная степень перекрывания атомных орбиталей с огрбиталями других атомов при образовании связей, что закрепляет гибридное состояние и делает его более устойчивым.
Число гибридных орбиталей равно числу исходных. При смешении s и р-орбиталей образуется две sp-гибридных орбитали, угол между осями которых равен 180°.
 | ¾® |  |
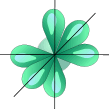
Две sp-орбитали могут образовывать две s-связи (BeH2, ZnCl2). Еще две s-связи могут образоваться, если на двух p-орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2). Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию.
 | ––® |  |
 | ––® |  |
Форма гибридных атомных орбиталей отличается от формы исходных. В гибридной атомной орбитали электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с атомной орбиталью другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями прочнее, а полученная молекула – более устойчива.
Геометрическая конфигурация молекул полностью определяется типом гибридных орбиталей центрального атома только при условии, что все гибридные атомные орбитали участвуют в образовании связей. Если хотя бы на одной из них остается неподеленная электронная пара, то конфигурация, определяемая типом гибридизации, реализуется не полностью (табл. 2).
Возможная геометрическая конфигурация
| Число неподеленных пар | Число σ-связей | Геометрическая конфигурация | Примеры |
| Тетраэдр | СН4 | ||
| Тригональная пирамида | NН3 | ||
| Угловая | Н2О | ||
| Линейная | КВr |
Таким образом, пространственная структура молекул зависит от типа гибридизации центрального атома и числа неподеленных пар. Образование p-связей стабилизирует состояние молекулы.
Гибридизация атомных орбиталей и пространственная конфигурация молекул. Полярность молекул
Обычно атомы формируют связи за счет электронов разных энергетических состояний. Например, у бериллия Ве в образовании связи принимают участие s— и p-электроны. Несмотря на различные формы электронных облаков связи равноценны и расположены симметрично. Как же неравноценные по исходному состоянию электроны образуют равноценные связи? Ответ дает теория гибридизации. Гибридизация – процесс, в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии.
Гибридные орбитали асимметричны и обуславливают более сильное перекрывание с орбиталями других атомов, по сравнению с негибридными, что приводит к образованию более прочной химической связи, а следовательно, более устойчивой молекулы.
Понятие гибридизации необходимо, когда связи образуются электронами центрального атома, принадлежащими различным подуровням.
Расположение гибридных орбиталей в пространстве
при различных типах гибридизации
| Тип гибридизации: | sp | sp 2 | sp 3 |
| Расположение гибридных орбиталей в пространстве |  |  |  |
| Теоретический валентный угол | 180 о | 120 о | 109 о |
Разберем вопрос о пространственной структуре молекулы. Пространственная структура молекулы связана с типом гибридизации и расположением боковых атомов вокруг центрального атома (табл. 3.2).
Пространственная структура молекул
при различных типах гибридизации
| Тип гибри- дизации | sp | sp 2 | sp 3 | sp 3 | sp 3 | ||
| Простран- ственная структура молекулы |  
| 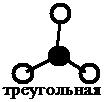 |  |  |  |
В качестве примера рассмотрим молекулу CdI2. Выписываем валентные электроны центрального атома 48Cd и валентные электроны йода 53I:
 |
Для образования связей с двумя атомами йода необходимо 5s электроны центрального атома перевести в возбужденное состояние.
 |
Таким образом, Cd предоставляет на связь два неспаренных электрона на s- и р-подуровне, у йода имеется один неспаренный электрон на р-подуровне. Следовательно, согласно Льюису, молекула CdI2 выглядит следующим образом:

Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис. 3.5.
Рис. 3.5. Процесс sp-гибридизации
Образование молекулы происходит за счет перекрывания полученных гибридных орбиталей центрального атома с валентными орбиталями соседних атомов. «Подводя» валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 3.6).
I Cd I
Рис. 3.6. Линейная конфигурация молекулы CdI2
Из рис. 3.6 следует, что рассматриваемая молекула CdI2 имеет линейную форму и две ковалентные связи σ-типа, так как область перекрывания орбиталей находится по оси, соединяющей ядра атомов. Связь Cd–I является полярной, поскольку более электроотрицательным элементом является йод.
Молекула CdI2 неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются.
Выписываем валентные электроны центрального атома – кислорода 2s 2 2p 4 и валентные электроны фтора 2s 2 2p 5
Так как у атома кислорода в четырех орбиталях имеются лишь два неспаренных электрона, то он может образовать две связи.
У фтора имеется один неспаренный электрон. По представле-ниям Льюиса, молекула OF2 может быть изображена следующим образом:

Рис. 3.7. Угловая конфигурация молекулы OF2
Связи О–F – полярные, поскольку разность электро-отрицательностей составляет |4,0–3,5|=0,5. Молекула в целом тоже полярна, так как в вершине угла заряд со знаком «+», а в противоположной стороне «–». Происходит оттягивание электронов в сторону F, т.е. образуется диполь. Две связи О–F – ковалентные, σ-типа.
Установление типа гибридизации центрального атома и пространственной структуры молекулы соответствует определенному алгоритму.
Алгоритм определения типа гибридизации:
1) определить валентные электроны центрального атома;
2) если возможно и необходимо, изобразить возбужденное состояние атома;
3) изобразить связи с использованием формулы Льюиса;
4) провести сам процесс гибридизации (смешение, выравнивание атомных орбиталей) и определить тип гибридизации;
5) нарисовать оси, по которым расположить гибридные атомные орбитали;
6) указать неподеленные пары электронов;
7) показать образование связей в молекуле перекрыванием гибридных атомных орбиталей центрального атома с атомными орбиталями других атомов.
Определив пространственную структуру молекулы, можно приступить к оценке полярности молекулы.
Следует отличатьполярность молекул от полярности связи. Для двухатомных молекул эти понятия совпадают. Для многоатомных молекул полярность оценивается исходя из:
1) полярности отдельных связей, которая учитывается по разности электроотрицательностей соединяющихся атомов либо по величине электрического момента диполя,
2) пространственной конфигурации молекулы, так как дипольный момент молекулы равен сумме векторов дипольных моментов всех связей и неподеленных пар электронов. Результат сложения зависит от конфигурации молекулы, если молекула симметрична, то она неполярна (даже если связи полярны).
3.3. Ионная связь. Механизм образования и свойства ионной связи
Ионы – положительно или отрицательно заряженные частицы, обладающие подвижностью в водных растворах.
Ионы, образующиеся из атомов, называют простыми, из групп атомов – сложными.
По характеру заряда их разделяют на анионы и катионы.
Примеры простых и сложных катионов и анионов
Ионная связь – это связь между элементами, легко образующими ионы, основанная на электростатическом взаимодействии.

 |  |  |
прочность ненаправленность ненасыщаемость полярность
Ионная связь менее прочная, чем ковалентная. Ионы можно представить как жесткие, несжимающиеся шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве (рис. 3.8).
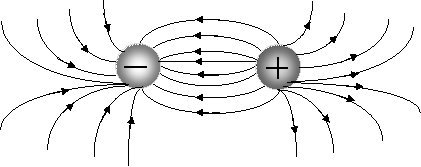 |
 |
Рис. 3.8. Распределение электрических силовых полей двух разноименных ионов
Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, следовательно, ионная связь ненаправленаиполярна.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей и сохраняется способность притягивать дополнительные ионы, следовательно, ионная связь ненасыщаема.
Соединения с ионной связью имеют кристаллическую структуру и обладают низкой температурой плавления. Соединения, образованные из простых ионов, малочисленны, это соединения типичных металлов с типичными неметаллами, например NaBr, CsCl, KF, RbCl.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.